胃上部与胃中下部早期癌的临床病理特征比较研究
2022-03-16丁超杜宝峰陈梅红陈涵党旖旎陆昱司新敏
丁超, 杜宝峰, 陈梅红, 陈涵, 党旖旎, 陆昱, 司新敏
胃癌发病率在全球癌症谱中居第5位,是全球癌症相关死亡的第三大原因[1]。早期胃癌(early gastric cancer, EGC)是指肿瘤浸润局限于黏膜层及黏膜下层,不论病灶范围大小及有无淋巴结转移。肿瘤临床分期是影响胃癌转归及预后的重要因素,EGC患者行内镜黏膜下剥离术(endoscopic submucosal dissection, ESD)或外科手术治疗后预后较好[2]。ESD是治疗浅表性胃肠道癌(包括食管癌、胃癌和结肠癌)的微创、有效的方法[3]。
近年来,胃癌总体发病率在全球范围内逐渐下降,但是胃上部癌的发病率却呈逐年上升趋势[4]。有研究表明,与胃中下部早期癌(middle-lower third early gastric cancer,M-LGC)相比,胃上部早期癌(upper third early gastric cancer,UGC)的肿瘤直径更大、未分化癌比例更高、5年生存率更低,其原因可能与胃解剖、复杂的淋巴系统及手术中的操作难度相关[5];但也有研究显示,胃上部癌中的分化癌占比较胃中下部癌更高[6]。上述研究提示胃上部癌与胃中下部癌具有不同的生物学或临床病理特征。然而,这些研究中大多数病例是晚期胃癌,关于ESD治疗UGC与M-LGC的对比研究尚少见。本研究选取行ESD治疗的EGC患者379例,通过比较UGC与M-LGC患者的临床病理特征及病灶内镜下特征,以期指导临床诊断和治疗。
1 对象与方法
1.1 研究对象
选择2016年1月至2020年5月于南京医科大学第一附属医院消化内科行ESD治疗且术后病理确诊为EGC的患者379例。根据肿瘤发生部位分为M-LGC组(199例)与UGC组(180例)。纳入标准:①病历资料完整,且愿意配合完成资料收集。②既往无胃切除手术史。③术前经影像学检查提示无淋巴结转移,超声内镜检查提示病灶未侵犯黏膜下层。④符合日本第5版胃癌指南内镜治疗胃癌的绝对适应证:直径≤2 cm的黏膜内癌(cT1a),分化型癌,UL0;直径>2 cm的黏膜内癌(cT1a),分化型癌,UL0;直径≤3 cm的大体可见的黏膜内癌(cT1a),分化型癌,UL1。扩大适应证:直径≤2 cm的大体可见的黏膜内癌(cT1a),未分化型,UL0[7]。⑤首次接受ESD治疗,术后病理诊断为EGC且未合并其他恶性肿瘤。排除标准:①术后病理为高级别上皮内瘤变(high-grade intraepithelial neoplasia,HGIN)或者低级别上皮内瘤变(low-grade intraepithelial neoplasia,LGIN);②患有同时性多发早期胃癌(synchronous multiple early gastric cancer,SMEGC);③同时接受食管ESD者。本研究经医院伦理委员会批准,患者及家属均知情同意。
1.2 方法
1.2.1 基本资料收集 收集患者年龄、性别、吸烟史、饮酒史、高血压病史、糖尿病史、冠心病史、胃溃疡史、胃肠道手术史、肿瘤家族史,以及是否合并慢性萎缩性胃炎、肠上皮化生等基本资料。
1.2.2 胃镜检查 记录患者肿瘤切除位置、肿瘤直径、巴黎分型、组织学类型、肿瘤浸润深度。依据第15版《日本胃癌规约》[8]划分为UGC组和M-LGC组。参照国际抗癌联盟(Union for International Cancer Control, UICC)和美国癌症联合会(Union for International Cancer Control, AJCC)颁布的第8版TNM分期方法[9]进行病理分期、淋巴结转移和胃壁浸润深度评估,本组患者均为TNM Ⅰ期。浅表病灶由巴黎分型[10]分3型:0-Ⅰ型,隆起性病变;0-Ⅱ型,浅表性病变;0-Ⅲ型,凹陷型病变。组织学类型分为两类:分化型(高、中分化腺癌)和未分化型(低、未分化腺癌)。肿瘤直径以肿瘤最大直径计。
1.2.3 ESD治疗 患者全麻下气管插管,奥林巴斯GIF-H260Z放大观察病灶,确定病灶边界后更换GIF-Q260J治疗胃镜,沿病灶边缘0.5 mm处标记,黏膜下注射生理盐水+玻璃酸钠+靛胭脂混合液,病灶抬举良好,用一次性黏膜切开刀沿标记点外做环周切开,行黏膜下剥离,直至病灶完整剥离,创面用热活检钳、止血夹充分止血,随镜取出标本,固定后送检。行ESD操作者均为副主任医师以上及ESD切除标本结果由同一位病理医师复阅。
1.2.4 疗效判定 短期疗效:①整块切除。病灶在内镜下整块切除,并获得单块标本。②完全切除。病灶水平和垂直切缘均为阴性的整块切除。③治愈性切除。病灶整块切除、垂直切缘与水平切缘阴性、无脉管浸润且满足以下条件的EGC:直径>2 cm,无溃疡的分化型黏膜内癌;直径≤3 cm,可伴溃疡的分化型黏膜内癌;直径≤2 cm,无溃疡的未分化型黏膜内癌;直径≤3 cm,分化型浅层黏膜下癌;④出血。包括急性术中出血和迟发性出血。⑤穿孔。长期疗效:①复发,指术后6个月以上原切除部位以及周围1 cm内发现肿瘤病灶。②死亡。
1.2.5 随访 自ESD后第1天开始随访,截至2020年12月31日,中位随访时间29个月。ESD后第3、6、12个月于门诊复查胃镜+活检、腹部CT,以后每年复查1次。随访过程中发现肿瘤复发则根据个人情况行内镜下治疗或外科手术治疗。
1.3 统计学方法

2 结果
2.1 UGC组与M-LGC组患者基本资料比较
UGC组年龄≥60岁、男性比例高于M-LGC组,合并慢性萎缩性胃炎、肠上皮化生比例低于M-LGC组,差异有统计学意义(P<0.05);两组吸烟史、饮酒史、高血压史、糖尿病史、冠心病史、胃溃疡史、胃肠道手术史及肿瘤家族史差异均无统计学意义(P>0.05),见表1。
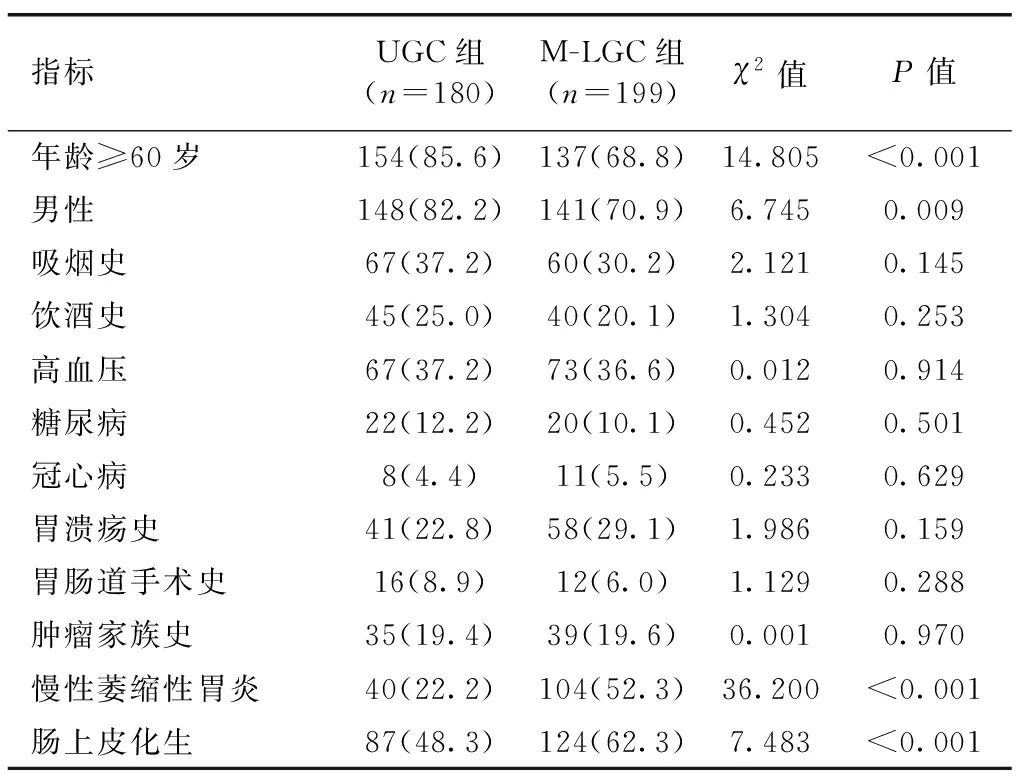
表1 UGC组与M-LGC组患者基本资料比较 [例(%)]
2.2 UGC组与M-LGC组患者病理特征比较
两组巴黎分型、组织学类型、黏膜下浸润、淋巴结转移差异有统计学意义(P<0.05),肿瘤直径和治愈性切除差异无统计学意义(P>0.05),见表2。
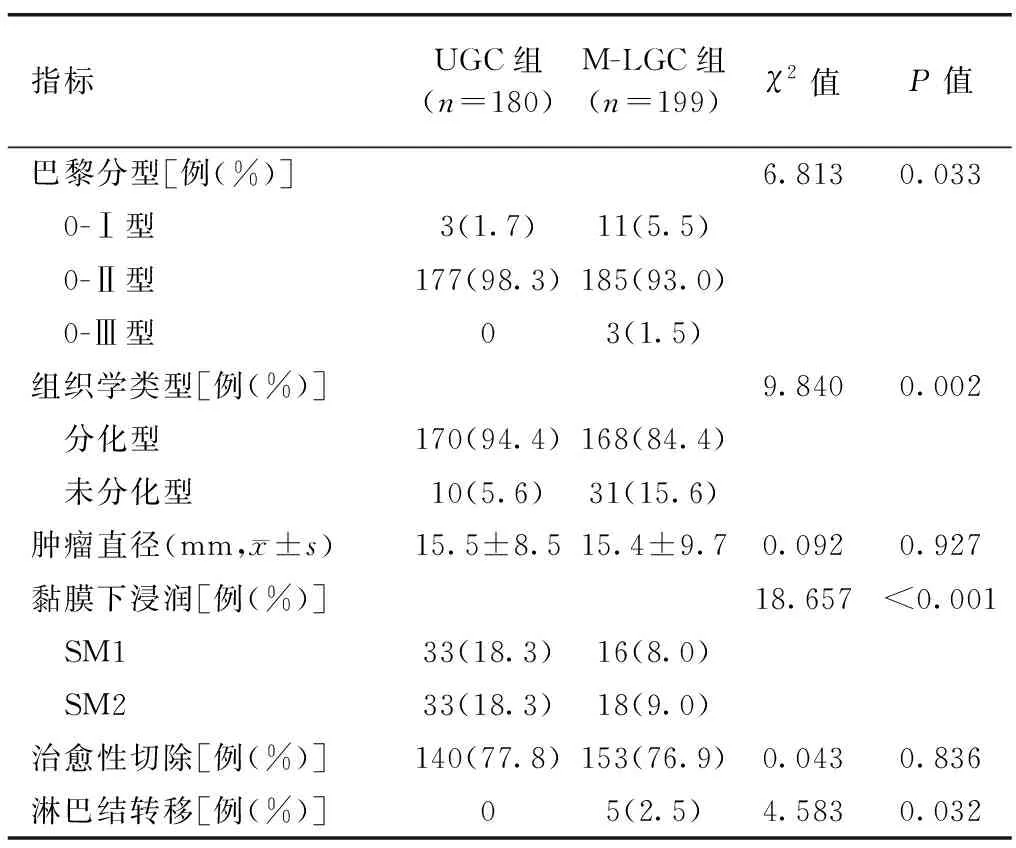
表2 UGC组与M-LGC组患者病理特征比较
2.3 UGC与M-LGC黏膜下浸润组的临床病理特征比较
UGC组有黏膜下浸润者66例(UGC浸润组),M-LGC组有黏膜下浸润者34例(M-LGC浸润组)。UGC浸润组慢性萎缩性胃炎、组织学类型为未分化型、淋巴结转移比例均低于M-LGC浸润组,差异有统计学意义(P<0.05);两组其他基本资料及临床病理特征差异均无统计学意义(P>0.05),见表3。
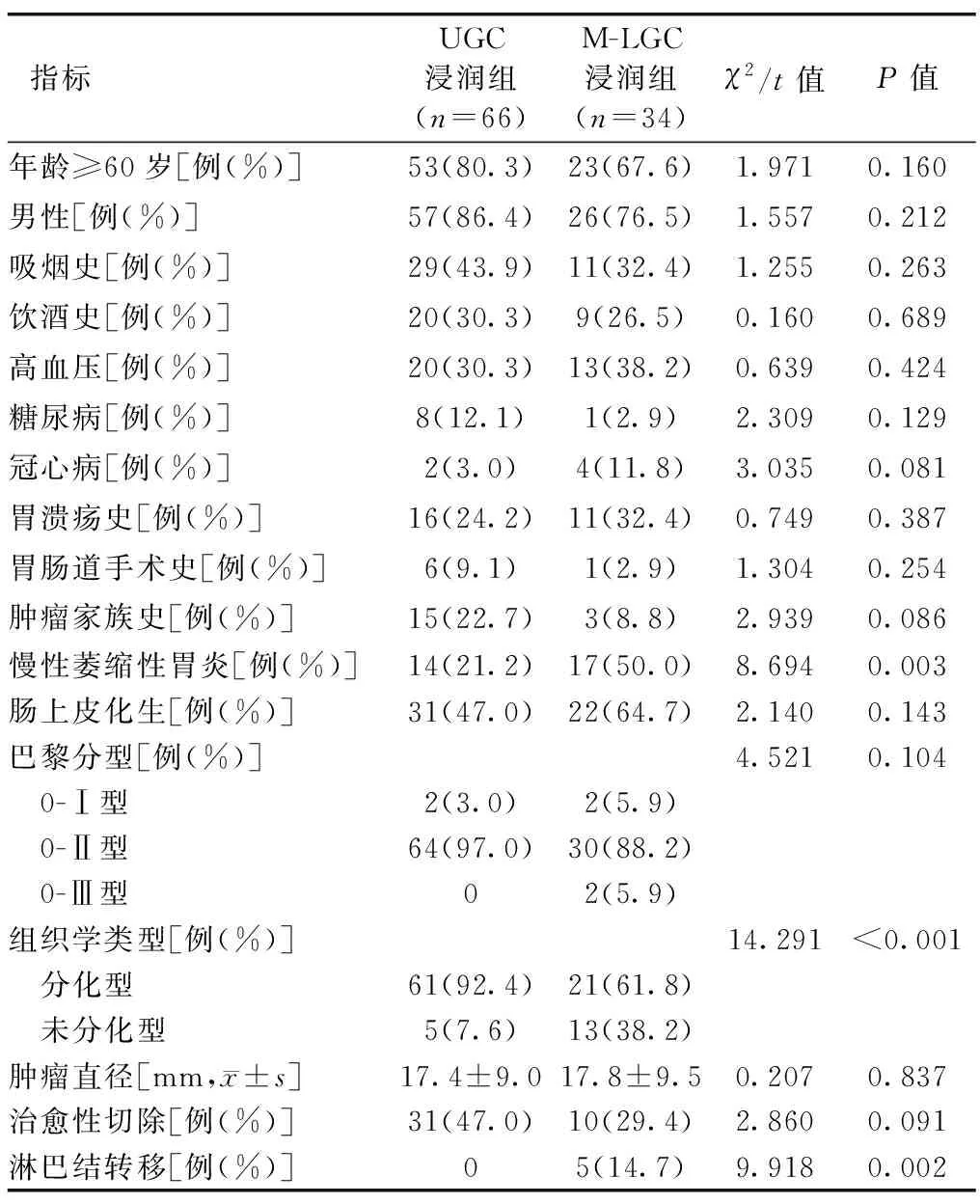
表3 UGC浸润组与M-LGC浸润组的临床病理特征比较
2.4 EGC黏膜下层浸润的影响因素分析
以EGC黏膜下层浸润(是=1,否=0)为因变量,以年龄(年龄≥60岁=1,年龄<60岁=0)、性别(男=1,女=0)、慢性萎缩性胃炎(是=1,否=0)、肠上皮化生(是=1,否=0)、肿瘤位置(胃上部=1,胃中下部=0)、组织学类型(未分化型=1,分化型=0)、淋巴结转移(是=1,否=0)为自变量进行单因素及多因素Logistic回归分析。结果均显示,肿瘤位于胃上部、组织学类型为未分化类型、有淋巴结转移是EGC黏膜下浸润的独立危险因素,见表4。
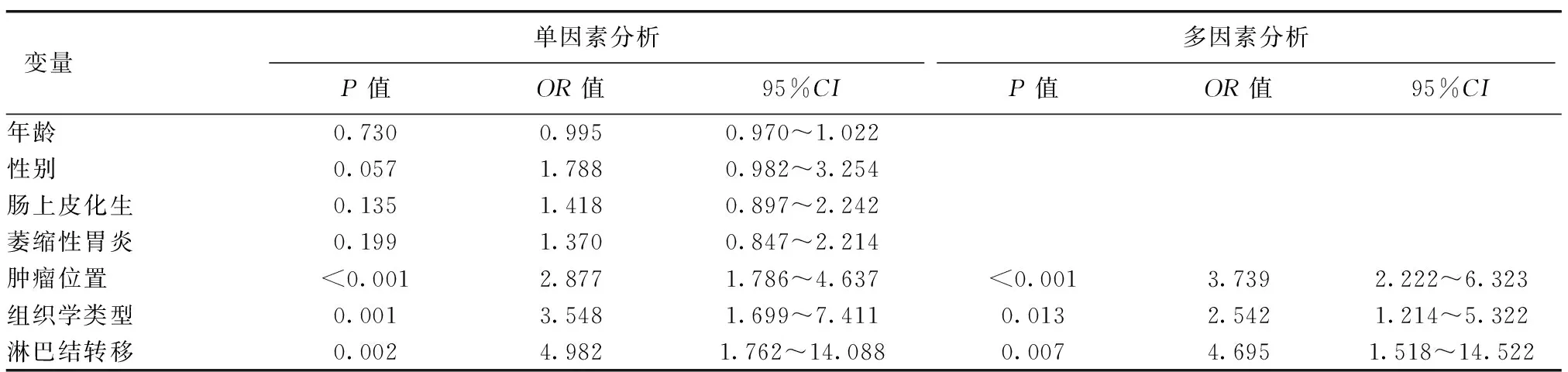
表4 EGC黏膜下浸润影响因素的Logistic回归分析
2.5 M-LGC及EGC患者发生淋巴结转移的危险因素分析
UGC组中有26例患者因非治愈性切除追加外科手术,术后病理结果均未提示有淋巴结转移;M-LGC组有33例患者因非治愈性切除追加外科手术,术后病理提示有8例发生淋巴结转移。以是否有淋巴结转移(是=1,否=0)为因变量,以年龄(年龄≥60岁=1,年龄<60岁=0)、性别(男=1,女=0)、吸烟史(是=1,否=0)、饮酒史(是=1,否=0)、胃溃疡史(是=1,否=0)、胃肠道手术史(是=1,否=0)、肿瘤家族史(是=1,否=0)、黏膜下浸润(是=1,否=0)、组织学类型(未分化型=1,分化型=0)为自变量进行单因素及多因素Logistic回归分析。结果均显示,肿瘤黏膜下浸润、组织学类型为未分化型是M-LGC组淋巴结转移的独立危险因素;肿瘤黏膜下浸润及组织学类型为未分化型亦是EGC淋巴结转移的独立危险因素,见表5、6。
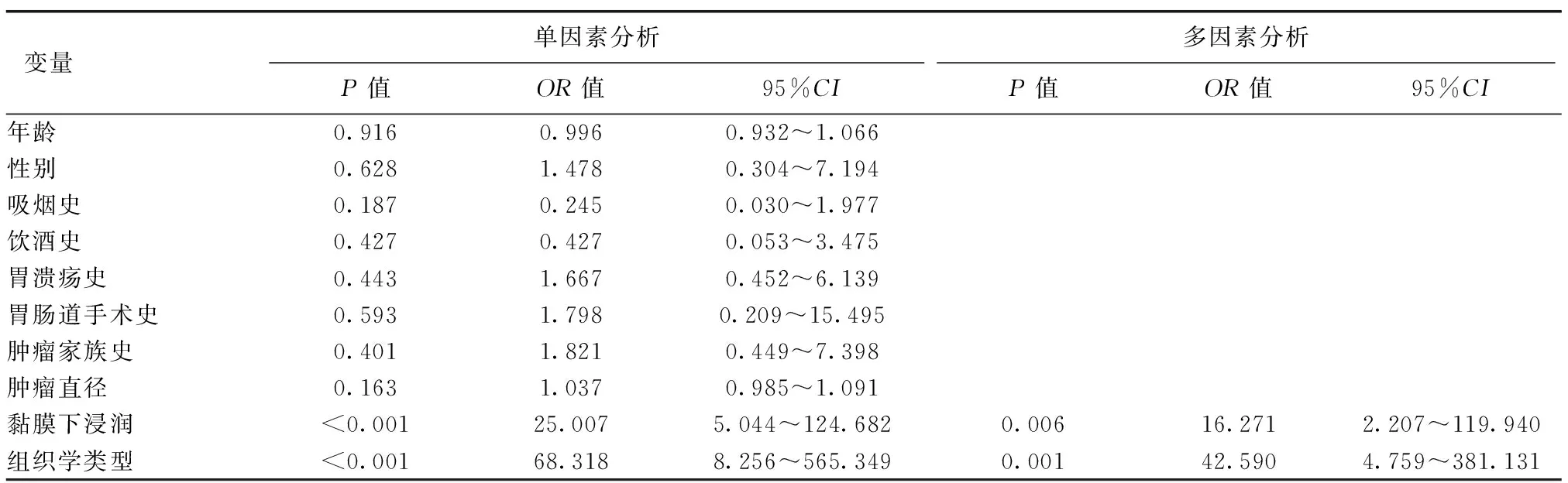
表5 M-LGC组淋巴结转移影响因素的Logistic回归分析
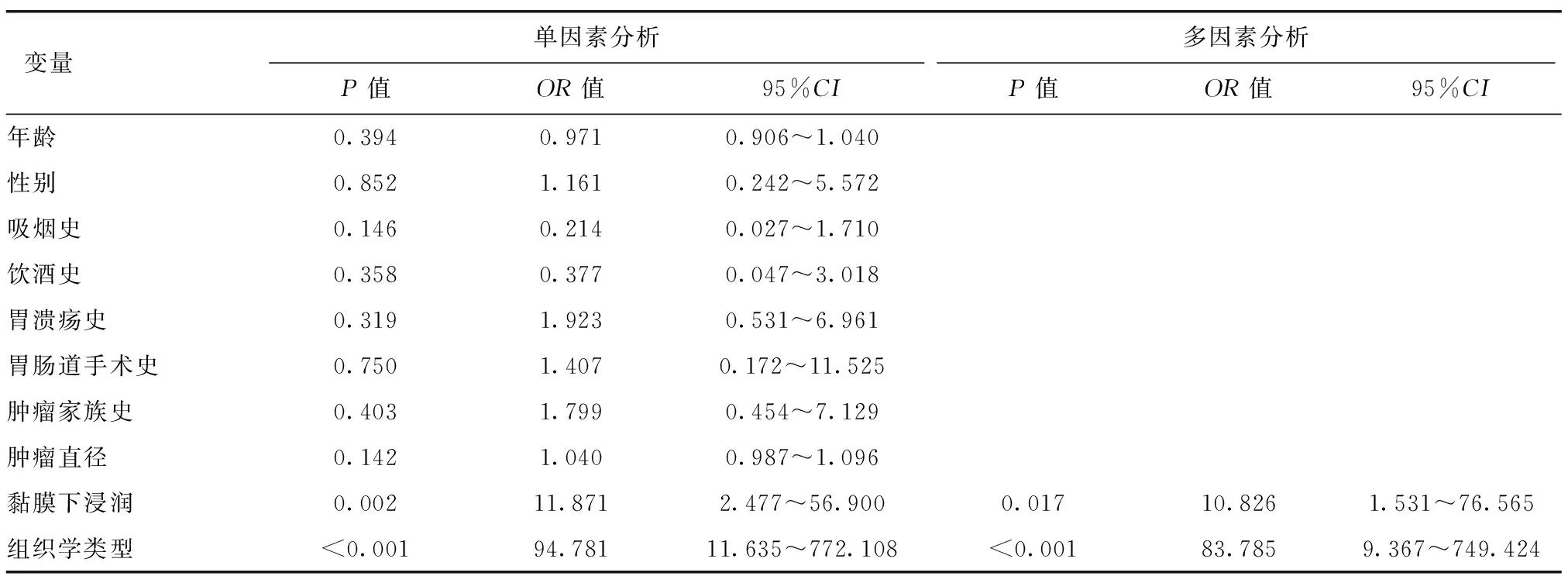
表6 EGC患者淋巴结转移影响因素的Logistic回归分析
2.6 ESD治疗UGC及M-LGC短期及长期疗效比较
2.6.1 短期疗效 两组整块切除、完全切除、治愈性切除、出血及穿孔比例差异均无统计学意义(P>0.05)。UGC组术后出血3例,予以药物止血治疗;M-LGC组术后出血9例,其中7例予以药物止血治疗,2例再次行内镜下止血。UGC组无术中穿孔发生,M-LGC组术中出现穿孔1例,行荷包缝合术。两组均无其他术后并发症发生,见表7。
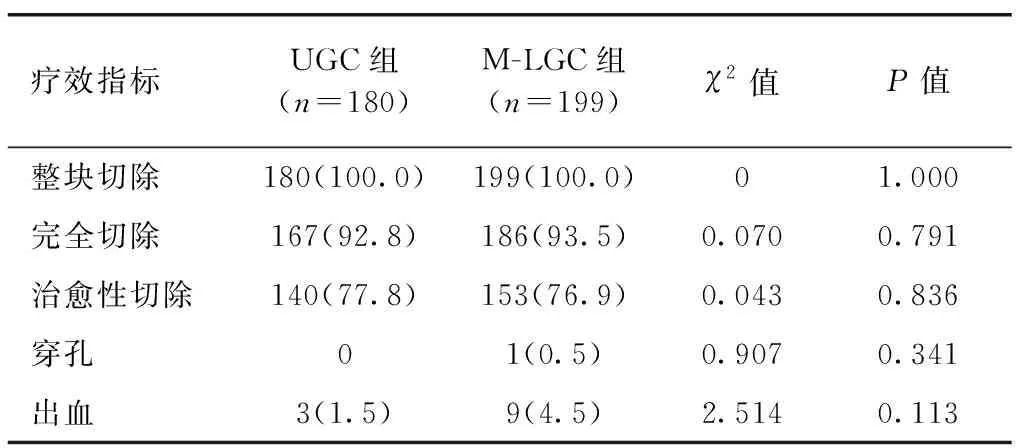
表7 UGC组与M-LGC组短期疗效比较 [例(%)]
2.6.2 长期疗效 至随访截止日期,UGC组、M-LGC组分别有6、8例复发,两组复发率差异无统计学意义(3.3%vs.4.0%,χ2=0.125,P=0.723)。UGC组无死亡,M-LGC组死亡2例,其中1例在出院7个月后追加外科手术时发生感染性休克死亡,另1例在出院16个月后因肿瘤转移死亡,两组病死率差异无统计学意义(0vs.1.0%,χ2=1.819,P=0.177)。
3 讨论
在过去十年间,我国胃癌年死亡率由3.8%降至2.3%[11]。在全球胃癌总体发病率下降的情况下,胃上部癌的发病率却呈上升趋势[4]。既往有较多文献对胃上部与胃中下部近端癌的临床病理特征进行对比研究,但这些研究中的病例多是T2~T4期的晚期胃癌[7,12-13]。
本研究比较了UGC与M-LGC患者的临床病理特征及病灶内镜下特征,结果显示,与M-LGC组相比,UGC组患者年龄≥60岁及男性比例更高,这与以往研究结果[14-15]一致。UGC组年龄≥60岁比例更高,考虑是由于老年患者消化机能减退,进食后胃排空时间用时长,胃底黏膜腺体萎缩相关;UGC组男性比例高于女性,可能与男性患者生活工作压力大,有吸烟、饮酒等不良习惯有关。此外,UGC组黏膜下浸润比例高于M-LGC组,且多因素Logistic回归分析显示肿瘤位于胃上部是黏膜下浸润的独立危险因素。因此,在EGC患者行ESD治疗前对黏膜下浸润情况进行评估具有重要意义。通常对黏膜下浸润的评估方法包括普通白光成像内镜(WLI)、窄带成像内镜(NBI)及超声内镜(EUS)等检查,其中以EUS检查最为常见。近期一项来自日本的研究显示,对于病变位于M/SM1的T1a/T1b1早期胃癌,EUS诊断黏膜下浸润的准确率为97%;对于病变位于SM2的T1b2早期胃癌,EUS的准确率降为79%[16]。目前通过新型人工智能来预测EGC浸润深度的研究越来越多,有研究显示,通过人工智能预测EGC浸润深度的准确率达94.5%,与WLI内镜无显著差异[17]。UGC患者更易发生黏膜下浸润的原因尚未明确,有研究指出可能与其解剖学位置有关,与胃中下部相比,上部胃壁及黏膜下层的厚度更薄,使得癌细胞更易侵犯至黏膜下层[18]。
既往研究发现,未分化型胃癌在近端胃中更加常见,预后更差[19]。本研究结果显示,M-LGC组中未分化型胃癌比例高于UGC组,与日本研究结果相一致[6]。因此,肿瘤的组织学类型可能也会因地区及国家不同而产生差异。此外,未分化型胃癌在肿瘤直径较小的情况下仍会表现出更强的侵袭能力[20],然而在本研究中,UGC患者中未分化型胃癌少见,但其黏膜下浸润却更加常见,这可能也是UGC不同于M-LGC的一个生物学行为,提示有必要根据胃内位置不同对EGC进行进一步研究。
EGC发生淋巴结转移是ESD治疗的禁忌证,亦是患者预后不良的独立危险因素[21-23]。临床通常采用影像学检查进行EGCs术前淋巴结转移筛查,如多层螺旋CT(multi-slice spiral CT,MSCT)。但是,一项来自韩国的研究表明,MSCT对EGCs的N分期的诊断准确率为86.1%[24]。国内研究显示术前MSCT对胃癌患者N分期的诊断准确率为86.3%,N0、N1、N2、N3分期的准确率分别为83.5%、89.0%、83.5%、89.0%[25]。本研究中有59例患者因非治愈性切除追加外科手术,术后病理提示有8例患者有淋巴结转移,MSCT的准确率为86.4%(51/59)。虽然目前MSCT对于淋巴结转移的判断存在不足,但其较高的准确率仍说明MSCT对评估胃癌的术前N分期有较高的价值。
EGC淋巴结转移率主要与浸润深度和组织学类型相关[26]。研究显示,与胃中下部癌相比,胃上部癌发生淋巴结转移和淋巴管浸润的风险更高[15]。但也有来自国内的研究显示,与胃中下部癌相比,胃上部癌发生淋巴结转移的风险更低[12,27-28]。在本研究中,M-LGC组共有33例追加外科手术,其中有8例患者出现淋巴结转移,UGC组共有26例追加外科手术,均未出现淋巴结转移,与上述国内研究[12,27-28]一致。
国外研究显示,ESD治愈性切除EGC后无局部复发或远处转移[29]。ESD与外科手术治疗EGC患者的5年生存率差异无统计学意义[30]。本研究中,ESD治疗EGC的复发率为3.7%(17/379),病死率为0.5%(2/379)。有研究显示,外科手术治疗EGC的总并发症发生率显著高于ESD[31]。在本研究中,ESD治疗EGC术后出血发生率为3.2%(12/379),术后穿孔发生率为0.3%(1/379)。UGC组与M-LGC组患者复发率、病死率、术后出血及穿孔发生率无明显差异。
综上所述,与M-LGC相比,UGC更易发生黏膜下浸润,但其未分化癌占比及淋巴结转移率更低,两组复发率及生存率无明显差异。因此,在评估UGC达到ESD适应证的前提下,可优先选择内镜下切除。
