免疫联合靶向治疗在晚期肝癌转化治疗中的研究进展
2022-03-16黄沾任宁金月李汉卿陈念平
黄沾任,宁金月,李汉卿,陈念平
原发性肝癌(primary liver cancer,PLC)是全球第六大常见癌症,每年新发病例数居恶性肿瘤第五位,死亡率更是位于恶性肿瘤的第三位[1]。由于肝癌在早期缺乏典型临床表现,初次就诊时约39.0% ~ 53.6%已是肝癌晚期,而晚期肝癌患者的中位生存期(mOS)仅有 4.2~7.9 个月[2-4]。鉴于索拉非尼及仑伐替尼作为晚期肝癌的一线治疗药物已经不能满足临床需要,国内外学者正在探索不同的治疗方案来延长中晚期肝癌患者的生存期,包括免疫治疗、免疫联合靶向治疗、肝动脉灌注化疗(hepatic artery infusion chemotherapy,HAIC)联合靶向及免疫治疗、经动脉化疗栓塞(transarterial chemoembolization,TACE)联合免疫治疗、双免疫联合治疗等。
目前已有多个研究证实血管内皮生长因子(vascular endothelial growth factor,VEGF)与肝癌肿瘤组织微环境中的免疫细胞之间存在相互作用。肿瘤组织中的VEGF 一方面可以促进血管的形成,从而起到营养肿瘤的作用,另一方面也可以通过增加肿瘤微环境中肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)的募集、增强免疫抑制细胞(如肿瘤相关巨噬细胞、调节性T 细胞、白介素⁃10 等)的免疫抑制作用、减少树突状细胞的分化成熟及抗原呈递等,从而促进肿瘤细胞的免疫逃逸[5-8]。此外,肿瘤微环境中的免疫细胞本身可以分泌 VEGF 等促血管生成因子[9],而由 VEGF 驱动的血管生成增加了肿瘤相关巨噬细胞(tumor⁃associated macrophages,TAM)对肿瘤部位的浸润,再加上TAM 通过分泌金属蛋白酶等来破坏脉管系统的稳定性,从而导致肿瘤的侵袭和转移[10]。在肿瘤组织中,肿瘤血管和正常血管的结构和功能不同,抗血管生成的靶向药物可以改变肿瘤微环境,使血管正常化[11]。正是基于肿瘤微环境中血管生成与免疫调节之间的关系,国内外学者正在尝试包括PD⁃1/PD⁃L1 抑制剂与血管内皮生长因子抑制剂、多靶点激酶抑制剂在内的多种联合降期方案,期待能解除肿瘤微环境中的免疫抑制,增强免疫治疗疗效,达到1+1>2 的效果。本文主要介绍免疫联合靶向治疗在晚期肝癌转化降期治疗方面的研究进展。
1 免疫联合靶向一线治疗晚期肝癌的临床研究
IMbrave150 纳入了501 例未接受过系统治疗的中晚期肝癌患者,分为阿特利珠单抗与贝伐珠单抗联合组和索拉非尼单药组,联合组可使生存时间(OS)和疾病进展(PD)风险分别下降42%、41%,并能显著延长患者的中位OS 和中位无病生存期(PFS)(19.2个月vs.13.4个月,6.9个月vs.4.3个月),其中,中国患者的中位总生存(mOS)为24 个月vs.11.4个月。根据mRECIST标准,联合组的客观缓解率(ORR)明显高于单药组(35.4%vs.13.9%)。联合组和单药组在3~4 级不良反应发生率分别为63%和57%,虽然联合用药的安全性与单药一致,但仍需警惕联合用药可能带来的出血(25%vs.17%),尤其是存在有食管胃底静脉曲张的患者[12-14]。基于该研究观察到的显著疗效,2020 年5 月29 日,FDA正式批准阿替利珠单抗联合贝伐珠单抗(T+A 方案)成为晚期肝癌的一线治疗方案,2020 年中国临床肿瘤学会(CSCO)也正式将该方案列为一线治疗方案。
帕博利珠单抗联合仑伐替尼治疗100名不可切除肝癌患者的单臂、前瞻性、开放标签Ib 期研究[15](KEYNOTE⁃524 研究)表明,联合组基于mRECIST标准的ORR率为46%(95%CI:36.0%~56.3%),中位缓解持续时间(mDOR)为8.6 个月和mPFS 为9.3 个月;其mOS 更是达到了22 个月。该研究未出现新的不良反应,也没有出现肝炎爆发情况。基于该研究结果,FDA 将该方案定为不可切除肝癌的突破性一线治疗方案。帕博利珠单抗+仑伐替尼与仑伐替尼+安慰剂的Ⅲ期临床研究也正在进行中(LEAP⁃002;NCT03713593)。除此之外,日本学者应用阿维鲁单抗联合阿西替尼一线治疗晚期肝癌的Ib 期研究也证实了其安全性及疗效[16],不过该研究仅纳入了22 名晚期肝癌患者,且在治疗过程中,由于不良反应的原因,超过一半患者减半剂量或停用阿西替尼。
不仅进口药物在肝癌转化治疗方面取得了良好的疗效,高效便宜的国产免疫药物也为国内广大肝癌患者带来了希冀。国内首次大规模应用信迪利单抗联合贝伐珠单抗对比索拉非尼一线治疗不可切除肝癌的2~3 期临床研究也取得了良好的疗效和可控的安全性[17]。虽然与 IMbrave150 相比,其ORR 率偏低,但该研究人群具有HBV 感染率高、肝外转移率高、肝功能差、AFP 值高、ECOG评分差、肿瘤负荷大等特点,更加符合中国肝癌患者的实际情况,有可能会得到国内医患的青睐。Han 等[18]人应用安罗替尼联合 PD⁃1 单抗 AK105 一线治疗不可切除肝癌,也取得了较好的疗效和可接受的安全性,且其出现3 级或更高的与治疗相关的不良反应事件远低于IMbrave150(19.4%vs.63%),但该研究存在样本量少、HBV 率低的缺点,还需要更大样本量和更符合中国肝癌患者实际临床情况的临床研究来验证该方案的实际疗效。
2 免疫联合靶向二线治疗晚期肝癌的临床研究
虽然晚期肝癌的综合治疗在临床上有了一定的应用,但并非所有患者都能从中获益,对于既往曾接受过全身或局部治疗后进展或不耐受的患者,能否适用免疫联合靶向治疗,目前尚无相关共识。瑞戈非尼单药二线治疗晚期肝癌的3 期临床试验取得了较好的疗效[19],是第一个被批准用于肝癌二线治疗的靶向药物;目前,瑞戈非尼联合信迪利单抗对比瑞戈非尼二线治疗不可切除肝癌的临床研究正在进行中(NCT04718909)。
卡瑞利珠单抗单药二线治疗晚期肝癌取得了良好的疗效和可控的安全性[20],2020 年 3 月 4 日我国已正式批准其为肝癌的二线治疗方案。徐建明等人首次报道了卡瑞利珠单抗联合阿帕替尼在晚期肝癌的一线治疗和二线治疗中具有良好的疗效和安全性[21]。该研究分成了一线治疗组和既往靶向治疗后疾病进展或不耐受的二线治疗组,分别纳入了70 例和120 例患者,其ORR 分别为34.3%和22.5%,mPFS分别为5.7个月和5.5个月;与治疗相关的≥3级不良反应事件发生率为77.4%,最常见的不良反应事件为高血压病、AST 升高、中心粒细胞减少。该试验是在中国25 个研究中心进行的,并且是目前卡瑞利珠单抗联合阿帕替尼治疗晚期肝癌相关研究中HBV感染率最高的,也更加符合中国的肝癌患者HBV 感染率高的情况。根据mRECEST 评价标准,一线治疗和二线治疗的ORR并没有统计学差异,研究者认为这可能和样本量小以及二线治疗患者曾接受过索拉非尼治疗相关。袁国盛等人[22]回顾性分析了国内5 个研究中心、共94 例卡瑞利珠单抗联合阿帕替尼在晚期肝癌二线治疗中的疗效及安全性,也证实了卡瑞利珠单抗联合阿帕替尼在晚期肝癌二线治疗中的疗效和安全性。目前卡瑞利珠单抗联合阿帕替尼对比索拉非尼一线治疗晚期肝癌的全球多中心随机3 期临床研究正在进行中(NCT03764293)。以上所述的相关临床研究见表1。
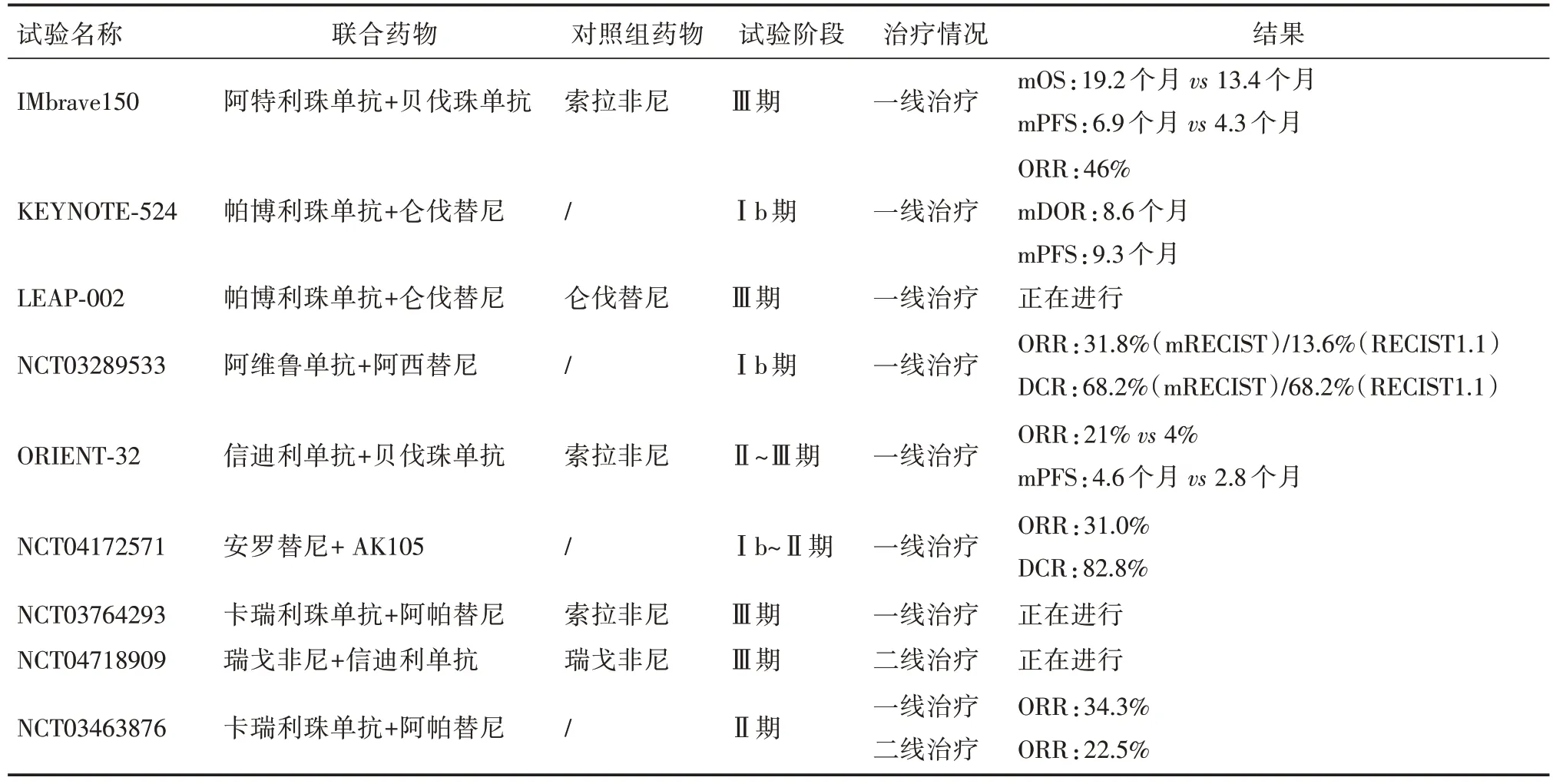
表1 肝癌免疫联合靶向药物治疗的相关临床研究
3 免疫联合靶向治疗适用人群的选择
目前,对于免疫联合靶向治疗人群的选择,不同国家和地区存在不同的标准。2021V5 版美国国立综合癌症网络(NCCN)肝胆肿瘤指南中建议,T+A 方案仅适用于Child⁃Pugh A 级的不可切除肝癌患者。日本2021 年肝细胞癌管理指南[23]中认为所有Child⁃Pugh B 级患者都不具备包括免疫联合靶向在内的全身性治疗的条件;建议对于没有肝外转移、无大血管侵犯、肿瘤数目≥4 个的Child⁃Pugh A 级患者,可以将全身性治疗作为二线治疗方案;对于伴有大血管侵犯的Child⁃Pugh A 级患者,还是优先考虑肝切除、TACE 或者HAIC,只有在Vp3 和Vp4 分型时才首选T+A 方案;全身性治疗也是伴有肝外转移的Child⁃Pugh A 级患者的唯一治疗方案;对于TACE 治疗后出现血管侵犯的患者,首选全身性治疗,该指南认为此时HAIC 不太可能有反应。
在国内,对于早中期肝癌一直秉持着手术切除为主的观念,对于不可切除的肝癌患者,首选介入治疗;《基于免疫联合靶向方案的晚期肝细胞癌转化治疗中国专家共识(2021 版)》中则建议对CNLC⁃Ⅲ期和BCLC C 期患者先行转化治疗,降期后再行根治性治疗可获得比直接手术更长的生存获益[4]。目前我国2021 版原发性肝癌诊疗规范更新工作已启动,期待能够对转化病人的选择进行进一步的指导。
4 免疫联合靶向治疗疗效预测
由于免疫治疗存在假性进展、超进展、延迟应答等情况,在治疗过程中可能会影响医患双方的信心,因此,研究人员也在探索分子层面的预测指标,其中比较热门的预测指标是循环肿瘤细胞DNA(circulating tumor DNA,ctDNA)、程序性细胞死亡配体⁃1(programmed cell death ligand,PD⁃L1)、肿瘤突变负荷(tumor mutational burden,TMB)、微卫星不稳定(microsatellite instability,MSI)以及错配修复缺陷(mismatch repair deficient,MMR),但上述标志物的疗效预测目前仍存在争议。但在多种实体肿瘤的免疫治疗中,无论PD⁃L1 的表达呈阳性或阴性都能从中获益[24]。有推测认为高TMB肿瘤可能携带有更多的肿瘤抗原,从而成为被激活的免疫细胞的靶点[25],但晚期肝癌TMB 值较低,约为 4 个突变/Mb[26];有研究[27]通过绘图判断和分析接受PD⁃1 或PD⁃L1 抑制剂的27 种肿瘤(包括HCC)患者的TMB 水平与ORR 之间的关系观察到两者之间存在显著相关性。亦有学者提出动态检测这些指标,期待可以指导临床上对靶向联合免疫治疗敏感患者的筛选和疗效预测,但由于基因检测费用高、相关研究报道少,加上肿瘤异质性和个体差异性等原因,国内2020 年出版的《肝胆肿瘤分子诊断临床应用专家共识》中暂不推荐对于接受靶向或免疫治疗的患者进行常规性基因检测,但是鼓励结合临床实际情况进行一定的探索。除此之外,Zheng 等人[28]首次应用基因测序技术观察到,接受免疫治疗的肝癌患者其肠道菌群的变化与免疫治疗疗效有关,并认为其有可能作为免疫治疗疗效预测的一种新途径。另有研究发现,肝癌免疫治疗过程中出现甲状腺功能减退可能是预后良好的预测因素[29]。
5 展 望
晚期肝癌患者的转化降期治疗给广大肝癌患者带来了新的希望,除了免疫联合靶向外,其它治疗方案也取得了较好的疗效,如FOLFOX⁃HAIC 联合靶向及免疫治疗方案、TACE 联合免疫治疗方案、立体定向放射治疗、双免疫联合治疗等[30-34],逐步打破了中晚期肝癌治疗手段少、转化率低的局面,促进了中晚期肝癌全身治疗和局部治疗相结合的治疗理念的发展,期待更多的综合性治疗方案能够给中晚期肝癌患者带来更长的生存获益。
