标准化剩余肝体积与肝硬度比值预测肝脏切除术后肝功能不全的临床研究
2022-03-16左超海覃芝蓉余杰雄潘德盛邝乃乐黄皓川
左超海,覃芝蓉,余杰雄,潘德盛,邝乃乐,黄皓川
目前针对于肝脏肿瘤的手术须根据肿瘤因素、基线肝功能和患者的功能状态分析可能的风险和益处进行个体化治疗,手术原则包括切缘阴性、保留残余肝脏的足够功能[1]。我国原发性肝癌患者合并肝硬化者甚多,除了原发性肝癌的肝脏切除为主要治疗手段外,一些巨大的良性肝脏肿瘤亦需行大范围的肝脏切除术,这些患者会面临肝功能衰竭的风险。对于可能涉及肝功能不全的患者来说,术前多学科、多方位评估以便提供治疗的最佳选择至关重要的,也是外科医生的挑战。本研究中回顾性分析我院2015 年1 月~2021 年6 月行半肝切除术患者61 例的临床资料,探讨标准化剩余肝体积与肝硬度值的比值预测肝脏切除术后肝功能不全的作用。
1 临床资料和方法
1.1 一般资料
共选择行肝脏切除术患者61 例入组。纳入标准:①有明确手术指征的肝脏肿瘤患者:原发性肝细胞肝癌、肝转移瘤、肝内胆管细胞癌、肝脏巨大血管瘤等;②肝功能均为Child A 级者;③切除肿瘤后剩余肝脏不少于功能性全肝体积40%;④患者行以下两种肝切除术式:开腹或者腹腔镜下左半肝切除术、右半肝切除术;⑤CT 或者MR 见肝脏无严重肝硬化或者肝脏萎缩;⑥患者术前均无黄疸,ICG⁃R15 均小于10%。
61 例患者中,男性 41 例,女性 20 例,年龄 23~74 岁,平均年龄 49 岁;肝脏恶性肿瘤患者 58 例,其中肝细胞肝癌51 例,肝内胆管细胞癌6 例,肝脏转移瘤1 例,肝脏良性肿瘤患者3 例;乙型肝炎患者48 例,丙型肝炎患者1 例,同时患有乙型、丙型肝炎者1 例,合并肝硬化患者44 例;左肝肿瘤37 例,右肝肿瘤24 例;肿瘤直径10 cm 以上者23 例,肿瘤直径 5~10 cm 者 30 例,5 cm 以下者 8 例;行左半肝切除术患者37 例,行右半肝切除术患者24 例。
1.2 术后肝功能不全及肝功能衰竭的判定
对于肝切除术后肝功能不全的定义目前尚无完全统一的标准。通过参考文献,在本研究中,我们采用的肝功能不全及肝功能衰竭的判定如下:①肝功能不全的标准:行肝脏切除术第7天后,总胆红素仍高于34 μmol/L;肝脏切除术后全过程出现总胆红素的峰值高于51 μmol/L[2];②患者术后肝功能衰竭标准:肝脏切除术后5 天或者5 天以上凝血酶原时间<50%(即INR>1.7)、血清胆红素>50 μmol/L或手术后胆红素峰值大于120 μmol/L[3]。
1.3 研究流程
对符合纳入研究标准的61 位患者采用CT 或者MR 进行全肝增强扫描,扫描范围从右膈顶到肝脏下缘,检查图像进行三维重建。按照肝脏肿瘤的位置拟行解剖性左半肝脏或者右半肝脏切除术。并按照拟定的手术方案计算出全肝体积及剩余的肝脏体积。
1)计算体表面积BSA(body surface area):采用DuBois 公式计算而得,BSA(m2)=人体质量(kg)0.425×身高(cm)0.725×0.007184[4];SLV 估算采用日本东京大学 Urata 公式:SLV(mL)=706.2×BSA(m2)+2.4[5];标准化剩余肝体积SFLV(standard fu⁃ture liver volume)=剩余肝体积FLV(future liver vol⁃ume)/体表面积BSA。
2)所有患者行肝脏超声影像和瞬时弹性成像检查,检测出每位患者的肝脏硬度值(KPA)。
3)计算出每位患者标准化剩余肝体积与肝硬度值的比值SFLV/KPA。
4)腹腔镜下解剖性肝切除术:采用鞘内分离法或者鞘外分离法游离肝蒂:鞘内法先游离出左肝动脉或者右肝动脉,结扎左肝动脉或者右肝动脉(部分患者如有需要需一并结扎中肝动脉),然后分离出门静脉左支或者右支并结扎;鞘外法则行整个左肝蒂或者右肝蒂结扎。出现缺血线后行术中彩超明确肝中静脉位置,保留肝中静脉主干,沿缺血线左侧或右侧约0.5 cm 电刀划好切除线,行pringle 法第一肝门全肝血流阻断,阻断方法为每次阻断时间不超过15 min,开放5 min 以上,一般行2 次到5 次阻断,直到完成半肝切除术。术后常规应用抗生素,输注白蛋白,制酸、使用相同护肝药物进行治疗等。
5)术后第 1 天、第 3 天、第 5 天、第 7 天分别检测患者肝功能及凝血功能:如患者行肝脏切除术第7 天后,总胆红素仍高于34 μmol/L;肝脏切除术后全过程出现总胆红素的峰值高于51 μmol/L。评定该患者发生术后肝功能不全。如患者肝脏切除术后5 天或者5 天以上凝血酶原时间<50%(即INR>1.7)、血清胆红素>50 μmol/L;或手术后胆红素峰值大于120 μmol/L,评定患者出现肝功能衰竭。
1.4 数据处理
把与患者术后肝功能不全的因素进行单因素分析,得到与患者术后肝功能不全相关的因素,再把这些因素全部纳入多因素二元logistics 回归分析;计算61 例患者SFLV/KPA 的值,然后作该值预测术后肝功能不全的受试者线ROC 曲线,并通过受试者工作特征曲线ROC 曲线确定SFLV/KPA 预测术后肝功能不全的临界值。数据采用SPSS 21.0统计软件进行统计学处理。符合正态分布的计量资料以()表示,两组比较采用t检验,两组的定性资料比较采用卡方检验,P<0.05 为差异有统计学意义。
2 结 果
2.1 手术完成情况
61 例肝切除术患者均顺利完成手术,出血量为50~400 mL,平均出血量约210 mL,中位出血量280 mL。患者的平均住院天数为14 天,无患者死亡,出现术后肝功能不全者7 例,术后出现肝功能不全的7 例患者中6 例为右半肝切除患者,1 例为左半肝切除患者。这7 例患者中5 例肝硬化。无患者出现肝功能衰竭。
2.2 与术后肝功能不全相关的指标进行单因素分析
从与术后肝功能不全的相关因素的单因素分析中,可以看到术中出血量、肝门阻断时间、SFLV/KPA 的值、手术方式的P值(t值)小于0.05,其差异有统计学意义,表明术中出血量大、肝门阻断时间长、SFLV/KPA 的比值小、右半肝切除等更容易发生肝切除术术后肝功能不全。
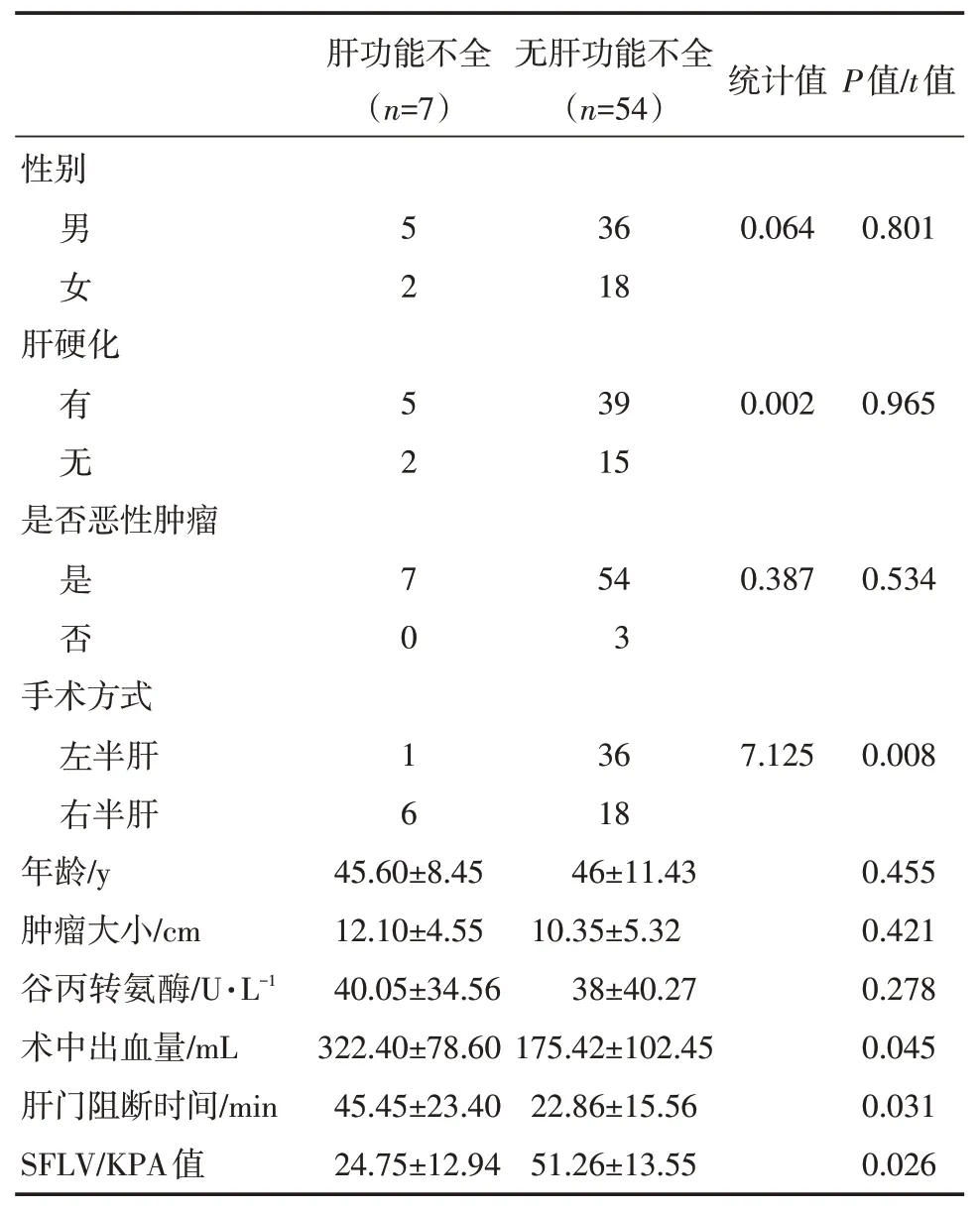
表1 与术后肝功能不全相关因素的单因素分析
2.3 术后肝功能不全多因素二元logistics回归分析
通过上面与术后肝功能不全相关因素的单因素分析中,得到术中出血量、肝门阻断时间、SFLV/KPA 的值、手术方式与术后肝功能不全相关。将这四种因素全部纳入多因素二元logistics 回归分析。从该结果可以看出,SFLV/KPA 的统计值P 值小于0.05,有统计学意义,是可以预测术后肝功能不全发生的独立因素。(表2)
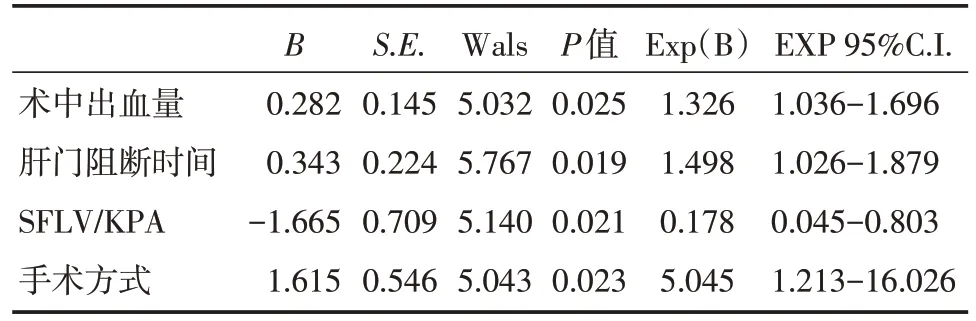
表2 术后肝功能不全多因素二元logistics 回归分析
2.4 通过ROC 分析确定SFLV/KPA 的比值预测肝功能不全
通过计算61 例患者SFLV/KPA 的比值,作该值预测术后肝功能不全的受试者工作特征曲线ROC 曲线,得到受试者工作特征曲线ROC 曲线下面积为 0.897,95%的置信区间为0.786⁃0.987,P=0.001(图 1)。SFLV/KPA 的比值为 30.6 时,特异度与灵敏度的和为最大,分别是0.857 和0.870。当患者SFLV/KPA 的比值大于30.6 时,其发生术后肝功能不全的概率较低,反之,当患者SFLV/KPA 的比值小于30.6 时,其发生术后肝功能不全的概率较高,患者行肝脏切除手术风险较大。
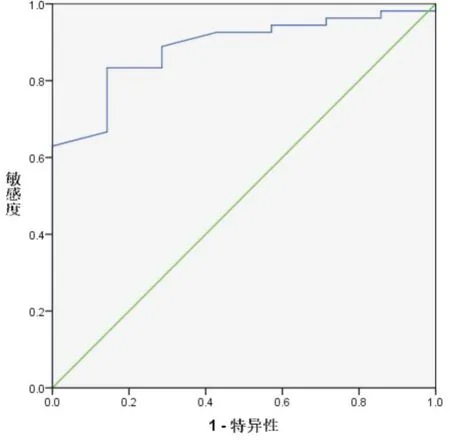
图1 SFLV/KPA 的比值预测术后肝功能不全
3 讨 论
在行肝脏切除术治疗肝脏肿瘤的患者中,无论肿瘤为良性或者恶性,都有部分患者需切除较大体积的肝脏。特别是肿瘤体积不是太大,而位置深在且靠近左右肝蒂等肝脏大血管,往往需要行大范围的半肝切除术才可以达到根治性切除,大范围肝脏切除有可能造成患者肝功能衰竭。我国肝癌患者大部分合并肝炎肝硬化,而当患者合并有肝硬化时,如果行大范围肝切除发生术后肝功能衰竭的危险将更加高,肝实质切除率是患者术后肝功能衰竭的独立因素[6],本研究中,右半肝切除术患者比左半肝切除术患者更加容易出现术后肝功能不全,同样表明大范围肝切除患者更加容易出现术后肝功能不全。另外,本研究中肝门阻断时间长,术中出血量大的患者也更加容易出现术后肝功能不全,与其他学者既往研究一致[7]。
当患者行大范围肝切除术时,可通过术前肝功能评估,如 Child⁃Pugh 分级评估,15 分钟吲哚氰绿滞留率(ICGR15)测定、残肝体积测定等来评定患者是否可以耐受手术。一直以来,Child⁃Pugh 分级评估肝功能是一种临床上常用的用以对患者的肝脏储备进行量化评估的方法,自1964 年由Child提出后一直受到广大临床医学工作者的认可,并以此为需行肝肿瘤切除的患者肝功能储备评估提供了具体的临床参考数据,具有非常重要的临床价值。但是,Child⁃Pugh 分级评估肝功能储备在临床应用上具有一定的局限性,最初Child⁃Pugh 分级并不是专门为HCC 设计的,而是根据经验开发且适用于肝硬化患者,涉及一些主观成分[8]。有学者观察到行肝癌切除术时,即使患者术前肝功能是Child⁃Pugh A 级,手术后仍有少部分患者死于肝功能衰竭,Child⁃Pugh 分级法在肝癌患者手术前肝功能储备的评估上仍具有局限性[9]。目前,也有学者采用改良的Child⁃Pugh(MCP)评估肝切除后的长期预后,以作为Child⁃Pugh 的相对简单、客观和基于证据的替代方案[10,11]。
15 分钟吲哚氰绿滞留率(ICGR15)测定是目前比较理想的对肝脏储备功能进行评估的方法,优于传统的Child⁃Pugh 评分法,在肝脏切除手术前检查具有非常高的参考评估价值[12]。但其也有影响的因素,如肝脏胆道是否梗阻、毛细胆管的排泄情况、肝血流量、腹腔内压力增加影响肝内毛细血管血流量等因素都影响检查结果的准确性[13],所以当患者有门静脉血栓,门静脉癌栓,肝脏局部血流异常,肝动脉栓塞术后,门静脉栓塞术后都会影响检查结果的准确性,其他的如高胆红素血症或者血管扩张剂等也会明显影响检查结果的准确性。另外患者有胆总管结石等影响胆道排泄的原因也可以导致ICG排泄速率延缓,从而影响检查结果的准确性[13]。
当前,有众多的方法都在探索预测术后肝功能不全,如使用15 分钟吲哚氰绿滞留率联合剩余肝体积测定、iMELD 及CLD、肝脏硬度值、PLT或者联合MELD 评分等多种方法预测术后肝功能不全[13-17]。另有学者认为 Gd⁃EOB⁃DTPA 在注射入人体血液后,可以迅速被肝细胞摄取,并且基本不进入肝肠循环,而肝细胞储备功能下降时,其摄取功能也明显下降,所以对肝脏用 Gd⁃EOB⁃DTPA 增强MRI 可以反映患者的肝功能储备,其在临床中通过对肝癌切除术患者进行Gd⁃EOB⁃DT PA 增强MRI 联合剩余肝脏体积测定来为术前的患者进行肝脏储备功能评估[18]。
目前肝功能储备的评估无绝对准确的方法,本研究中,采用SFLV/KPA 的比值,既考虑了剩余肝脏体积,也考虑了患者肝硬化的程度,在其比值大于30.6 时手术安全性较高,如果结合患者的ICGR15 的结果共同参考,可能对肝脏切除手术的安全性提供更大帮助。
