菊糖对蚯蚓粪肥性状的影响及调控过程①
2022-03-16曹惠翔甘泉峰谢军伟赵耕毛
曹惠翔,李 帅,杨 敏,黄 婷,李 媛,甘泉峰,谢军伟,赵耕毛
菊糖对蚯蚓粪肥性状的影响及调控过程①
曹惠翔,李 帅,杨 敏,黄 婷,李 媛,甘泉峰,谢军伟,赵耕毛*
(南京农业大学资源与环境科学学院/江苏省海洋生物学重点实验室,南京 210095)
通过蚯蚓堆肥试验,探讨菊糖对蚯蚓的益生作用及高活力蚯蚓粪肥的形成过程,可为滩涂生态农牧化模式构建及障碍土壤修复提供理论依据。以牛粪、赤子爱胜蚓()和菊糖为材料,设置纯牛粪养殖蚯蚓(EM)和添加菊糖的牛粪养殖蚯蚓(IEM)处理,养殖周期为40 d,每隔10 d采样分析,研究了牛粪–蚯蚓肠道内容物–普通蚯蚓粪肥/菊糖型蚯蚓粪肥性质动态变化过程。结果表明:添加菊糖与否的腐熟牛粪经蚯蚓取食、消化、排泄等过程所形成的菊糖型蚯蚓粪肥和普通蚯蚓粪肥,其基本性质较为一致:pH趋于中性,电导率显著下降,氮元素被吸收利用,有机质加速分解矿化,磷、钾元素进一步释放。但添加菊糖提高了有机质的降解效率与钾素释放,40 d时IEM处理蚯蚓粪肥的有机质含量比EM处理低9.4%,全钾含量高13.0%。EM处理的脲酶、碱性磷酸酶、过氧化氢酶活性总体呈先升后降的趋势,其峰值出现在20 ~ 30 d;而IEM处理缩短了酶活性峰值的出现时间(除脲酶活性外),10 d时碱性磷酸酶、过氧化氢酶活性均达到峰值,其值较EM处理分别提高113.0% 和61.0%。养殖10 d时,普通蚯蚓粪肥和菊糖型蚯蚓粪肥微生物多样性显著增加,菊糖型蚯蚓粪肥功能菌数量呈倍数增长。添加菊糖提高了前、中期(10、20 d)蚯蚓粪肥中放线菌门(Actinobateria)的相对丰度,其中20 d时较EM处理增加40.7%。可见,菊糖能够调控蚯蚓堆肥进程与蚯蚓粪肥性状,蚯蚓堆肥20 d后获得的菊糖型蚯蚓粪肥生物活性高、品质佳。
蚯蚓粪肥;菊糖;酶活性;群落结构;微生物多样性
我国滨海地区的盐渍土面积约占全国盐渍土总面积的40%,是我国五大盐渍土区域之一。土壤盐渍化是土地治理中的一大难题,目前我国可耕面积面临严峻挑战,滨海盐碱地作为重要的后备土地资源,其治理与开发对保护我国粮食安全具有重要意义[1]。滨海盐碱地盐渍化程度高、营养物质匮乏且生物活力较差,新垦滩涂盐碱地资源亟待加速治理改造[2]。有机类肥料能够改善土壤理化性质,提高土壤微生物活性,促进盐渍化土壤向良性转化,为盐碱土改良提供了新的切入点[3]。
蚯蚓粪是有机物料经蚯蚓消化系统作用后产生的生物有机肥,其具有排水性高、持水量大和通气性好等特点[4],且含有丰富的养分和有益微生物,具有较强的供肥保肥及改良土壤的能力[5-6]。蚯蚓粪在促进植物生长、抑制植物土传病害和缓解土壤盐胁迫方面发挥着重要作用[7-8]。研究表明,蚯蚓粪肥较普通有机肥在土壤改良和促进植物生长方面的效果更好[9]。减肥减药、以生物有机肥替代化肥是绿色农业发展的重要方向,蚯蚓粪肥的生产利用具有广阔的发展前景。但是目前蚯蚓堆肥缺乏统一规范性,蚯蚓粪肥的品质得不到有效保障,因此生产高品质蚯蚓粪肥成为实现农业可持续发展的当务之急。
菊糖是由D-果糖经β(1→2)糖苷键链接而成的线性直链多糖,末端常带有一个葡萄糖残基。菊糖作为植物中的储备性多糖广泛存在于多种植物体内,能够有效改善人体肠道微生物的组成和结构[10]。菊糖几乎不被胃酸水解和消化,人和动物体内都缺乏分解菊糖的酶类,但菊糖可被肠道内大量有益菌群代谢利用,从而改善肠道环境,促进肠道理想微生态形成[11]。有研究表明,菊糖可以促进肠道内的双歧杆菌()增殖,增强胃肠道蠕动,提高肠胃功能,增加消化和食欲,提高机体免疫力[12-13]。尽管有大量研究报道了菊糖对人体肠道菌群具有益生作用,但菊糖作为一种新型绿色无残留的饲料添加剂在蚯蚓堆肥中是否发挥益生作用尚未有研究报道。
本研究通过为期40 d的蚯蚓堆肥试验,探究菊糖在蚯蚓堆肥过程中所发挥的益生作用,旨在揭示牛粪–蚯蚓肠道内容物–普通蚯蚓粪肥/菊糖型蚯蚓粪肥性质的动态变化过程,为高品质蚯蚓粪肥的制备及品质调控提供理论依据和技术参数。
1 材料与方法
1.1 试验材料
赤子爱胜蚓()种苗由宿迁市启龙农业科技有限公司提供,菊糖购买于江苏碧青园海洋生物科技有限公司,牛粪取自奶牛养殖场,新鲜牛粪堆制在阳光充足的地方,自然发酵至无臭松软的状态,相对持水量约为70%。腐熟牛粪的基本性质如表1所示。
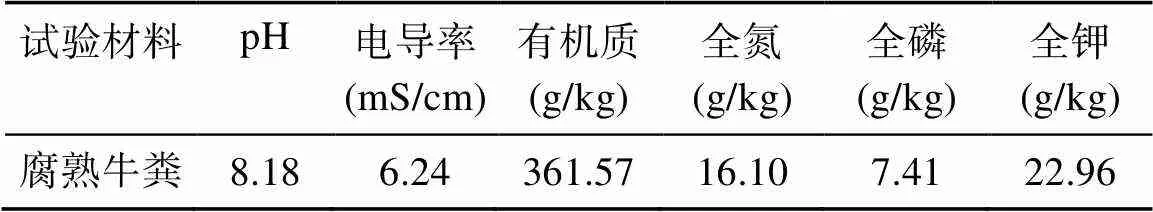
表1 腐熟牛粪的基本性质
1.2 试验设计
以采集的腐熟牛粪作为蚯蚓的培养基质,设置纯牛粪养殖蚯蚓(EM)和添加菊糖的牛粪养殖蚯蚓(IEM)2个处理,每处理3个重复。IEM处理的菊糖添加量为25 g(纯度高于97% 的白色粉末状固体),每个处理均含牛粪基质5 kg,蚯蚓200条左右,单条蚯蚓均重为0.45 g。蚯蚓分组后分别放置于室内已装好培养基质的长410 mm×宽310 mm×高145 mm的长方形周转箱(内置两块塑料挡板做隔断,平均分为3个重复小区)内,用打孔报纸遮盖进行培养。每隔2 d向周转箱内喷洒等量的水以维持基质湿度,室内温度为26 ~ 28℃,试验周期为40 d。
两个处理的培养基质经蚯蚓取食消解后每隔10 d采样1次,包括零时间对照10月19日(CK)、10月29日(EM10、IEM10)、11月8日(EM20、IEM20)、11月18日(EM30、IEM30)、11月28日(EM40、IEM40),共采集5次基质样品。每次采样采用五点取样法在周转箱内随机钻取样品,采集的样品混匀后取部分鲜样测定功能菌数量和微生物生物量碳氮含量,剩余样品一部分放置于–60℃冰箱保存,用于测定微生物群落结构,另一部分风干后过100目筛网,室温存储,用于测定其基本性质和酶活性。EM和IEM两个处理的蚯蚓肠道内容物分别在11月8日(EG20、IEG20)、11月28日(EG40、IEG40)采集两次。采样时每个处理随机挑选15 ~ 20条蚯蚓,用纯水冲洗干净蚯蚓体表后,于–60℃超低温冰箱短暂冷冻致死后通过解剖针和解剖刀取其肠道内容物,收集样品放置于–60℃超低温冰箱保存用于测定微生物群落结构。
1.3 测定指标与方法
基质基本性质测定:pH和电导率采用水土比5∶1(),用pH计和电导率仪测定;有机质采用重铬酸钾容量法–稀释热法测定;全氮采用浓硫酸–过氧化氢消煮,连续流动分析(Seal-AA3)法测定;全磷、全钾采用硝酸–盐酸–高氯酸(1∶3∶2,)消煮,ICP-OES测定。
基质生物学性质测定:微生物生物量碳氮采用氯仿熏蒸–K2SO4浸提法测定;脲酶、碱性磷酸酶、过氧化氢酶活性采用solarbio®的相应酶活性检测试剂盒进行测定;功能菌数量分别采用阿须贝氏培养基、硅酸盐细菌培养基、根瘤菌培养基、有机磷细菌培养基和无机磷细菌培养基进行稀释涂布平板计数法测定,每个样本稀释为10–3、10–4和10–53个连续梯度,每一稀释度2个平行2个空白,方法参照国标GB4789.2—2016[14]进行,有效活菌数为上述5种功能菌的菌落总数。
基质及蚯蚓肠道内容物总DNA提取与PCR扩增以及16S rRNA测序:采用QIAamp-DNA试剂盒提取样品的总DNA,利用琼脂糖凝胶电泳检测DNA的纯度和浓度,根据提取DNA的纯度和浓度,选择样品进行后续测序。用引物338F: 5'-ACTCCTACGGGAGGCAGCAG-3'和806R: 5'-GGACTACHVGGG TWTCTAAT-3' 扩增细菌16S核糖体RNA基因V3 ~ V4区。PCR扩增产物测序在上海Majorbio Bio-Pharm Technology (Shanghai, China)的Illumina Mised平台上进行。
1.4 数据处理
使用Microsoft Excel 2013、SPSS Statistics 19.0软件对数据进行统计分析,单因素Duncan法进行方差分析和多重比较,显著性水平为<0.05。使用UPARSE软件(version 7.0 )根据97% 的相似度对序列进行OTU(operational taxonomic unit, 操作分类单元)聚类,利用RDP Classifier对每条序列进行物种分类注释,比对Silva数据库。利用Mothur1.30.2 进行Alpha多样性计算,包括群落丰富度指数(Sobs指数、Chao1指数)、群落多样性(Shannon指数)以及群落系统发育多样性(PD指数)。物种Venn图与群落柱形图使用R语言(version 3.3.1)工具统计和作图。
2 结果与分析
2.1 蚯蚓粪肥基本性质变化
腐熟牛粪(CK)经过蚯蚓取食消解后转化为普通蚯蚓粪肥(EM)和菊糖型蚯蚓粪肥(IEM),两个处理(EM、IEM)的pH变化较小,40 d时分别由初始的8.18降低到7.88和7.96;而电导率、全氮含量急剧降低(10 d),之后变化趋于稳定,养殖40 d时分别较腐熟牛粪降低39.1% 和42.0%、27.8% 和30%(表2)。EM和IEM处理的有机质含量呈先升后降的趋势,10 d内显著增加,之后持续减少,40 d时分别较腐熟牛粪显著降低7.9%和16.6%,IEM处理的有机质分解更彻底,二者差异显著();全磷含量总体呈增长趋势,40 d时分别较腐熟牛粪显著提高8.0% 和10.1%;全钾含量在10 d内有所减少,此后持续增加,40 d时IEM较EM处理的全钾含量提高了13.0%,且IEM处理的全钾含量在各时期均显著高于EM处理。
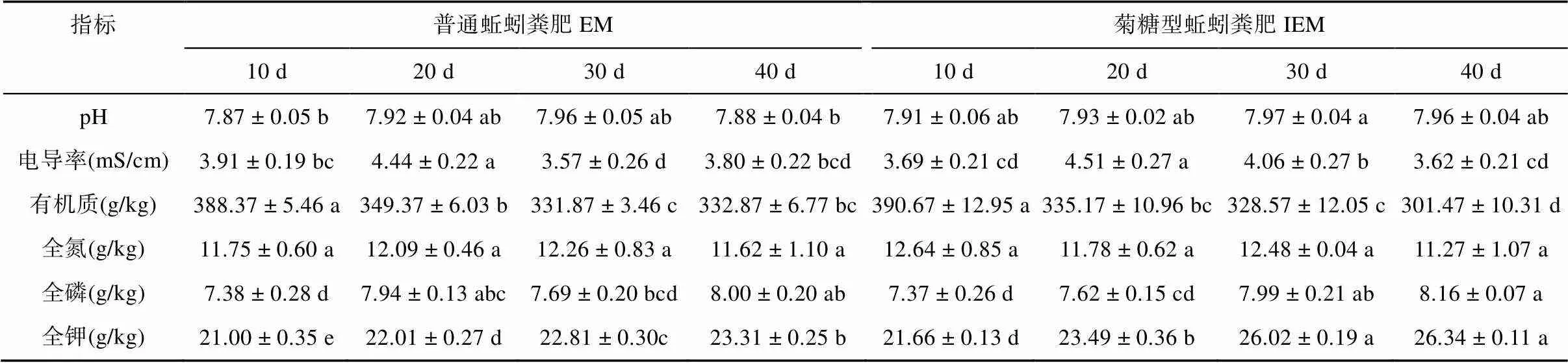
表2 养殖周期内普通蚯蚓粪肥和菊糖型蚯蚓粪肥的基本性质动态变化
注:表中数据为3次重复的平均值±标准差,同行数据不同小写字母表示处理间差异显著(<0.05);下同。
2.2 蚯蚓粪肥生物学性质变化
腐熟牛粪经过蚯蚓取食消解后,EM和IEM两个处理的微生物生物量碳氮含量总体呈先升后降的变化趋势,20 d时均达到峰值(表3)。IEM处理的微生物生物量碳氮含量在10 d时显著高于EM处理,微生物生物量碳、氮分别较EM处理提高43.9%、96.1%,40 d时两个处理间已无显著性差异。
EM处理的脲酶、碱性磷酸酶和过氧化氢酶活性在20 ~ 30 d达到峰值。IEM处理的3种酶活性在10 d时较EM处理有不同程度的提高,除脲酶活性外,其碱性磷酸酶和过氧化氢酶活性均在10 d时达到峰值,分别较EM处理显著提高113.0%、61.0%。40 d时除IEM处理的脲酶活性显著高于EM处理外,两个处理间的碱性磷酸酶与过氧化氢酶活性差异不显著。

表3 养殖周期内普通蚯蚓粪肥和菊糖型蚯蚓粪肥的微生物生物量碳氮含量及酶活性
2.3 蚯蚓粪肥功能菌数量的变化
通过对蚯蚓粪肥样品进行平板涂布法分离菌落发现,其5种功能菌(有机磷细菌、无机磷细菌、根瘤菌、固氮菌、硅酸盐细菌)菌落数量级均维持在105cfu/g,有效活菌数达到106cfu/g(表4);IEM处理的有效活菌数在10 d时达到峰值,较EM处理呈倍数增长,EM处理的有效活菌数则在30 d时达到峰值,添加菊糖明显提高了前、中期(10、20 d)蚯蚓粪肥中的有效活菌数,10、20 d时IEM处理的有效活菌数分别较EM处理增加2.22倍和1.70倍。
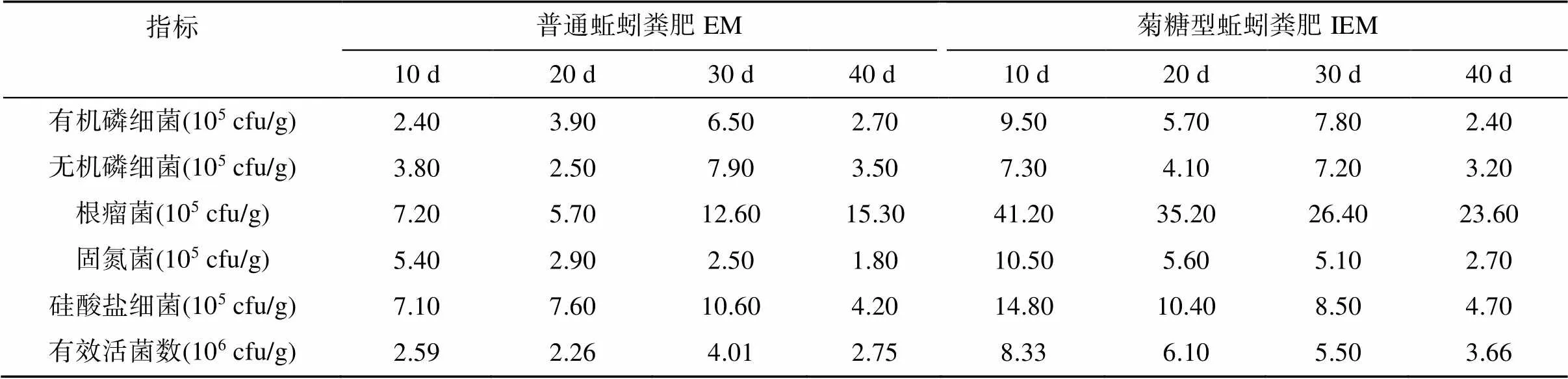
表4 养殖周期内普通蚯蚓粪肥和菊糖型蚯蚓粪肥中的功能菌数量
2.4 蚯蚓粪肥微生物OTU数与多样性指数的比较
CK样品中共生成了2 695个OTU,EM和IEM处理在整个蚯蚓堆肥过程中分别含有1 491和1 413个共有OTU,这部分共有OTU构成了蚯蚓粪肥中的核心微生物群(图1)。EM处理的4个时期样品与CK样品之间的共有OTU数量分别为2 221、2 167、2 040、1 771,IEM处理的4个时期样品与CK样品之间的共有OTU数量分别为2 202、1 970、1 872、1 812。随着蚯蚓养殖时间的增长,堆肥产物和发酵牛粪的共有细菌OTU数量逐渐减少。
Alpha多样性指数结果表明,EM和IEM两个处理各时期经过蚯蚓取食消解的基质样品,其Sobs、Shannon、Chao1、PD指数均高于原始腐熟牛粪(CK)(表5),且蚯蚓养殖前10 d的微生物多样性增长幅度最大,EM和IEM两个处理的多样性水平始终高于原始腐熟牛粪。

(CK:腐熟牛粪;EM:纯牛粪养殖蚯蚓处理;IEM:添加菊糖的牛粪养殖蚯蚓处理;下同)
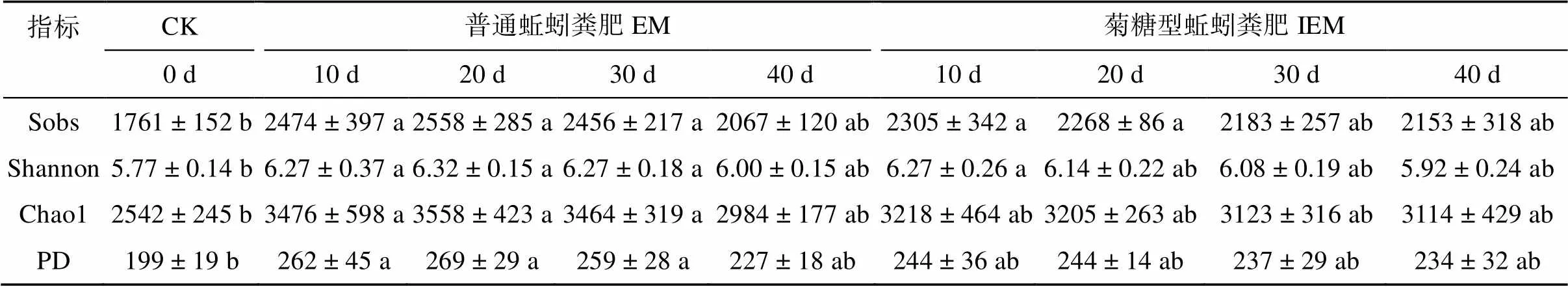
表5 养殖周期内普通蚯蚓粪肥和菊糖型蚯蚓粪肥的Alpha多样性指数
2.5 蚯蚓粪肥和蚯蚓肠道细菌群落组成的变化
腐熟牛粪经过蚯蚓的取食消解向蚯蚓粪肥转化的过程中,不同样品的细菌群落组成相似,且随着时间推移,不同门类的相对丰度动态变化表现出一定规律性(图2)。蚯蚓粪肥中的细菌群落在门水平上相对丰度较高的5个门分别是变形菌门(Proteobacteria)、放线菌门(Actinobateria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和绿弯菌门(Chloroflexi),占总序列的80% 以上。门水平上相对丰度最高的是变形菌门,在CK样品中的相对丰度为32.4%,在EM和IEM两个处理中的相对丰度则随时间推移不断增加,40 d时较CK样品分别提高了16.4% 和17.0%;其次为拟杆菌门,在CK样品中的相对丰度为24.4%,在EM和IEM两个处理中的相对丰度则随时间推移持续减少,40 d时较CK样品分别降低了28.7% 和34.4%;绿弯菌门的相对丰度变化趋势与拟杆菌门类似,40 d时EM和IEM两个处理的相对丰度较CK样品分别降低了58.2% 和57.5%。
放线菌门在CK样品中的相对丰度为8.4%,在EM和IEM两个处理中的相对丰度随着时间的推移不断增加,40 d时分别较CK样品提高了115% 和122%。IEM处理的放线菌门相对丰度在10、20 d时分别较EM处理提高了29.3%、40.7%,在养殖蚯蚓的基质中添加菊糖显著提高了前、中期蚯蚓粪肥中放线菌门的相对丰度。
放线菌门的相对丰度在蚯蚓肠道内容物中的占比高于同时期蚯蚓粪肥,蚯蚓生物反应器的转化作用可能促进了蚯蚓粪肥中放线菌门相对丰度的增长。拟杆菌门在蚯蚓肠道内容物中的相对丰度远低于蚯蚓粪肥;而厚壁菌门在前者中的相对丰度则大幅高于后者,在同时期,其在IEM处理蚯蚓肠道内容物(IEG)中的丰度要低于EM处理蚯蚓肠道内容物(EG)。
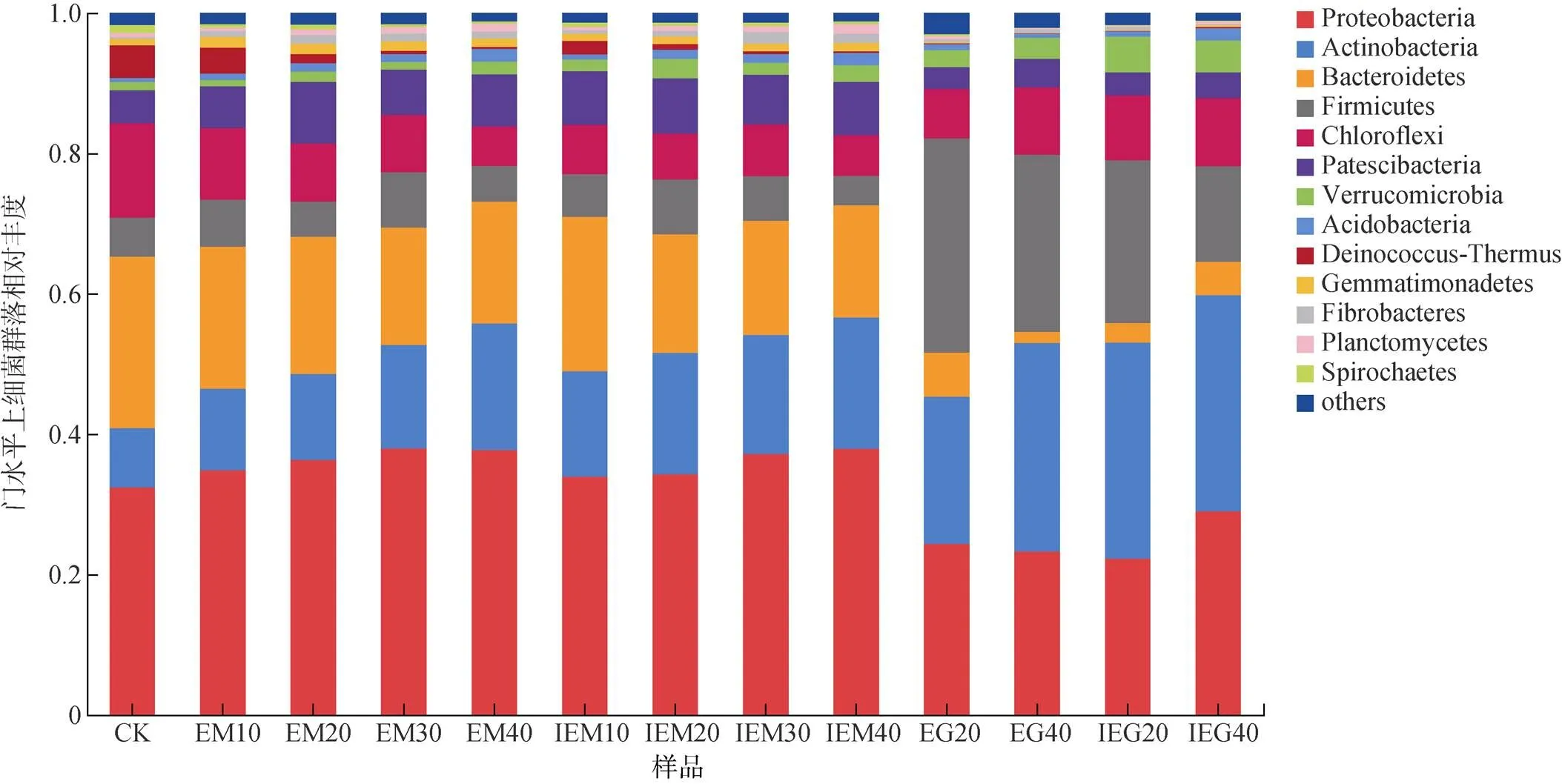
(EG:EM处理蚯蚓肠道内容物;IEG:IEM处理蚯蚓肠道内容物)
3 讨论
3.1 两种蚯蚓粪肥的基本性质
初始基质的pH是影响蚯蚓粪肥pH变化的一个重要因素。蚯蚓可以在pH 5 ~ 9的范围内存活,有研究推荐牛粪养殖蚯蚓过程中最理想的pH为7.5 ~ 8.0[15]。本试验中EM和IEM两个处理的基质pH由初始的8.18分别下降到7.87和7.97,位于理想pH区间,原因可能是蚯蚓粪肥生产过程中有机酸的积累和CO2的产生[16]。电导率(EC)反映了有机物料的盐度,经过蚯蚓的取食消解,EM和IEM两个处理在40 d时的基质EC值较原始腐熟牛粪显著下降。蚯蚓粪肥中有机质最终减少的原因是由于蚯蚓和微生物通过呼吸作用从基质中消耗了碳[17]。通常情况下,在蚯蚓取食消解过程中,有机物料首先被分解为可溶性的小分子有机物,之后才是将小分子有机物继续矿化和腐殖化的过程[18]。这也不难解释本试验初期有机质含量有稍微的增加、之后才呈逐渐降低的趋势。有研究发现,在蚯蚓粪肥生产过程中氮含量会出现下降,除了被蚯蚓与微生物吸收利用,还可能是由于基质氨化、反硝化、挥发、浸出或NH3的释放造成的[19]。蚯蚓处理牛粪过程中,磷的释放是由蚯蚓肠道磷酸酶和溶解磷酸盐的微生物完成的,这类微生物存在于成熟的蚯蚓粪肥中[20]。初始基质中存在的微生物对最终蚯蚓粪肥中磷含量的增加也起着重要作用[21]。钾与氮、磷一起对植物的生长起着重要的作用,它是植物细胞分裂和根系发育所必需的营养物质[22],蚯蚓肠道菌群通过产生解钾酸来提高钾素释放。本试验结果显示,EM和IEM两个处理的全氮含量在10 d内降幅最大,之后较为稳定,除被蚯蚓与微生物吸收消耗外还可能是前期牛粪中的NH3大量挥发导致的;全磷和全钾含量显著提高的主要原因是随着基质降解,CO2、NH3等气体的放出导致了物料干物质量的减少,从而增加了全磷和全钾在物料中的占比。
3.2 两种蚯蚓粪肥的生物学性质
蚯蚓粪肥生产过程是取食牛粪的蚯蚓与基质中的微生物相互作用的生物氧化过程,从而加速有机质的分解并改变牛粪的物理和生化特性。蚯蚓通过取食、迁移和竞争等生命活动来直接或间接影响微生物活性和多样性[23],促进微生物的代谢和活动,从而强化其对有机质的降解作用[24]。同时,蚯蚓肠道富含活性微生物和酶,可以与蚯蚓粪肥中的微生物起到协同作用[25],这也是蚯蚓粪肥较常规堆肥对有机物料的分解更彻底的原因。本研究结果显示,两种蚯蚓粪肥中的微生物生物量碳氮含量呈现先升后降的趋势,10 d时IEM处理的微生物生物量碳氮含量均显著高于EM处理,前期基质内丰富的养分资源和蚯蚓活动促进了微生物的大量繁殖。酶是物质代谢的重要参与者,特定酶活性的变化可以反映特定物质的代谢速度,也从一定程度上反映了牛粪向蚯蚓粪的分解转化状态。本试验中两种蚯蚓粪肥中的脲酶、碱性磷酸酶和过氧化氢酶活性在不同时间阶段中均出现过峰值,且IEM处理的碱性磷酸酶和过氧化氢酶活性峰值的出现时间均早于EM处理,表明菊糖的添加促进了蚯蚓粪肥微生物活性从而加快其生物学性质的变化。通过平板涂布法分离两种蚯蚓粪肥中的菌落,发现IEM处理的5种功能菌数量在各时期均高于EM处理,且前期尤为明显,菊糖的添加一定程度上提高了蚯蚓粪肥中的有效活菌数。现有的研究表明,菊糖在调节肠道微生物的菌群结构中起到重要作用[26]。菊糖对蚯蚓粪肥生物学性质的影响可能有两个方面的原因:一方面,菊糖能够作为碳源被蚯蚓粪肥中的微生物直接利用,为微生物的大量繁殖提供更高的营养水平;另一方面,菊糖能够被蚯蚓取食,在蚯蚓肠道中被微生物间接利用,进一步提高蚯蚓粪肥品质。
3.3 两种蚯蚓粪肥及蚯蚓肠道的微生物群落结构
食物和环境是影响动物肠道微生物群落结构的重要因素[27-28]。蚯蚓肠道内含有丰富的黏液,较高的湿度和稳定的pH,是微生物的理想栖息地[29]。放线菌被认为是蚯蚓肠道菌群中最占优势的微生物之一,研究表明,蚯蚓肠道中含有活跃的放线菌,且其中大多数是链霉菌,可通过释放几丁质酶和抗生素来降解植物病原菌,限制病原微生物的生长[30-32]。蚯蚓粪中的链霉菌可对大多数真菌病原体产生拮抗作用[33-34]。肠道中的变形菌门可以发酵食物成分,帮助宿主消化和吸收营养物质,增强宿主体内的营养和能量代谢[35]。本研究发现,蚯蚓肠道中存在大量的放线菌门、变形菌门、厚壁菌门等菌群,这与Aira等[36]的研究结果一致。经过蚯蚓肠道作用后,蚯蚓粪肥中的放线菌门丰度得到了提高,说明一部分蚯蚓肠道菌群会伴随着蚯蚓排泄作用进入到粪肥基质中,之后在粪肥中也可能会进一步地增殖[37]。
蚯蚓粪肥含有不同性质的微生物种群,与嗜热堆肥相比,这些微生物种群更加多样化。在蚓粪基质中,微生物与蚯蚓活动有着密切的联系,蚯蚓的生命活动促进有机物料进行生化降解,而此进程又进一步提高了微生物的活性。蚯蚓取食消解牛粪后,通过蚯蚓肠道增加了黏液和酶,提高了其比表面积,以便微生物作用分解[38]。蚯蚓与微生物之间的这种相互关系对优质肥料的生产具有重要作用。本试验中,经过蚯蚓取食消解产生的两种蚯蚓粪肥微生物多样性和功能菌群数量远高于原始腐熟牛粪,且两种蚯蚓粪肥细菌群落组成的改变具有明显的时间效应,优势微生物的增加或减少具有连续性。变形菌门、放线菌门和拟杆菌门在两种蚯蚓粪肥中属于优势菌门,且在蚯蚓堆肥过程中前两者的相对丰度持续增加,而拟杆菌门的相对丰度则不断下降。优势微生物在牛粪向蚯蚓粪肥的转化过程中起着重要作用,拟杆菌门包含多种具有较强水解能力的细菌,可水解淀粉、纤维素、蛋白质和几丁质等[39]。拟杆菌门的逐步减少说明基质中可降解的有机物逐渐达到稳定的状态;放线菌门则是难降解有机物的主要降解者,养殖后期基质中丰富的放线菌通常被认为是蚯蚓粪肥达到成熟期的重要指标[40]。Aira等[41]及Sampedro和Domínguez[42]报道了蚯蚓肠道和粪便中的微生物群能够消化以多糖为代表的小分子有机物和以纤维素为代表的大分子复杂有机物,微生物菌群之间也存较强的相互作用,进而促进了蚯蚓养殖系统中基质的快速分解矿化。本试验结果显示,纯牛粪中添加菊糖提高了前、中期(10、20 d)蚯蚓粪肥中放线菌门的相对丰度,菊糖作为碳源可能被特定微生物选择性吸收利用,而关于菊糖对蚯蚓粪肥中微生物群落结构的影响机制有待进一步研究。
4 结论
1)牛粪被蚯蚓取食消解后产生的两种蚯蚓粪肥性质较为一致,但各项理化指标随时间的变化趋势有所不同,最终表现为pH趋于中性,EC显著下降,氮元素被同化利用,有机质加速分解矿化,磷钾元素得到不同程度的富集。在蚯蚓堆肥基质中添加菊糖提高了有机质的降解效率与钾的富集。
2)添加菊糖能够缩短蚯蚓粪肥中过氧化氢酶和碱性磷酸酶活性峰值的出现时间,较普通蚯蚓粪肥提前10 ~ 20 d达到峰值,从而加速有机物料的分解矿化进程,促进高品质蚯蚓粪肥的形成。
3)蚯蚓的取食消解活动为微生物的生长繁殖提供了优良的环境条件,显著提高了微生物多样性,且对特定的微生物类群丰度具有选择性调控作用。添加菊糖提高了蚯蚓消解活动产物—— 蚯蚓粪肥的功能菌群数量和生物活性。本研究明确了菊糖在蚯蚓粪肥生产过程中发挥的益生作用,为生产优质蚯蚓粪肥提供了理论依据。
[1] 徐成龙, 董奕岑, 卢家磊, 等. 我国滨海盐碱地土壤改良及资源化利用研究进展[J]. 世界林业研究, 2020, 33(6): 68–73.
[2] 吕晓, 徐慧, 李丽, 等. 盐碱地农业可持续利用及其评价[J]. 土壤, 2012, 44(2): 203–207.
[3] 张建兵, 杨劲松, 李芙荣, 等. 有机肥与覆盖对苏北滩涂重度盐渍土壤水盐调控效应分析[J]. 土壤学报, 2014, 51(1): 184–188.
[4] 吴军虎, 邵凡凡, 刘侠. 蚯蚓粪对土壤团聚体组成和入渗过程水分运移的影响[J]. 水土保持学报, 2019, 33(3): 81–87.
[5] Lv B, Xing M Y, Yang J. Exploring the effects of earthworms on bacterial profiles during vermicomposting process of sewage sludge and cattle dung with high-throughput sequencing[J]. Environmental Science and Pollution Research International, 2018, 25(13): 12528–12537.
[6] 王福友, 王冲, 刘全清, 等. 腐植酸、蚯蚓粪及蚯蚓蛋白肥料对滨海盐碱土壤的改良效应[J]. 中国农业大学学报, 2015, 20(5): 89–94.
[7] Zhang W W, Cao J, Zhang S D, et al. Effect of earthworms and arbuscular mycorrhizal fungi on the microbial community and maize growth under salt stress[J]. Applied Soil Ecology, 2016, 107: 214–223.
[8] 胡艳霞, 孙振钧, 孙永明, 等. 蚯蚓粪对黄瓜炭疽病的系统诱导抗性作用[J]. 应用生态学报, 2004, 15(8): 1358–1362.
[9] Wu Y P, Li Y F, Zhang Y, et al. Responses of saline soil properties and cotton growth to different organic amendments[J]. Pedosphere, 2018, 28(3): 521–529.
[10] Yang J Y, Rose D J. The impact of long-term dietary pattern of fecal donor onfecal fermentation properties of inulin[J]. Food & Function, 2016, 7(4): 1805–1813.
[11] 张泽生, 刘亚萍, 李雨蒙, 等. 菊粉的研究与开发[J]. 中国食品添加剂, 2017(10): 183–188.
[12] Roberfroid M B. Functional foods: Concepts and application to inulin and oligofructose[J]. The British Journal of Nutrition, 2002, 87(Suppl 2): S139–S143.
[13] Kleessen B, Schwarz S, Boehm A, et al. Jerusalem artichoke and chicory inulin in bakery products affect faecal microbiota of healthy volunteers[J]. The British Journal of Nutrition, 2007, 98(3): 540–549.
[14] 王曦, 苏章庭, 李宏, 等. 平板计数法与纸片法检测食品微生物菌落总数的比较研究[J]. 食品安全质量检测学报, 2020, 11(16): 5489–5493.
[15] Garg V K, Gupta R. Optimization of cow dung spiked pre-consumer processing vegetable waste for vermicomposting using[J]. Ecotoxicology and Environmental Safety, 2011, 74(1): 19–24.
[16] 朱欣洁, 孙先锋, 周秋丹, 等. 好氧堆肥与蚯蚓堆肥对污泥处理污泥效果比较研究[J]. 环境科学与技术, 2015, 38(4): 79–83,111.
[17] Bansal S, Kapoor K K. Vermicomposting of crop residues and cattle dung withfoetida[J]. Bioresource Technology, 2000, 73(2): 95–98.
[18] Varma V S, Yadav J, Das S, et al. Potential of waste carbide sludge addition on earthworm growth and organic matter degradation during vermicomposting of agricultural wastes[J]. Ecological Engineering, 2015, 83: 90–95.
[19] Kumar R, Verma D, Singh B L, et al. Composting of sugar-cane waste by-products through treatment with microorganisms and subsequent vermicomposting[J]. Bioresource Technology, 2010, 101(17): 6707–6711.
[20] Suthar S, Singh S. Feasibility of vermicomposting in biostabilization of sludge from a distillery industry[J]. Science of the Total Environment, 2008, 394(2/3): 237–243.
[21] Vinotha S P, Parthasarathi K, Ranganathan L S. Enhanced phosphatase activity in earthworm casts is more of microbial origin[J]. Current Science, 2000, 79(9): 1158–1159.
[22] Yadav A, Garg V K. Vermicomposting - An effective tool for the management of invasive weed[J]. Bioresource Technology, 2011, 102(10): 5891–5895.
[23] 郑金伟, 李辉信, 胡锋. 不同处理方式对奶牛粪细菌群落多样性及群落结构的影响[J]. 农业环境科学学报, 2009, 28(3): 555–558.
[24] Jouquet P, Plumere T, Thu T D, et al. The rehabilitation of tropical soils using compost and vermicompost is affected by the presence of endogeic earthworms[J]. Applied Soil Ecology, 2010, 46(1): 125–133.
[25] Lazcano C, Gómez-Brandón M, Domínguez J. Comparison of the effectiveness of composting and vermicomposting for the biological stabilization of cattle manure[J]. Chemosphere, 2008, 72(7): 1013– 1019.
[26] 赵孟良, 任延靖. 菊粉及其调节宿主肠道菌群机制的研究进展[J]. 食品与发酵工业, 2020, 46(7): 271–276.
[27] Thakuria D, Schmidt O, Finan D, et al. Gut wall bacteria of earthworms: A natural selection process[J]. The ISME Journal, 2010, 4(3): 357–366.
[28] 陈浩, 赵海涛, 姚振飞, 等. 饵料对蚯蚓粪细菌群落结构多样性的影响[J]. 农业环境科学学报, 2012, 31(12): 2500–2505.
[29] 曹佳, 王冲, 皇彦, 等. 蚯蚓对土壤微生物及生物肥力的影响研究进展[J]. 应用生态学报, 2015, 26(5): 1579–1586.
[30] 宋清姿, 王一丁, 周艳玲, 等. 耕作土壤中蚯蚓肠道可培养放线菌的多样性研究[J]. 四川师范大学学报(自然科学版), 2016, 39(2): 284–288.
[31] Yu J C, Liu Q, Liu Q, et al. Effect of liquid culture requirements on antifungal antibiotic production byMY02[J]. Bioresource Technology, 2008, 99(6): 2087–2091.
[32] 汪学军, 闫双林, 闵长莉, 等. 蚯蚓粪中放线菌分离及其抗菌活性研究[J]. 中国中药杂志, 2015, 40(4): 614–618.
[33] Jayasinghe B A T D, Parkinson D. Earthworms as the vectors of actinomycetes antagonistic to litter decomposer fungi[J]. Applied Soil Ecology, 2009, 43(1): 1–10.
[34] Pathma J, Sakthivel N. Molecular and functional characterization of bacteria isolated from straw and goat manure based vermicompost[J]. Applied Soil Ecology, 2013, 70: 33–47.
[35] Yasir M, Aslam Z, Kim S W, et al. Bacterial community composition and chitinase gene diversity of vermicompost with antifungal activity[J]. Bioresource Technology, 2009, 100(19): 4396–4403.
[36] Aira M, Bybee S, Pérez-Losada M, et al. Feeding on microbiomes: Effects of detritivory on the taxonomic and phylogenetic bacterial composition of animal manures[J]. FEMS Microbiology Ecology, 2015, 91(11): fiv117.
[37] 杨格格, 邢美燕, 马小杰, 等. 蚯蚓-微生物协同作用过程中的微生物特性[J]. 环境工程, 2017, 35(1): 124–128.
[38] Yadav A, Garg V K. Feasibility of nutrient recovery from industrial sludge by vermicomposting technology[J]. Journal of Hazardous Materials, 2009, 168(1): 262–268.
[39] Chen Y X, Chang S K C, Chen J, et al. Characterization of microbial community succession during vermicomposting of medicinal herbal residues[J]. Bioresource Technology, 2018, 249: 542–549.
[40] Huang K, Li F S, Wei Y F, et al. Changes of bacterial and fungal community compositions during vermicomposting of vegetable wastes byfoetida[J]. Bioresource Technology, 2013, 150: 235–241.
[41] Aira M, Monroy F, Domínguez J. Earthworms strongly modify microbial biomass and activity triggering enzymatic activities during vermicomposting independently of the application rates of pig slurry[J]. Science of the Total Environment, 2007, 385(1/2/3): 252–261.
[42] Sampedro L, Domínguez J. Stable isotope natural abundances (δ13C and δ15N) of the earthwormand other soil fauna living in two different vermicomposting environments[J]. Applied Soil Ecology, 2008, 38(2): 91–99.
Effect of Inulin on Characters of Earthworm Manure and Its Regulation Process
CAO Huixiang, LI Shuai, YANG Min, HUANG Ting, LI Yuan, GAN Quanfeng, XIE Junwei, ZHAO Gengmao*
(College of Resources and Environmental Sciences/Jiangsu Provincial Key Laboratory of Marine Biology, Nanjing Agricultural University, Nanjing 210095, China)
The probiotic effect of inulin on earthworms and the formation process of earthworm manure with high vigor were discussed through the experiment of earthworm composting in order to provide theoretical basis for the construction of ecological agriculture, pastoral mode and the remediation of obstacle soil in tidal shoal. Cattle manure,and inulin were used in this study as materials to explore the dynamic change processes of cattle manure, earthworm intestinal contents, common earthworm manure and inulin type earthworm manure, respectively, by using pure cattle manure breeding earthworm (EM) and inulin added cattle manure breeding earthworm (IEM). The breeding cycle was lasted for 40 days,samples were taken and analyzed every 10 days. The results showed that the basic properties of inulin type earthworm manure and common earthworm manure formed by the decomposed cow manure with or without inulin were similar: pH tended to be neutral, electrical conductivity decreased significantly, nitrogen was absorbed and utilized, organic matter was accelerated to decompose and mineralize, and phosphorus and potassium were further released. However, the addition of inulin improved the degradation efficiency of organic matter and the release of potassium. After 40 days, the organic matter content of earthworm manure in IEM treatment was 9.4% lower than that in EM treatment, while the total potassium content in IEM treatment was 13.0% higher than in EM treatment. The activities of urease, alkaline phosphatase and catalase in EM treatment increased at first and then decreased, and the peak value appeared on 20–30d. However, IEM treatment shortened the time of peak of enzyme activity (except ureaseactivity), alkaline phosphatase and catalase activities reached their peaks at 10 days, and their values were increased by 113.0% and 61.0% respectively compared with EM treatment. After 10 days of breeding, the microbial diversities of common earthworm manure and inulin type earthworm manure increased significantly, and the number of functional bacteria of inulin type earthworm manure increased multiple times. The addition of inulin increased the relative abundance of Actinobacteria in earthworm manure at the early and middle periods (10 and 20 days), and increased by 40.7% compared with EM treatment at 20 days. In conclusion, inulin can regulate the process of earthworm composting and the properties of earthworm manure. The inulin-type earthworm manure obtained after 20 days of vermicomposting has high biological activity and good quality.
Earthworm manure; Inulin; Enzymatic activity; Community structure; Microbial diversity
S154
A
10.13758/j.cnki.tr.2022.01.008
曹惠翔, 李帅, 杨敏, 等. 菊糖对蚯蚓粪肥性状的影响及调控过程. 土壤, 2022, 54(1): 55–63.
国家重点研发项目(2019YFD0900702, 2020YFD0900703)、国家自然科学基金中美联合项目(20191J006)和山东省重点研发计划项目(2019JZZY020614)资助。
(seawater@njau.edu.cn)
曹惠翔(1996—),男,山东烟台人,硕士研究生,主要从事滩涂生态学研究。E-mail:2018103009@njau.edu.cn
