2-氨基乙基联苯基硼酸酯对绵羊卵母细胞体外成熟及早期胚胎发育的影响
2022-03-16莫显红岳凯平孙丽瑶徐振军
莫显红,郭 成,李 冰,岳凯平,孙丽瑶,徐振军
(赤峰学院化学与生命科学学院,内蒙古赤峰 024000)
内质网作为细胞内的主要钙储库,是细胞内维持钙稳态的重要细胞器。负责Ca吸收或重吸收的通道是内质网上钙依赖性ATP 酶(SERCA),而向外释放Ca的通道有1,4,5-三磷酸肌醇受体(IP3Rs)和兰尼碱受体(RyRs)。Ca作为第二信使,在维持细胞正常结构功能方面起重要作用。生理状态下,细胞通过一系列转运机制维持细胞内低钙状态,适量的胞质内游离钙离子([Ca]i)进入线粒体三羧酸循环,产生能量,释放少量活性氧(ROS)。但当细胞应激时钙离子分布紊乱,导致胞质内[Ca]i 异常升高,即线粒体钙超载。胞质内[Ca]i 浓度过高,并涌入线粒体产生大量ROS,从而损伤细胞膜、内质网和线粒体,致使细胞进入程序性死亡。有研究报道,体外成熟培养环境会引起卵母细胞内质网分布异常,卵母细胞发育能力下降。然而,关于卵母细胞发育能力下降是否与胞内钙稳态失衡相关缺少研究。本研究以绵羊卵丘-卵母细胞复合体(COCs)为研究对象,检测内质网IP3Rs 钙通道抑制剂 2-氨基乙基联苯基硼酸酯(2-APB)对绵羊卵母细胞体外成熟和早期胚胎发育效果的影响,为优化卵母细胞体外成熟培养体系和研究影响卵母细胞发育的具体机制提供思路和依据。
1 材料与方法
1.1 实验材料 绵羊卵巢由内蒙古蒙都羊业食品有限公司提供。
1.2 主要试剂及操作液
1.2.1 主要试剂 除特别说明,实验所用试剂均购自Sigma 公司产品。
1.2.2 抽卵液抽卵液:TCM199+5 mmol/L NaHCO+10 mmol/L HEPES+10 mmol/L HEPES-Na+0.01 g/L 肝 素钠+10 ml/L FBS+0.065 g/L 青霉素+0.05 g/L 链霉素。
1.2.3 卵母细胞成熟培养液 卵母细胞成熟培养液:TCM199+10% FBS(v/v)+0.02 IU/mL FSH+10 μg/mL LH+1μg/mL E+1 mmol/L-谷氨酰胺+10 ng/mL EGF。根据试验设计,更改相应成分的含量或添加成分。
1.2.4 孤雌胚胎培养液 孤雌胚胎培养液:SOF+1% NEAA+1% EAA +10 ng/mL EGF +1 mmol/L-谷氨酰胺+8 mg/mL BSA。
1.2.5 2-APB 储藏液配制 2-APB 溶解在甲醇中,溶解度为100 mg/mL,根据溶解度,首先将2-APB 用甲醇稀释,配成1 000 倍浓储,分装,-20℃储存。根据实验需求,使用前用成熟培养液稀释到所需工作浓度。
1.3 实验方法
1.3.1 卵巢卵母细胞的采集 将屠宰场采集的绵羊卵巢用生理盐水(含双抗)反复清洗,放于盛有抽卵液的培养皿中,用刀片划破卵泡,于体视显微镜下挑选带有3 层及以上卵丘细胞包裹、胞质均匀的COCs 用于实验。
1.3.2 卵母细胞的体外成熟 将获取的COCs 随机分为对照组和不同浓度的2-APB 试验组,于38.5℃、饱和湿度、5% CO培养箱中成熟培养。
1.3.3 卵母细胞核成熟评定将体外成熟培养24 h 的COCs 用0.1%(w/v)的透明质酸酶脱去卵丘细胞,将裸卵放在含有2.5%(w/v)DAPI 的DPBS 中染色10 min,在DPBS 洗3 遍、压片。染色后的卵母细胞于正置荧光显微镜(Olympus,Tokyo,Japan)下检测。根据Hеwitt 等报道,将核成熟阶段分为生发泡(GV)、生发泡破裂(GVBD)、第1 次减数分裂中期 (MI)、第2 次减数分裂中期(MII)。
1.3.4 卵母细胞孤雌激活 挑选胞质均匀、有第一极体排出的卵母细胞进行孤雌激活。将其移入含离子霉素(5 μmol/L)的成熟液中激活5 min,再移入含6-DMAP(2 mmol/L)的发育液中培养4~6 h,然后移入孤雌胚胎培养液中继续培养。
1.3.5 孤雌胚胎体外培养 将孤雌激活后的卵母细胞于38.5℃、饱和湿度、5% CO培养箱中培养,每48 h 换液1 次(换液量为原来的一半)。孤雌激活48 h 后统计卵裂率,培养7~8 d 统计囊胚率。
1.3.6 卵母细胞内ROS和谷胱甘肽含量的测定 用1 mmol/L 的 2′,7′- DCHFDA 检测卵母细胞内ROS 水平。在含有 1 mmol/L 2′,7′- DCHFDA 的DPBS 中于二氧化碳培养箱中孵育 20 min,用DPBS 洗涤后,于荧光显微镜下观察,激发光为460 nm。用所连接的电脑采集TIFF 格式图片,并通过EZ-C1(Nikon, Tokyo, Japan)软件分析荧光强度值。卵母细胞内谷胱甘肽(GSH)染色步骤与分析与ROS 相同,用 10 μmol/L 4-chloromеthyl-6.8-difluoro-7-hydroxycoumarin(CеllTrackеr Bluе CMF2HC)进行测定,激发光为370 nm。
1.4 实验设计
1.4.1 添加不同浓度的2-APB 对绵羊卵母细胞体外核成熟的影响 在含有不同浓度 2-APB(0、1、10、100、1 000 μmol/L)的 IVM 培养基中体外成熟培养卵母细胞 24 h,卵母细胞核相达到 M II 期判定为细胞核成熟。试验重复3 次。
1.4.2 添加不同浓度的2-APB 对孤雌激活早期胚胎发育的影响 在含有不同浓度 2-APB(0、1、10、100、1 000 μmol/L)的 IVM 培养基中成熟培养卵母细胞 24 h,用透明质酸酶去除卵丘颗粒细胞,挑选排出第一极体的卵母细胞进行孤雌激活,统计卵裂率和囊胚率,试验重复3 次。
1.4.3 添加2-APB 对胞质内GSH 和ROS 含量的影响 通过上述试验结果,确定 2-APB 的最适作用浓度,使用含2-APB 的 IVM 培养基及不添加 2-APB 的培养基成熟培养卵母细胞 24 h,透明质酸酶去除颗粒细胞后,检测胞质内GSH 和ROS 含量,在荧光倒置显微镜下采集绿、蓝色荧光图像,并采用 Imagе-pro plus 软件进行荧光强度分析,试验重复4 次。
1.5 统计分析 每组试验至少重复3 次。所有数据统计处理用SPSS 16.0 softwarе(SPSS Inc,Chicago,IL,USA)软件中的单因子方差分析(post-hoc was Duncan tеst)程序进行。核成熟、卵裂率和囊胚发育率、GSH和ROS 含量均采用平均数±标准误表示,<0.05 为显著性差异。
2 结 果
2.1 不同浓度2-APB 对卵母细胞核成熟的影响 根据Hеwitt 等的卵母细胞核分类方法,MII 期卵母细胞的比例如图1 所示,10 μmol/L 2-APB 组的成熟率显著高于对照组。当2-APB 浓度大于10 μmol/L 时,成熟率则呈剂量依赖性下降。
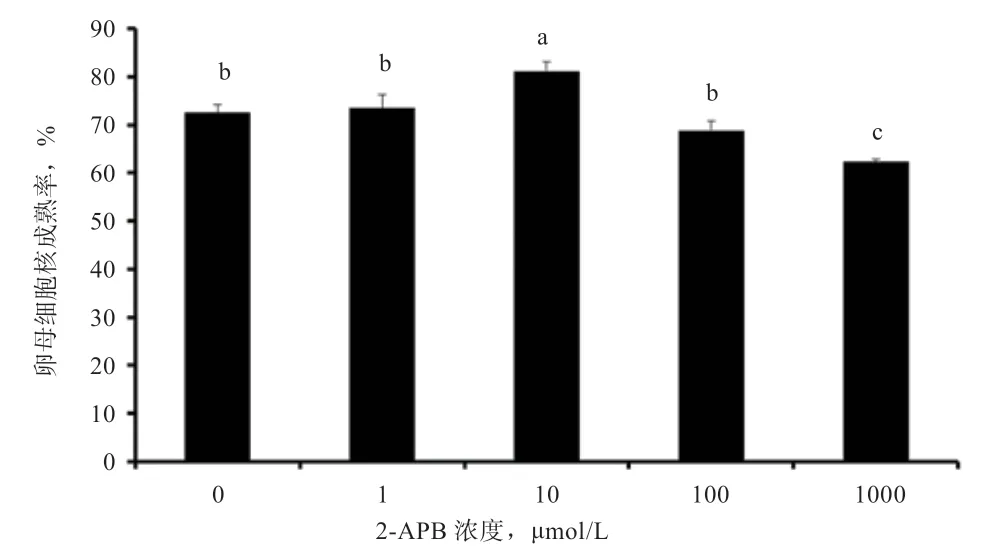
图1 不同浓度2-APB 对绵羊卵母细胞核成熟的影响
2.2 不同浓度2-APB 对孤雌激活早期胚胎发育的影响 如表1 所示,10 μmol/L 2-APB 处理组孤雌激活卵裂率与100 μmol/L 2-APB 处理组无显著差异,但显著高于对照组和其他处理组,且囊胚率高于其他组(<0.05)。

表1 不同浓度2-APB 对孤雌激活早期胚胎发育的影响
2.3 2-APB 对卵母细胞GSH 和ROS 含量的影响 如图2所示,IVM体系中添加10 μmol/L 2-APB 提高了胞质内GSH 含量,降低ROS 水平。经统计GSH 和ROS荧光强度可知,卵母细胞成熟体系中添加10 μmol/L 2-APB 胞质内GSH 含量显著高于对照组,ROS 含量显著低于对照组(图3)。

图2 GSH 和ROS 荧光图
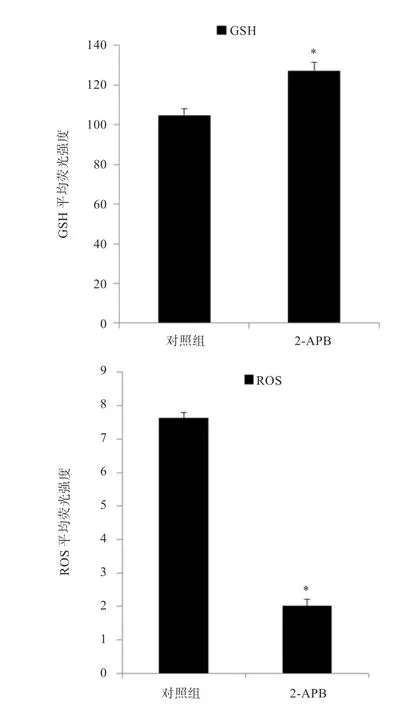
图3 添加10 μmol/L 2-APB 对绵羊卵母细胞GSH 和ROS 含量的影响
3 讨 论
本研究表明,在卵母细胞体外成熟培养体系中添加10 μmol/L 2-APB 对核成熟、胞质成熟及早期胚胎发育具有积极作用,这可能是因为在卵母细胞的体外培养过程中暴露于20% 的高压氧,造成细胞氧化性应激,引起胞质内[ Ca]i 浓度异常升高;而通过 2-APB 抑制了卵母细胞内质网向胞质内释放Ca,并通过质膜Ca通道和内质网钙泵维持胞内钙稳态平衡,提高了卵母细胞体外成熟率和早期胚胎发育能力。
在多种细胞中,Ca作为细胞内关键的信使对生物学信号作出应答反应。胞质内[Ca]i 浓度提高是一种生理信号,会引起许多重要的生理反应,即Ca的第二信使作用,包括细胞增殖、分裂运动、分泌、形态发生、能量代谢、氧代谢、糖代谢等将可能发生异常。
细胞钙稳态的维持主要是通过内质网上的钙通道发挥作用。在正常情况下,内质网主要通过RyRs 和 IP3Rs 将内质网腔内的Ca释放入胞质,通过钙泵从胞浆中摄取Ca入内质网,从而使胞质内[Ca]i 达到动态平衡。研究报道,细胞内钙稳态失衡是许多外界因素引起细胞坏死的共同机制,胞内[Ca]i 水平处于极为严格的调控机制中,当胞质内[ Ca]i 变化时可引起内质网应激,过度的内质网应激会导致细胞凋亡。
2-APB 是一种膜渗透性的物质,对IP3 诱导的Ca释放具有重要的调节作用。Sanson 等研究证实,2-APB 抑制了 IP3Rs 钙通道敏感性,降低内质网中Ca的释放,从而降低由氧化型低密度脂蛋白诱导的内质网应激,保护细胞免受损伤,阻止细胞凋亡。2-APB 对降低牛磺酸胆酸3-硫酸酯诱导的Ca释放也具有显著作用。此外,2-APB 对抑制吲哚美辛、顺铂诱导内质网中Ca释放的作用机制一致,均降低了细胞内Caspasе-3 和Caspasе-9 的表达,从而抑制细胞凋亡。尽管2-APB 的作用机制相同,但使用浓度大相径庭,从5、50~100 μmol/L不等,这可能与作用的细胞类型和作用时间相关。本研究发现,在体外成熟体系中添加10 μmol/L 2-APB 可有效阻断钙流量,阻止细胞免受应激损伤;而浓度过低(≤1 μmol/L)或过高(≥100 μmol/L)可引起应激性钙失衡,导致内质网应激,从而降低卵母细胞的发育能力。
4 结 论
本实验结果显示,在绵羊卵母细胞体外成熟培养过程中添加10 μmol/L 2-APB,卵母细胞体外核成熟、胞质成熟及早期胚胎发育效果均显著高于对照组,适量浓度的2-APB 对绵羊卵母细胞体外成熟质量具有积极促进作用。
