饲料原料中抗营养因子的研究进展
2022-03-15梁洪慧谭会泽赵江涛王凤麟区美怡
梁洪慧,谭会泽,赵江涛,董 莹,何 鑫,张 瑜,王凤麟,杨 露,区美怡
(温氏食品集团股份有限公司//农业部动物营养与饲料学重点实验室,广东 云浮 527400)
随着我国社会经济发展,人民对畜牧产品需求增大,畜牧业也进入了快速发展阶段。饲料中所含的营养物质影响着畜禽的生存、生长和繁衍性能。抗营养因子(ANF)是饲料成分检测的一项关键指标,指的是植物在进化过程中产生的能够抵御外界不利因素和平衡自身营养结构的物质,但对食用的动物会产生不同程度的不良反应。本研究主要对不同类型的抗营养因子进行分析,加深对抗营养因子的认识,并整理总结各种降低或消除抗营养因子对畜禽饲料不良影响的方法。该研究对提高畜禽饲料的综合利用率、畜禽生产养殖的社会经济效益等具有重要意义。
1 抗营养因子的定义及分类
1.1 抗营养因子的定义
抗营养因子又称“营养抑制因子”或“毒性因子”,英文简称“ANF”。抗营养因子是由植物自身所分泌的某些对动物消化吸收利用产生有害作用的特殊因子构成,通过不同的作用机制使动物对饲料营养成分产生不耐性,也就是使饲料丧失一部分营养价值,同时引发机体功能紊乱、免疫力下降和代谢性疾病频发等问题。目前对抗营养因子的研究发现,抗营养因子能极大程度上延缓机体的发育和危害动物的健康[1-3]。
1.2 抗营养因子的分类
按作用不同可分为抑制蛋白质、矿物质和微量元素、维生素和碳水化合物消化利用的抗营养因子,刺激免疫系统的抗营养因子以及其它综合性抗营养因子等6大类(见表1)。按来源不同可分为动物性与植物性来源2大类[4-7](见表2)。

表1 抗营养因子按不同作用分类

表2 抗营养因子按不同来源分类
2 主要抗营养因子的理化性质以及在植物原料中的分布和含量
2.1 蛋白酶抑制因子
蛋白酶抑制因子是一种多肽或蛋白质,其为一种可与酶分子的活性中心(由结合和催化部位组成)反应从而抑制酶活的物质[9],在大豆、豌豆等豆科植物中含量较高。其中,胰蛋白酶抑制因子(KTI)和胰凝乳蛋白酶抑制因子(BBI)因抗营养作用显著而最具研究代表性[10],两者在大豆中占比为1.4%和0.6%[11]。KTI不溶于乙醇,但在酸性及90℃加热环境下均能令其失活。BBI不溶于丙酮,耐蛋白酶水解,耐酸,耐热。
2.2 植物凝集素
凝集素是一种具有多级结构的蛋白质,其分子上的活性结构——亚基能与单糖、寡糖等特异糖相结合,能与动物的红细胞发生凝集反应[12],在豆类籽实及其饼粕中含量较高,具有耐干热、不耐湿热(95℃的高温湿热环境能让其完全失活)的特性。
2.3 植酸
植酸为液体状,颜色呈无色至淡黄色,易与水、95%乙醇、丙酮等互溶,但与无水乙醇、乙醚类、苯、氯仿等不相溶[13],同时具有强酸性和强螯合能力,能与多种金属离子与蛋白质发生螯合。植酸主要来源于植物种子、根、茎中,且在菜籽粕、豆粕、棉粕中含量差异大,如在菜籽粕中所占比重较大,而在豆粕中所占比重较小[14]。常用饲料谷物原料中植酸的含量见表3。

表3 常用饲料谷物原料中植酸的含量 mg/g
2.4 单宁
单宁为黄色或淡棕色的无定形固体,略有苦涩气味。能溶于水、乙醇与甘油,但几乎不溶于乙醚、氯仿或苯等极性弱的溶剂。高粱、油菜、豆科等植物原料的籽实中含有较多的单宁[17]。菜籽粕中单宁的质量分数约为1.5%~3.1%[18]。根据结构与活性,单宁可分为水解和缩合2类[19]。水解单宁是由葡萄糖和有机酸(如咀嚼酸)形成的低聚物,易被酸解和酶解;缩合单宁是由羟基黄烷类组成的低聚物,易被酸解产生红色的花色素。
2.5 非淀粉多糖
非淀粉多糖属于复合碳水化合物,是一种区别于贮存多糖(淀粉)的结构多糖,由纤维素、半纤维素和果胶等组成,在谷物原料和粕类中含量较高。按照溶解度不同,非淀粉多糖可分为水溶性(SNSP)和水不溶性(INSP)2种。水溶性的半纤维素和果胶因强亲水性和强结合吸附性而具有抗营养特性。半纤维素中的阿拉伯木聚糖和葡聚糖抗营养作用最强[20]。非淀粉多糖在常用饲料原料的含量见表4。
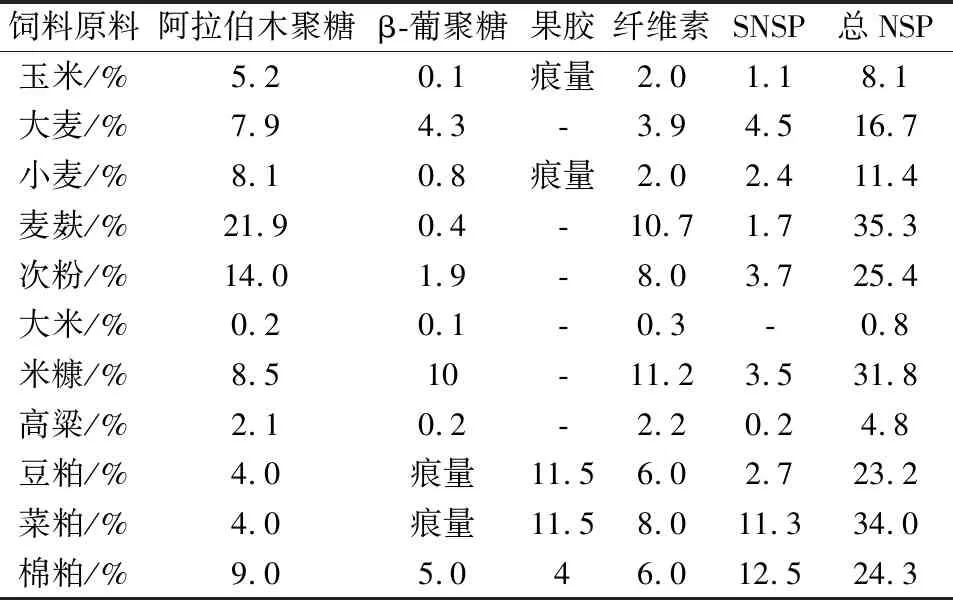
表4 各种非淀粉多糖在饲料原料中的含量(DM)[21]
3 抗营养因子的作用机制及其产生的影响
抗营养因子主要通过消耗较多内源性蛋白质[22]、降低表观代谢能[23]、螯合矿物质元素和微量元素[24]、灭活或干扰机体利用维生素[25]等表现方式减少机体对蛋白质、能量等营养物质的利用。
3.1 胰蛋白酶抑制因子
胰蛋白酶抑制因子顾名思义就是对胰蛋白酶产生抑制作用,降低酶活性,导致机体消化不良,不被消化的蛋白质与胰蛋白酶一起通过粪便排出体外,导致机体内胰蛋白酶严重流失,刺激胰腺分泌大量的胰蛋白酶,导致机体胰腺变大、蛋白质内源性损失和胱氨酸等含硫氨基酸失衡[26],且降低脂肪的吸收和采食量,影响动物的生长发育。
3.2 植物凝集素
植物凝集素作为一种抗原,能快速识别并针对性与小肠壁黏膜结合,损害其黏膜结构,使其分泌酶功能异常,改变酶活性和肠道环境,损害免疫系统[27]。同时,植物凝集素影响缩胆囊素等分泌,从而延缓胃排空速率和降低采食量[28],导致动物发育不良。当血液循环系统进入较多的植物凝集素会导致机体中毒等。
3.3 植酸
植酸作为强络合剂,通过结合某些养分,降低其溶解度,从而降低养分的吸收利用。植酸与Ca2+、Mg2+、Zn2+等金属离子相互作用生成植酸盐络合物,导致矿物质和微量元素在机体中的溶解度减小,不易被机体吸收利用。植酸螯合蛋白质分子,降低蛋白质的溶解度,同时结合蛋白酶使酶失活,降低蛋白质和能量的利用率[29]。另外,植酸能刺激机体分泌较多的内源性钠,干扰机体吸收氨基酸和葡萄糖。
3.4 单宁
单宁是一种高度聚合物,能够结合蛋白质、各种酶和维生素等。单宁能降低营养物质的消化率,主要表现方式有:①通过与胰蛋白酶、淀粉酶等相互作用,抑制酶活性;②与蛋白质和碳水化合物相互作用生成难溶物;③螯合维生素B12或Ca2+、Zn2+等多种离子。同时单宁也能降低畜禽的采食量,通过与唾液黏蛋白等发生反应,减弱唾液润滑功能使口腔有干涩感,导致机体适口性差[30]。
3.5 非淀粉多糖
水溶性非淀粉多糖(SNSP)因呈网状结构具有高度黏稠性,能够结合消化酶,抑制其活性,阻碍消化酶对养分的消化。SNSP能结合胆汁酸或脂类,引发机体排出大量的胆汁酸和降低对脂肪的吸收。SNSP也能增加肠道黏度,降低消化道中氧气的浓度,同时使养分长时间在肠道中滞留[31],为微生物的生长繁殖提供环境和养分保障,导致肠道功能失衡。
4 主要抗营养因子的检测方法
4.1 大豆胰蛋白酶抑制因子的检测
针对大豆中胰蛋白酶因子含量的检测,Kadade等[32]最早建立了酶化学检测法,主要通过酶活性对样品量的抑制曲线求出检测样品中含有的抑制因子能抑制的酶活性,但检测的精准度不高(例如过度加热样品会影响检测结果),同时检测结果还会受其它抑制因子的影响[33]。生大豆中胰蛋白酶抑制因子的变性失活程度和含量与脲酶相近[34],故采用脲酶检测法可间接检测目标抑制因子,该方法主要包括pH值增值法和滴定法[35],但脲酶的活性容易受到加热程度、水分、压力等条件影响,故适用性较差。酶联免疫吸附实验法根据所用的抗体不同,可分为多克隆抗体(酶标抗原竞争、酶标抗体直接竞争和间接抑制法[36]、间接竞争ELISA[37])和单克隆抗体(KTI免疫层析纸检测方法[38])检测方法,其中ELISA方法具有灵敏性高、特异性强的特点,但其检测结果会受到基质干扰以及交叉反应的影响[39]。
4.2 植物凝集素的检测
检测植物凝集素有3种原理不同的方法。操作简便且能快速检测的红细胞凝集法,利用了其具有凝集红细胞的能力和其凝集活力与含量呈线性关系的性质,方法主要包括试管法、Liener法以及目前普遍使用的96孔血凝板法,由于该法只能检测具有凝集活力的多价态凝集素,故对特定条件下的单体或活性功能片段尚不能采用该方法检测[40]。利用凝集素的亚基能针对性的与复合糖结合的特点,采用糖复合物法对凝集素进行检测,该方法刚开始是用放射性同位素对糖复合物进行标记[41],由于不同种类的红细胞会影响糖复合物法的凝集效果,后来又一种新方法被提出,把与相应凝集素具有结合特异性的糖复合物共价连接于聚苯乙烯胶粒上来替代红细胞[42]。凝集素本质上是一种蛋白质,其能诱导机体产生特异性抗体,利用这一点可采用抗原抗体免疫法进行检测,功能性凝集素免疫测定方法有活性凝集素免疫分析法(FLIA)、刷状缘凝集素凝集分析法(BBLAA)等。
4.3 植酸的检测
植酸的检测需首先利用萃取或离心分离方法得到植酸,在此基础上再利用化学沉淀、比色、高效液相色谱、毛细管等速电泳法等方法进行浓缩及纯化,最后分析测定。化学沉淀法也称铁沉淀法,其中磷钼蓝法则是根据植酸含量与磷含量呈负相关的特性,通过无机磷含量反推植酸含量,但铁离子还会对除IP6以外的部分IP5、IP4、IP3结合生成微溶物,测定结果会有偏差,同时该方法步骤繁琐,耗时长,误差较大[43]。比色法测定时间短,所需仪器简单,故为目前常用来检测植酸的方法,主要包括磷钼黄比色法和三氯化铁比色法[44]。高效液相色谱法(HPLC)能高效定量分析植酸,但实验投入费用较高,且实验条件苛刻[45-46]。毛细管等速电泳法(CITP)利用待分离离子有效淌度不同的特点进行分离,但其灵敏度不高,仍需再改进浓缩技术和检测技术。
4.4 单宁的检测
由于单宁具有还原性,易被氧化,故可使用氧化还原滴定法,该方法包括铁氰化钾法和高锰酸钾法,但需在高温条件下进行,同时滴定终点受实验人员的专业性影响。EDTA络合滴定法利用单宁与EDTA溶液发生酸碱中和反应生成蓝色络合物进行测定。比色法利用柠檬酸铁铵溶液生成棕色络合物、偏钒酸铵溶液生成蓝紫色络合物、磷钨酸钠溶液生成蓝色络合物后采用分光光度计比色进行测定,目前国家标准中采用柠檬酸铁铵法测定高粱中单宁的含量[47-48]。
4.5 非淀粉多糖的检测
目前,比色法和气相色谱法均是通过测定单糖的含量来计算非淀粉多糖的含量,测定结果较常规的纤维法更准确。比色法是把非淀粉多糖水解为单糖,加入显色剂与之反应,比色测定吸光值后计算含量,该法简单易行,可测定戊聚糖、β-葡聚糖等含量。气相色谱法则先用酶法提取谷物中的非淀粉多糖,通过水解和进一步衍生乙酰化后用色谱法测定含量,该法可测阿拉伯糖和木糖等含量[49]。
5 抗营养因子的消除方法
由于抗营养因子能够阻碍动物对饲料养分的消化吸收利用,采取一些常规的物理、化学、生物法以及电子束辐照法等降低和消除饲料原料中的抗营养因子,有利于提高饲料加工的效率和养分的利用率。
5.1 物理方法
加热法消除抗营养因子需满足两个条件:①抗营养因子具有热不稳定性;②严格把控加热的温度和时间。针对抗维生素因子、蛋白酶抑制因子和外源凝集素等具有受热易分解的性质,可以采取烘烤或蒸煮等干湿热法除去,但植酸、皂角苷、氰类化合物等具有耐高温的特点,加热并不能将其降解。不同的抗营养因子受热分解所需的温度和时间也不相同,因此要严格控制作用的温度和时间以求达到最佳的消除效果,避免加热过度使饲料本身的营养成分流失,如Lys、含硫AA和维生素[50],加热不足导致抗营养因子残留。Eduarde等发现,108℃条件下,加热蚕豆30 min可使其代谢能由10.25 MJ/kg升至12.89 MJ/kg。
挤压膨化法具有高温、高压和高剪切力的特点。其工作原理是在螺旋加压的条件下对饲料进行挤压,使其受热喷出并产生膨化作用,最终导致抗营养因子失效。目前国内企业适合采用干式挤压法对大豆中的抗营养因子进行钝化处理,且效果显著[51]。
水浸泡法能有效除去能与水互溶的抗营养因子,如用清水浸泡高粱一段时间后,可使其中含有的水溶性NSP与水相溶除去。但因该法存在浸泡后需烘干、投入成本较高等问题,在实际生产中不推荐使用[52]。
机械加工法通过去除植物原料中抗营养因子含量较高的部位来降低其含量。如高粱、蚕豆的外皮含有较多的单宁,通过剥掉其外皮可除去大部分的单宁。
5.2 化学方法
主要包括酸碱处理法和氨处理法,在适宜的条件下,往含有抗营养因子的饲料中加入化学试剂(硫酸铜、过氧化氢、乙醇等),发生反应使抗营养因子失效。实验证明,往含有胰蛋白酶抑制因子的生豆粕中加入浓度为10 mol/L VC和0.5 mol/L CuSO4处理1 h,在27℃和65℃条件下分别可灭活40%和90%的胰蛋白酶抑制因子。该法虽操作简单,试剂易得,但残留化学试剂不容易处理,处理不当也会带来二次污染,同时影响饲料的口感和毒害动物的健康[53]。
5.3 生物方法
酶制剂处理法利用植酸酶、单宁酶等酶制剂来钝化抗营养因子,往猪日粮中加入植酸酶后,饲料中的镁、锌、铜和铁等微量元素均能更大程度地被机体消化吸收[54],加入木聚糖酶和β-葡聚糖酶后,物质消化率提高10个百分点以上[55];该法虽高效和专一,但对环境要求较高。利用纳豆芽孢杆菌和短乳杆菌发酵菜籽粕,使植酸和单宁含量分别降低了10.1%和5.4%[56]。该法虽能使抗营养因子降解,但也能改变营养成分结构(如饲料中的蛋白质会被分解成氨基酸)。发芽处理法通过内源蛋白酶降解豆科和麦类原料中的抗营养因子,Savelkoul等对大豆进行发芽处理,发现胰蛋白酶因子和单宁含量均有不同程度的下降。
5.4 电子束辐照法
电子束辐照法利用不同剂量的电子束对饲料进行辐照处理。赵燕等[57]对豆粕进行辐照处理后,发现其中的抗营养因子显著降低;崔龙等[58]采用同样方法对豆粕、菜籽粕等饲料进行实验,发现电子束辐照法对不同的抗营养因子的抑制效果有差异,其差异可能来源各抗营养因子的热稳定性,因此需对辐照法的抑制机制进一步探讨。
6 小结与展望
抗营养因子能影响机体的消化和吸收甚至能决定一个机体的存亡。对动物来说,饲料是成长的关键,抗营养因子的相关研究有助于更好地改善动物饲养水平,同时对饲料的发展和变革有着重要的促进作用,特别是对生产线技术参数和营养配方的调控。目前,抗营养因子的检测和消除方法还存在一定的局限性,因此不断摸索更方便有效的检测和消除方法显得尤其重要,既要提高饲料利用率,同时又可以增加经济效益。
