全身磁共振扩散加权成像对多发性骨髓瘤的诊断价值
2022-03-15王亚丽崔凤珍李玉清
王 明,刘 莹,王亚丽,张 伟,崔凤珍,李玉清*
(1.河北医科大学第三医院CT/MRI室,河北 石家庄 050051;2.河北医科大学第三医院放射科,河北 石家庄 050051;3.河北省石家庄市第二医院核磁室,河北 石家庄 050051)
骨髓瘤是单克隆浆细胞恶性增生性疾病,好发于中老年人,最常侵犯骨骼系统,骨髓瘤骨病是导致多发性骨髓瘤并发症和死亡的主要原因[1-2]。磁共振扩散加权成像(diffusion weighted imaging,DWI)是目前唯一能够在活体组织内反映水分子扩散运动的成像技术,表观扩散系数(apparent diffusion coefficient,ADC)值定量反映了体内局部水分子的扩散能力,能够反映组织器官早期的病理生理状态,为疾病的诊断、分期以及预后随访提供新的思路与方法[3-5]。国际骨髓瘤工作组(international myeloma working group,IMWG)共识中推荐采用磁共振的传统序列和全身磁共振扩散加权成像(whole body diffusion weighted imaging,WB-DWI)技术诊断和评估骨髓瘤[6-7]。在英国,对所有可疑骨髓瘤的初诊患者推荐使用全身MRI(包括WB-DWI)作为一线影像检查方法[8]。目前国内将WB-DWI用于骨髓瘤诊断方面的研究较少,本研究对首诊为骨髓瘤的患者治疗前行WB-DWI检查,探讨WB-DWI在骨髓瘤诊断中的作用。
1 资料与方法
1.1一般资料 选取2018年1月—2019年12月河北医科大学第三医院经骨髓穿刺或活检和血液学指标首次确诊的骨髓瘤患者31例为试验组,其中男性17例,女性14例,另选取健康志愿者98例为对照组,其中男性47例,女性51例。2组一般资料比较,差异无统计学意义(P>0.05) 。排除标准:患者有其他恶性肿瘤或血液系统疾病;患者做过放射治疗;存在MRI检查禁忌证;患者拒绝参加者。本研究经我院伦理委员会批准,所有患者在检查前均签署MR检查知情同意书。
1.2方法
1.2.1临床观察指标 患者首诊治疗前的实验室检查项目及骨髓细胞学检查(与MRI检查时间间隔小于1周),包括血白蛋白、血红蛋白、乳酸脱氢酶、血清钙、血肌酐、血、尿免疫固定电泳、蛋白电泳、血清游离轻链检测、血、尿β2-微球蛋白(β2-microglobulin,β2-MG)检测及骨髓抽吸、活检。首诊患者的临床分期采用2017年中国多发性骨髓瘤诊治指南[9]。
1.2.2图像采集 患者于治疗前行MRI检查,包括冠状位TSE-T1WI、TSE-T2WI和轴位EPI-DWI序列。采用德国Siemens 1.5 T Avanto超导型MR机,4导体部表面线圈。 T1WI的扫描参数为:TR 796 ms,TE 11 ms,FOV 44 cm×44 cm,层厚5.0 mm,矩阵384×384,采集次数2次。T2WI 的扫描参数:TR 5 190 ms,TE 64 ms,FOV 44 cm×44 cm,层厚5.0 mm,矩阵384×384,采集次数2次。EPI-DWI序列的参数:TR 8 000 ms,TE 83 ms,FOV 50 cm×50 cm,层厚4.0 mm,无间距扫描,矩阵192×192,采集次数6次;扩散敏感系数b值取0和800 s/mm2。WB-DWI扫描范围从头顶至膝关节,分5段完成,每段60层,范围为240 mm,完成一段数据采集后,检查床自动前进至下一段进行扫描,扫描结束后自动生成b值为800 s/mm2的ADC图。对扫描所得DWI横断面图像进行MIP重组,然后采用黑白翻转技术,生成类PET图像。
1.2.3图像分析 由2名高年资MR肌骨影像医师对所有患者的图像进行双盲分析,逐一观察患者的T1WI、T2WI、DWI、类PET图像及ADC图,分析病变部位、分布及信号特点,不一致处采用协商方法解决。
1.2.4ADC值测量 利用Siemens数据测量软件包直接在b值为800 s/mm2的ADC图上测量。将全身分为如下几个部位:头颅、胸骨、肋骨、肩胛骨、肱骨、颈椎、胸椎、腰椎、骶椎、髂骨、股骨和髓外病变。每个部位取5个感兴趣区测量,然后求平均值,最后将各部位的ADC值取平均值。当患者病变为局灶性病变时,每一部位选取5个较大病变测量;当患者病变为弥漫分布时,感兴趣区放置要尽量大,同一部位的每个感兴趣区尽量相同,且要避开出血、坏死、血管、椎间盘等成分。
1.3统计学方法 应用SPSS 19.0统计软件分析数据。计量资料比较采用t检验或秩和检验。采用Spearman相关性分析首诊时髂骨ADC值与骨髓瘤细胞百分比的相关性以及首诊时全身各部位ADC均值与临床化验指标的相关性。P<0.05为差异有统计学意义。
2 结 果
2.1临床资料及影像学表现 临床影像资料齐全的患者共31例,其中男性17例,女性14例,年龄45~79岁,平均(59.9±8.3)岁。病变分布为斑点/斑片状局灶性或弥漫性分布(图1,2),在T1WI上呈等或低于临近肌或椎间盘信号,T2WI压脂序列图像上呈高信号,DWI(b=800 s/mm2)图像上呈高信号,ADC图呈低信号。出现骨髓外病变患者3例,其中表现为临近骨的骨质破坏伴周围软组织肿块2例(图3),另表现为眶周眼球前方软组织内斑片状异常信号1例,DWI(b=800 s/mm2)图像上呈高信号,类PET上呈低信号,ADC图呈低信号。
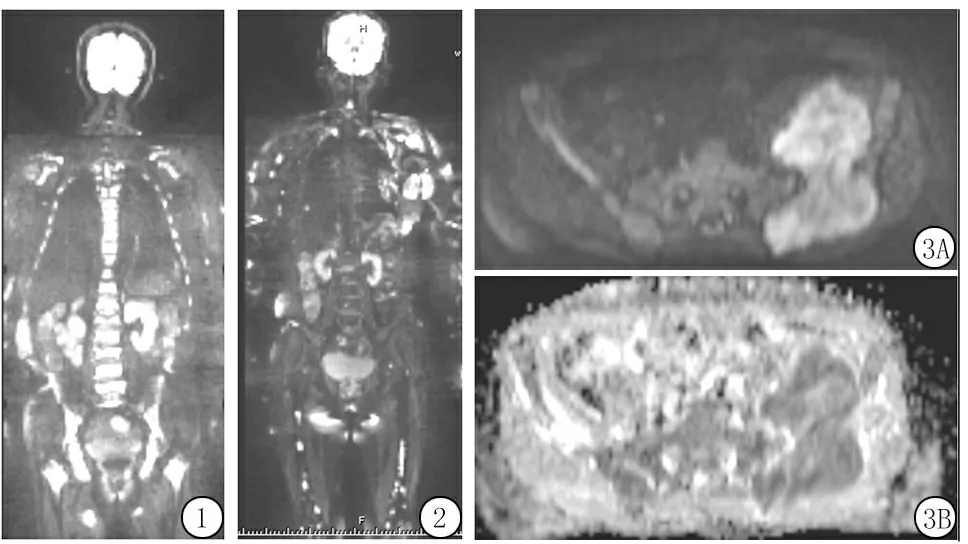
图1 女性,58岁,弥漫性骨髓瘤(b=800 s/mm2)
2.2首诊骨髓瘤患者 ADC值分布及与健康志愿者的差异 患者首诊时,颈椎ADC值平均(0.77±0.18)×10-3mm2/s,胸骨ADC值平均(0.88±0.14)×10-3mm2/s,肋骨ADC值平均(0.89±0.17)×10-3mm2/s,骶骨ADC值平均(0.74±0.20)×10-3mm2/s,所有部位ADC值平均(0.77±0.21)×10-3mm2/s。骨髓瘤患者与健康志愿者胸椎、肩胛骨、肱骨、腰椎、髂骨及股骨的ADC值差异有统计学意义(P<0.05),见表1。
表1 骨髓瘤患者与健康志愿者不同部位ADC值的比较Table 1 Comparison of ADC values in different sites between myeloma patients and healthy volunteers
2.3首诊骨髓瘤患者ADC值与各指标的相关性 首诊时中位骨髓瘤细胞百分比29.5%(5%~87.5%),有3例患者第1次骨髓穿取材失败,后在WB-DWI的指引下再次穿刺成功。骨髓瘤患者髂骨ADC值与骨髓瘤细胞百分比呈正相关(rs=0.560,P=0.008)。首诊时骨髓瘤患者临床化验指标与全身各部位ADC均值相关分析见表2,ADC均值与血红蛋白呈负相关;ADC均值与血β2-MG、尿β2-MG、C反应蛋白呈正相关;ADC均值与肌酐、血钙相关系数分别为0.324、-0.328,但差异无统计学意义;ADC均值与红细胞沉降率、白蛋白、低密度脂蛋白无明显统计学相关性。
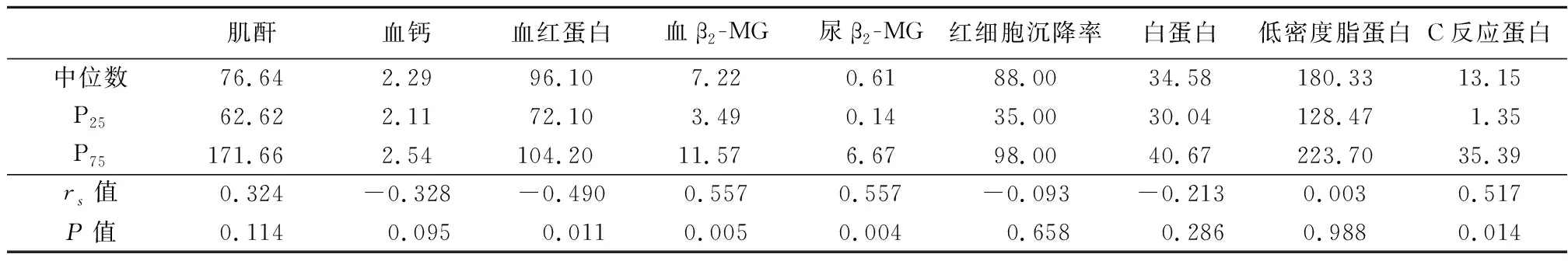
表2 临床化验指标分布及其与全身各部位ADC均值的相关分析Table 2 Distribution of clinical laboratory indexes and their correlation with ADC mean values of the whole body
3 讨 论
3.1骨髓瘤WB-DWI上的影像表现及相应ADC值 多发性骨髓瘤病灶主要累及脊柱、骨盆、颅骨、肋骨、胸骨、肩胛骨及四肢骨近段,在骨骼内呈弥漫性或局灶性骨髓浸润改变,亦可累及骨髓外的结构[10-14]。骨髓瘤病灶在MR T1WI上呈等或低于椎间盘或肌信号,T2WI压脂序列为高信号,DWI上表现为扩散受限,呈高信号,ADC图上为低信号[15]。董立山等[16]研究显示WB-DWI比常规T2WI更易发现病变,敏感度更高。WB-DWI无创、无辐射、不需造影剂,可在较短时间内通过一次扫描完成全身成像,敏感度、特异度高,可重复性强,能同时检出髓内、髓外病变,并准确定位,且能定量测量独立病变及全身骨骼对治疗的反应[17-19]。
研究显示,多发性骨髓瘤患者骨髓病变的ADC值与正常成年人的骨髓明显不同且重叠较少, ADC值区分骨髓瘤和正常骨髓的敏感度和特异度分别为90%和93%[20]。通常正常骨髓ADC值低于(0.60~0.70)×10-3mm2/s,而有活性的肿瘤的ADC值在(0.70~1.40)×10-3mm2/s,ADC值≥1.40×10-3mm2/s的通常见于治疗后病变或有坏死的病变[8]。文献中各家报道所示骨髓瘤的ADC值范围不同[21-24]。骨髓瘤病灶处骨髓内混有骨髓瘤细胞、脂肪细胞和骨髓细胞,骨髓瘤骨髓浸润的程度不同,各组成分比例不同,故其ADC值也不同。ADC值还与使用的DWI序列、选取的b值、T2穿透效应、患者生理运动伪影及植入物、所使用的机器、线圈、参数等有关[25],因此各家的设备、序列、参数等不同,所测ADC值可能不同。本研究显示首诊患者治疗前骨髓瘤的ADC均值为(0.80± 0.21)×10-3mm2/s,且不同部位骨髓瘤病灶的ADC值不同。本研究与我院先前的“全身MR扩散加权成像测量骨髓的正常值”研究[10]采用同一设备,DWI序列相同,参数相同,所测ADC值相对具有可比性。本研究显示骨髓瘤病灶各部位ADC值与相同部位正常骨髓ADC值[10]的差异均有统计学意义。由此可见,使用DWI结合ADC值能够清晰区分正常与骨髓瘤病变的骨髓。
值得注意的是,DWI上正常骨骼一般呈低至中等信号,少部分呈高信号,且DWI信号越高,ADC值越高[10,26]。此外,骨髓水肿、骨关节炎、感染、梗死、血管瘤、软骨瘤、囊肿、局部的红骨髓、金属伪影等都可能引起DWI上的高信号。骨髓瘤治疗好转后局部液化坏死,因T2穿透效应也可表现为DWI上的高信号[8]。此时分析DWI上高信号要结合其他MRI解剖成像序列如T1WI、T2WI像及ADC值,另外结合临床化验指标和骨髓穿刺结果共同分析。骨髓刺激性药物如粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)常用于骨髓瘤化疗后并发症(如中性粒细胞减少)的治疗,其应用会导致 WB-DWI 图像上骨髓信号强度增加,造成骨髓瘤弥漫性骨髓浸润的假象,这可能与G-CSF 引起良性红骨髓转换、骨髓细胞结构改变及水分增加有关[16],因此评估骨髓DWI信号时要注意患者是否应用此类因子。本研究扫描时患者均未使用此类药物。
3.2骨髓瘤ADC值与临床实验室指标关系 骨髓瘤细胞(反应浆细胞增殖程度)并非在骨髓中均匀分布,骨髓浆细胞数由于穿刺部位不同可能不同,也可能因样本稀释等因素而出现漏诊或误诊[27]。本研究有3例患者最初穿刺未见骨髓瘤细胞,后在WB-DWI的指引下获得阳性穿刺结果。另外骨髓瘤患者常常因骨髓瘤肾病引起肾功能受损,导致β2-MG(反应肿瘤负荷)升高,而不分泌型骨髓瘤患者β2-MG会缺失。因此实验室指标有时并不能真正显示疾病的真实状态。本组研究显示骨髓瘤患者ADC值与骨髓瘤细胞百分比、血β2-MG、尿β2-MG、C反应蛋白呈正相关,与血红蛋白呈负相关;与肌酐、血钙也有一定相关性。而这些化验指标与患者病变的严重程度及预后相关。因此WB-DWI结合ADC值对骨髓瘤的诊断、分级及预后均有重要作用。此外实验室指标只能显示患者的一个整体状态,不能独立显示各病变的状态,对于一个治疗后缓解的病例,其不同病灶的恢复程度是不同的,甚至存在高度活性的局限性病灶的可能[28]。而WB-DWI通过一次扫描,就可以独立监测全身各部位的病变,对骨髓瘤患者疾病概况有一个全面的了解,不受髓内、外病变,是否分泌型及少分泌型骨髓瘤的限制[29-30]。
本研究在国内首次分析多发性骨髓瘤患者病灶ADC值与其临床化验指标的相关性,为WB-DWI用于骨髓瘤患者的临床诊断及病情评估提供有力的佐证。另外,本研究将全身病变分成几大部位,并测量各部位骨髓瘤病变的ADC值,为后期学者研究骨髓瘤提供数据参考。同时将各部位骨髓瘤病变的ADC值与前期研究的正常骨髓各部位ADC值进行对比分析,结果更具有可比性。本研究也存在一些不足:①样本量相对较少,以后可扩大各组样本量进一步研究;②颅骨病灶因DWI上高信号脑组织易遗漏,需要结合横轴面图像仔细观察;③四肢远端因FOV限制难以显示。
综上所述,WB-DWI用于多发骨髓瘤的诊断、骨髓浸润程度的评估、患者预后及对患者各部位病变的监测大有裨益,应当将其作为初诊骨髓瘤患者的常规影像检查方法。
