结合局部一致性和低频振幅探究躯体症状障碍患者大脑自发性活动的改变
2022-03-15崔阳阳梁怀彬高婷婷刘建仁杜小霞
崔阳阳,梁怀彬,朱 千,汤 伟,高婷婷,刘建仁,杜小霞
结合局部一致性和低频振幅探究躯体症状障碍患者大脑自发性活动的改变
崔阳阳1,3,梁怀彬2,朱 千3,汤 伟3,高婷婷3,刘建仁2#,杜小霞1*
1.上海体育学院 心理学院,上海 200438;2.上海交通大学医学院附属第九人民医院 神经内科,上海 200011;3.华东师范大学 物理与电子科学学院 物理系,上海市磁共振重点实验室,上海 200062
躯体症状障碍(somatic symptom disorder,SSD)是一种常见的医学疾病,致病原因涉及生物学、心理学及社会因素.目前关于SSD的神经机制知之甚少.本研究通过静息态功能磁共振成像(functional magnetic resonance imaging,fMRI),结合低频振幅(amplitudes of low-frequency fluctuation,ALFF)和局部一致性(regional homogeneity,ReHo)分析探究45位SSD患者和43位健康对照自发性脑活动特征的区别.结果发现:与对照组相比,SSD患者右侧扣带回中部的ReHo值显著升高,而右侧楔前叶、左侧颞下回延伸到左侧颞中回和左侧海马旁回、右侧脑桥的ReHo值显著降低.同时,SSD患者扣带回中部延伸至左侧额中回、右侧脑岛延伸至右侧额下回、左侧额中回延伸至左侧前扣带回的ALFF值均显著升高.这些脑区的脑功能与自我加工、情绪处理、身体知觉等有关,与SSD发病机制有重要联系.
躯体症状障碍(SSD);局部一致性;低频振幅(ALFF);功能磁共振成像(fMRI)
引 言
躯体症状障碍(somatic symptom disorder,SSD)是一种异质性的精神综合征,其特征是患者主诉有反复出现的身体症状,但医学检测却呈现阴性,这种疾病通常与心理因素相关[1].SSD在2013年《精神障碍诊断和统计手册》第五版(Diagnostic and Statistical Manual of Mental Disorders,Fifth Edition,DSM-5)中被提出.要达到SSD诊断标准,必须具备以下条件.首先是一种或多种躯体症状,使人痛苦和/或导致日常生活严重中断.其次是与下列躯体症状或相关健康问题有关的一种或多种过度的想法、感觉和/或行为:(i)对症状严重性的过度和持续的想法;(ii)对健康或症状的持续高度焦虑;(iii)花在这些症状或健康问题上的时间和精力过多.并且一种或多种症状持续存在,且持续6个月以上[2].SSD给患者带来了巨大的心理和经济压力[1],是比较常见的神经内科疾病.欧洲一项流行病研究显示,在来自6个不同国家的65~84岁人群中,每年各种躯体形式障碍总患病率为3.8%[3].有综述文献报道严格诊断的SSD的患病率是0.8%~5.9%,其中初诊时至少存在一种躯体形式障碍的患者比例是26.2%~34.8%,至少有一种医学上无法解释的症状的患者比例为40.2%~49%[4].目前,国际上已经证实的SSD治疗方法包括认知行为疗法、正念疗法和药物疗法[5].
服用5-羟色胺再摄取抑制剂,或使用三环类抗抑郁药在缓解症状方面是有效的[5].国内尚无特效的SSD治疗方法,已有的治疗方法包括心理干预、西药治疗、中医治疗和联合治疗等[6].
虽然SSD的生物学性质已被广泛接受,并且许多潜在的致病因素已被提出,如儿童期忽视、性虐待、混乱的生活方式、酗酒、药物滥用史、社会心理压力,以及人格障碍,特别是回避、偏执、自我挫败和强迫症[7].然而这些研究大多基于社会调查和行为研究,SSD相关的神经机制仍然没有定论.
神经影像学(如脑功能成像)有助于深入探测SSD患者深层次的脑功能障碍.例如基于血氧水平依赖(blood-oxygen-level-dependent,BOLD)对比的功能磁共振成像(functional magnetic resonance imaging,fMRI)在疾病相关研究中得到了广泛应用[8,9].低频振幅(amplitudes of low-frequency fluctuation,ALFF)和局部一致性(regional homogeneity,ReHo)是分析静息态fMRI数据的常用方法,可用于研究大脑局部的自发性神经活动[10].ALFF信号强度的变化被认为与局部神经元的活动有关,ALFF分析能有效检测低频自发振荡的涨落.ReHo通过计算大脑中每个体素与其相邻体素的时间序列的肯德尔和谐系数(Kendall’s coefficient concordance,KCC),即ReHo值,从而评估不同体素间时间序列的相似性,并衡量各体素在时间序列上的相似性和同步性[11].
本研究采用了相对较大的样本量,利用ReHo和ALFF探究了SSD患者静息状态下自发脑功能活动特征.
1 实验部分
本次研究得到了上海交通大学医学院附属第九人民医院独立伦理委员会和华东师范大学人类研究委员会的批准(批准文号为:HR062-2018),受试者均已签署知情同意书.
1.1 实验对象
我们从上海交通大学医学院附属第九人民医院神经内科招募了45名SSD患者(20名男性、25名女性),这些患者由神经科医生根据DSM-5诊断标准,经过临床访谈诊断为SSD[1],并排除了如下状况的病人:(1)患有其他主要精神疾病的患者,包括抑郁症、焦虑症、药物滥用或药物依赖;(2)患有痴呆症或者中风等主要神经系统疾病;(3)通过结构磁共振扫描检测到任何白质变化的患者,例如梗塞或者其它血管病变.在诊断过程中,神经科医生也获得了SSD患者的人口统计和临床数据,包括性别、年龄、病程,同时患者填写健康问卷(patient health questionnaire,PHQ-9)[12]、广泛性焦虑量表(generalized anxiety disorder,GAD-7)[13]、汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)[14]、汉密尔顿抑郁量表(Hamilton depression scale,HAMD)[15]和简易精神状态测试(mini-mental state examination,MMSE)[16].在45名SSD患者中:有18位主诉头痛(有或没有头晕);有8位主诉头晕;有5位主诉周围疼痛;还有14位主诉其他身体不适,例如局部麻木.有一半的患者是未使用过药物的患者,服药的患者在磁共振扫描当天停止用药12 h以上.另外,我们一共招募了43位健康对照(男性19名,女性24名).所有被试者都是右利手,并根据临床检查和结构化访谈排除了所有的神经系统和精神疾病.
1.2 数据采集
静息态结构像和静息态功能像的MRI数据采集在华东师范大学上海磁共振重点实验室完成,使用西门子Prisma 3.0T磁共振系统和64通道头/颈线圈.
高分辨结构像采用1加权3D磁化准备的快速梯度回波(magnetization-prepared rapid-acquisition gradient-echo,MPRAGE)序列来获取全脑解剖图像,参数如下:矢状位,视野=256 mm×256 mm,矩阵大小=256×256,回波时间(echo time,TE)=2.34 ms,重复时间(repetition time,TR)=2 530 ms,反转时间=1 100 ms,翻转角=7˚,层数=192,层厚=1 mm,层间距=50%.静息态功能磁共振图像采用2*加权梯度回波平面成像(echo-planar imaging,EPI)序列,参数如下:横断位,视野=220 mm×220 mm,矩阵大小=64×64,TR为2 000 ms,TE为30 ms,反转角为90˚,33层覆盖全脑,层厚为3.5 mm,层间距为25%,扫描帧数为210.
1.3 静息态fMRI数据预处理
我们使用SPM12(http://www.fil.ion.ucl.ac.uk/spm/software/spm12)和MATLAB(The Math Works,Natick,MA)来分析静息态fMRI数据.为了排除扫描开始时段MRI仪器的不稳定和被试的不适,我们将每个被试的前十个时间点数据剔除.接着进行不同片层间的时间层矫正,剩余的200帧数据通过六参数的刚体变换来进行头动矫正.然后,我们使用前后联合作为高分辨1加权图像上的原点,将所有被试的功能像与结构像配准.再将图像分割成白质、灰质和脑脊液.然后将图像标准化到蒙特利尔(Montreal neurological institute,MNI)空间,并以3 mm×3 mm×3 mm的大小重新采样.然后使用一般线性模型对时间序列、白质、年龄、性别、6个头动参数以及脑脊液信号进行回归.如果受试者在任何方向上的最大平移>2 mm或旋转>2˚,将被排除在外.双样本检验发现SSD患者和对照组的6个头动参数无显著差异.
1.4 数据分析
1.4.1 ReHo分析
我们使用DPABI(Data Processing & Analysis of Brain Imaging)2.0版本进行ReHo分析[17].首先使用频率范围为0.01~0.1 Hz的带通滤波器对数据进行滤波,从而去除低频和高频生理信号.接着通过计算被试者每个体素的时间序列和它周围26个体素的时间序列的KCC,生成个体在MNI标准空间的ReHo图[10].为了去除被试的个体差异,将所得的ReHo值进行标准化处理,即将被试每个体素的ReHo值与全脑的均值之差和全脑ReHo的标准偏差值相比,得到比值zReHo.为了减小处理过程中带来的误差,我们需要对静息态指标zReHo进行空间平滑处理,平滑核选择6 mm×6 mm×6 mm,从而得到被试全脑平滑后的zReHo图.
1.4.2 ALFF分析
利用DPABI 2.0软件,我们将已经预处理的fMRI数据继续进行ALFF分析.首先选用6 mm× 6 mm×6 mm的平滑核对预处理过的数据进行空间平滑,接下来计算ALFF值,即将体素的时间序列经过快速傅里叶变换得到频域的能量谱,设置频率范围0.01 Hz << 0.1 Hz,计算对应的振幅之和从而得到ALFF.最后将得到的ALFF值进行标准化处理,得到zALFF.
1.5 统计分析
利用SPM12软件,分别逐体素对SSD组和健康对照组的zReHo和zALFF进行双样本检验,并将年龄、性别作为协变量.体素水平<0.001,团块水平经过总体错误率(family-wise errors,FWE)矫正后<0.05,则认为该体素在SSD患者组与健康对照组间具有显著性差异.
2 结果与讨论
2.1 人口统计学和临床资料
SSD患者组和健康对照组的人口学和临床资料见表1.经独立样本检验得到的值分别为0.88和0.97,表明年龄和性别在SSD患者组和对照组之间没有显著差异.

表1 受试者人口统计学与临床资料
PHQ:Patient Health Questionnaire(患者健康问卷);GAD:Generalized Anxiety Disorder(广泛性焦虑量表);HAMA:Hamilton Anxiety Scale(汉密尔顿焦虑量表);HAMD:Hamilton Depression Scale(汉密尔顿抑郁量表);MMSE:Mini-mental State Examination(简易精神状态测试).健康对照组的临床数据来源于面谈和快速量表排除.
2.2 ReHo和ALFF分析
SSD患者在右侧扣带回中部(middle cingulate gyrus,MCG)的ReHo值相比健康对照显著升高,而在右侧楔前叶、左侧颞下回(延伸至左侧颞中回和左侧海马旁回)和右侧脑桥的ReHo值相比健康组显著降低(图1、表2).同时,SSD患者在MCG延伸至左侧额中回、右侧脑岛延伸至右侧额下回、左侧额中回延伸到左侧前扣带回(anterior cingulate cortex,ACC)的ALFF值相比健康组显著升高(图2,表3).
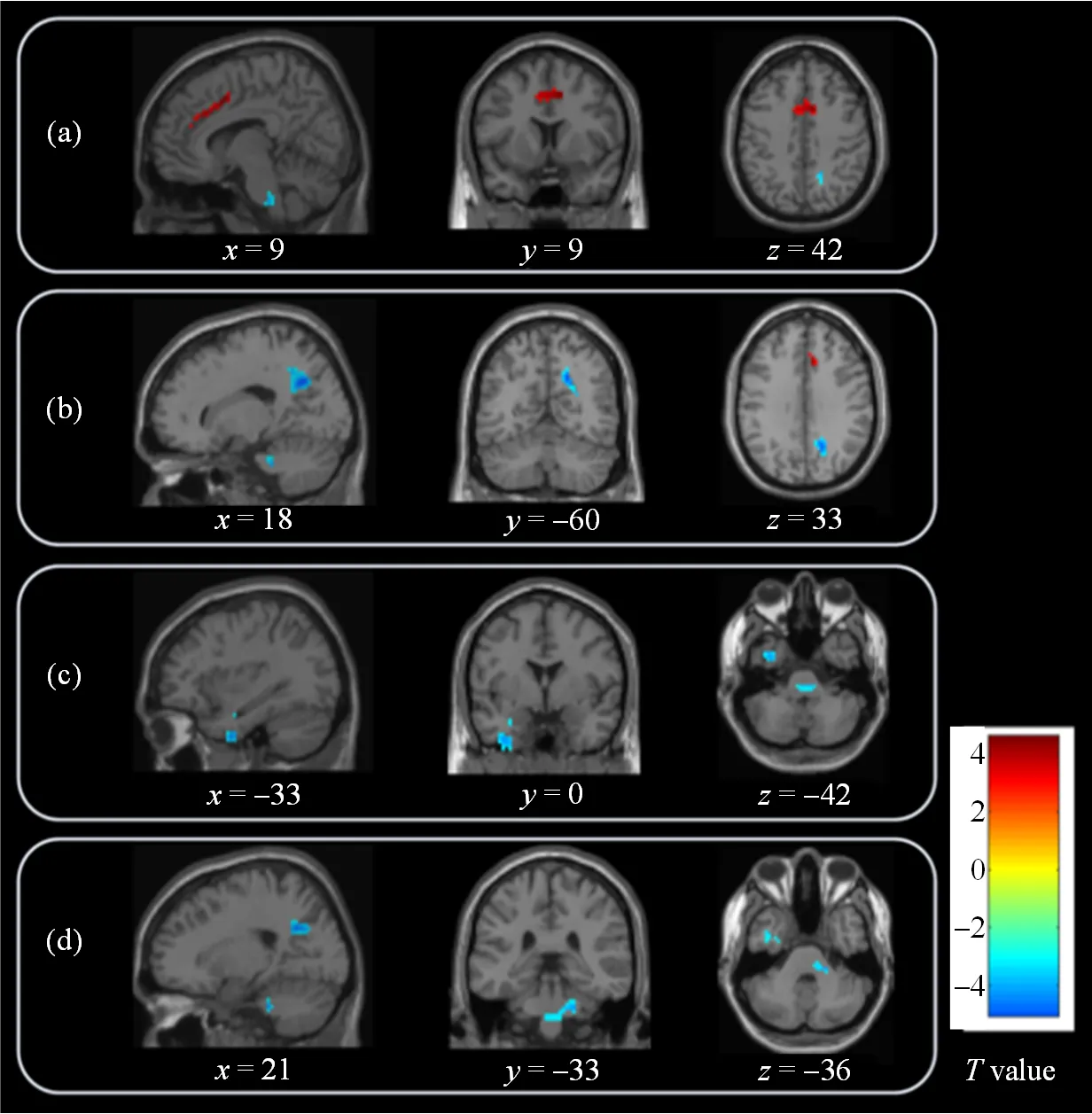
图1 基于ReHo分析,SSD患者与健康对照组间有显著差异的脑区.与健康对照相比,SSD患者在右侧扣带回中部[(a)图中红色标注]的ReHo值升高,在右侧楔前叶[(b)图中蓝色标注]、左侧颞下回延伸至左侧颞中回和左侧海马旁回[(c)图中蓝色标注]、右侧脑桥[(d)图中蓝色标注]的ReHo值降低

表2 两组间ReHo值显著变化的脑区
a:若体素水平<0.001,团块水平经过FWE(family-wise errors)矫正后<0.05,则认为该体素在SSD患者组与健康对照组间具有显著性差异
在这些异常的区域中,通过皮尔逊相关性分析,发现ReHo值和ALFF值与患者的临床指标(PHQ、GAD、HAMA、HAMD和MMSE评分)之间无显著相关性.
2.3 讨论
本研究基于ReHo和ALFF来探究SSD患者的自发性大脑活动异常.与健康对照组相比,SSD患者在MCG、ACC、额中回、额下回、脑岛、楔前叶、颞下回、颞中回、海马旁回和脑桥处均显示出异常的ReHo和ALFF值.这些发现与前人的影像学研究相一致[18-20].Meta分析提示前运动皮层和辅助运动皮层、额中回、前扣带回皮层、脑岛和后扣带回皮层对SSD的发生具有特别重要的意义[21].

图2 基于ALFF分析,SSD患者与健康对照组间有显著差异的脑区.与健康对照相比,SSD患者在扣带回中部延伸至左侧额中回(a)、右侧脑岛延伸至右侧额下回(b)、左侧额中回延伸至左侧前扣带回(c)的ALFF值升高
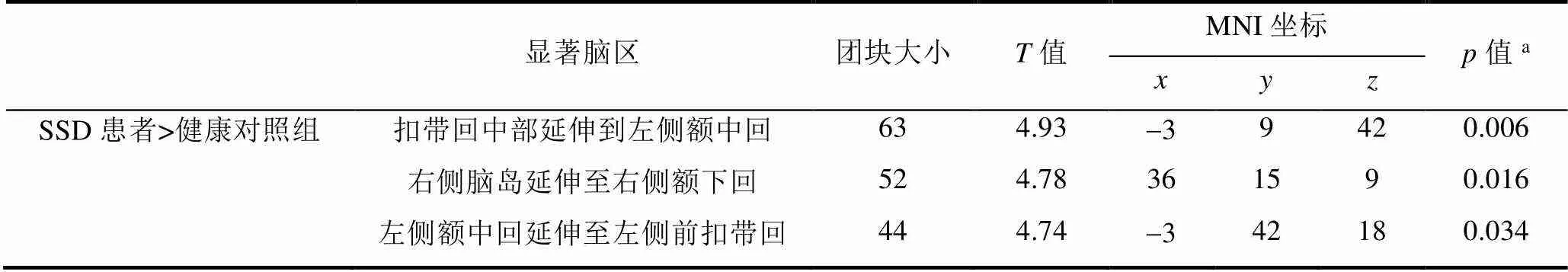
表3 两组间ALFF值显著变化的脑区
a:若体素水平<0.001,团块水平经过FWE(family-wise errors)矫正后<0.05,则认为该体素在SSD患者组与健康对照组间具有显著性差异
目前基于ReHo和ALFF方法研究SSD患者脑区的自发性神经活动的文献非常有限,目前只发现少数研究使用ReHo或者ALFF来探究SSD患者脑区的自发性神经活动,且SSD样本数量较少.Ou等[18]发现,与健康对照组相比,首发未服药的SSD患者左侧额中回和前扣带回的ReHo值增加.Huang等[22]发现,与健康对照组相比,持续性躯体形式疼痛障碍患者双侧初级躯体感觉皮层、枕叶和小脑后叶的ReHo值降低,而默认网络和前额叶皮层的ReHo值升高.此外,Song等[23]研究发现,与健康对照组相比,SSD患者左侧角回的ReHo值增加.Su等[24]报道称,与健康对照组相比,SSD患者双侧前额叶内侧皮质的ALFF值增加,而左侧楔前叶ALFF值降低.前期的研究结果不完全一致,和本研究也只有部分的相似和重叠,究其原因可能是SSD本身是一种复杂的疾病,症状表现形式各不相同,以往研究的样本较小,包含不同亚型或不同比例的亚型,可能导致不同研究结果的差异性.此外在不同阶段,患者的脑功能活动其功能活动可能也不同.本研究利用较大的样本,同时分析了ReHo值和ALFF值的变化,且采用比较严格的统计阈值,增加了结果的可信性度.
在本次研究中,我们发现SSD患者在额叶和额叶下区域的局部表现出自发的脑功能异常,包括MCG、ACC、额中回和脑岛.前人的结构神经影像学研究表明ACC和MCG的异常在功能性神经系统疾病的神经生物学中起着重要作用,其中ACC的功能异常可能与情绪失调和创伤症状有关,MCG的异常可能与运动控制和认知受损有关[19].内侧前额叶皮层和ACC的异常均参与情绪障碍,如焦虑症和抑郁症.前人的综述文献显示在情绪调节任务中,广泛性焦虑患者前额叶和ACC功能不足,并且自上而下的调控功能存在缺陷[25].脑岛参与内感受过程,以及感觉、本能和情感信息的整合,从而促进个体的情感体验,而且脑岛是显著网络(salience network,SN)中一个非常重要的节点.
此外,前脑岛参与身体的感知和疼痛的情绪感知[26].扣带-额叶皮层与自上而下的控制疼痛的传递有关[27].本研究进一步证实SSD患者扣带-额叶皮层和扣带-脑岛确实存在异常,而且这些异常的脑区参与情绪、身体感觉等脑功能.
与对照组相比,SSD患者在右侧楔前叶的ReHo值降低.楔前叶是大脑的最强枢纽之一,是默认网络(default network,DMN)的重要组成部分,在DMN中起着关键作用[28,29].前期的文献表明,楔前叶参与了信息的传递和多模态整合,这可能是处理自发性思维和内在意识的基础[24].文献提示楔前叶的激活可能与自我反思的过程有关[30].楔前叶局部ReHo值的降低表明局部自发性脑活动同步性降低,表明SSD患者楔前叶的自发脑功能活动异常,可能会影响自我相关的加工.
与对照组相比,SSD患者在左侧颞下回(延伸至颞中回和海马旁回)和右侧脑桥的ReHo值降低.前人的研究表明躯体形式障碍的患者在双侧颞叶的代谢降低,并且颞中回代谢率跟患者躯体症状的评分有关[31].本研究发现SSD患者的颞叶存在脑功能异常,然而SSD的颞叶病理学作用依旧不明确,需要进一步证实.脑桥是前脑和后脑之间的重要连接,也参与控制睡眠和运动[29].脑桥包含桥脑和三叉神经和面神经的运动核,参与了触摸和疼痛、面部感觉和表情,以及唾液和眼泪分泌的感觉过程[32],其功能异常也可能直接或间接与身体感觉的不适有关.
需要说明的是本次研究的SSD被试包含不同亚型的SSD患者,因此结果反应的是SSD的一般特性,而非单个亚型的特性.此外,未发现fMRI结果和临床数据的显著相关性.我们推测可能是由SSD病理的复杂性导致的.在将来的SSD研究中,通过增加样本量、分亚型研究以及纵向追踪研究将有助于进一步揭示SSD病理.
3 结论
在静息状态下,SSD患者在MCG、ACC、前额叶皮层、脑岛、楔前叶、颞下回、颞中回、海马旁回和脑桥存在局部功能活动异常.这些异常脑区的脑功能与自我加工、情绪处理、身体知觉等有关,与SSD发病机制有重要的联系.
本研究得到了国家自然科学基金项目(81571658)的资助.
无
[1] JIBSON M D, SEYFRIED L S.Diagnostic and statistical manual of mental disorders (DSM-5®)[M].Fifth Edition.USA: Academic Psychiatry.2013.
[2] HENNINGSEN P.Management of somatic symptom disorder[J].Dialogues Clin Neurosci, 2018, 20(1): 23-31.
[3] DEHOUST M C, SCHULZ H, HARTER M, et al.Prevalence and correlates of somatoform disorders in the elderly: Results of a European study[J].Int J Methods Psychiatr Res, 2017, 26(1): e1550.
[4] HALLER H, CRAMER H, LAUCHE R, et al.Somatoform disorders and medically unexplained symptoms in primary care[J].Dtsch Arztebl Int, 2015, 112(16): 279-287.
[5] KURLANSIK S L, MAFFEI M S.Somatic symptom disorder[J].Am Fam Physician, 2016, 93(1): 49-54.
[6] WANG J F, ZHANG B, BIE H J, et al.Research progress of somatization disorder[J].Clinical Journal of traditional Chinese Medicine, 2013, 25(3): 277-281.
王俊锋, 张波, 别红军, 等.躯体化障碍研究进展[J].中医药临床杂志, 2013, 25(3): 277-281.
[7] D'SOUZA RS, HOOTEN WM.Somatic syndrome disorders[M].Treasure Island (FL): StatPearls Publishing.2021.
[8] CHENG L W, WANG L L, ZHONG K.Application of fMRI in transcranial direct current stimulation researches [J].Chinese J Magn Reson, 2020, 37(4): 533-546.
程力维, 王璐璐, 钟凯.fMRI 在经颅直流电刺激研究中的应用进展[J].波谱学杂志, 2020, 37(4): 533-546.
[9] YANG B L.Future of ultra high field MRI in basic research and clinical applications[J].Chinese J Magn Reson, 2015, 32(4): 707-714.
杨保联.超高场磁共振人体成像应用研究和医学前景[J].波谱学杂志, 2015, 32(4): 707-714.
[10] MARGULIES D S, BOTTGER J, LONG X Y, et al.Resting developments: a review of fMRI post-processing methodologies for spontaneous brain activity[J].MAGMA, 2010, 23(5,6): 289-307.
[11] ZANG Y F, JIANG T Z, LU Y L, et al.Regional homogeneity approach to fMRI data analysis[J].Neuroimage, 2004, 22(1): 394-400.
[12] KROENKE K, SPITZER R L, WILLIAMS J B.The PHQ-9: validity of a brief depression severity measure[J].J Gen Intern Med, 2001, 16(9): 606-613.
[13] SPITZER R L, KROENKE K, WILLIAMS J B, et al.A brief measure for assessing generalized anxiety disorder: the GAD-7[J].Arch Intern Med, 2006, 166(10): 1092-1097.
[14] HAMILTON M.The assessment of anxiety states by rating[J].Br J Med Psychol, 1959, 32(1): 50-55.
[15] HAMILTON M.A rating scale for depression[J].J Neurol Neurosurg Psychiatry, 1960, 23(1): 56-62.
[16] FOLSTEIN M F, FOLSTEIN S E, MCHUGH P R.“Mini-mental state”.A practical method for grading the cognitive state of patients for the clinician[J].J Psychiatr Res, 1975, 12(3): 189-198.
[17] YAN C G, WANG X D, ZUO X N, et al.DPABI: Data processing & analysis for (resting-state) brain imaging[J].Neuroinformatics, 2016, 14(3): 339-351.
[18] OU Y P, LIU F, CHEN J D, et al.Increased coherence-based regional homogeneity in resting-state patients with first-episode, drug-naive somatization disorder[J].J Affect Disord, 2018, 235: 150-154.
[19] OSPINA J P, JALILIANHASANPOUR R, PEREZ D L.The role of the anterior and midcingulate cortex in the neurobiology of functional neurologic disorder[J].Handb Clin Neurol, 2019, 166: 267-279.
[20] WEI S B, SU Q J, JIANG M L, et al.Abnormal default-mode network homogeneity and its correlations with personality in drug-naive somatization disorder at rest[J].J Affect Disord, 2016, 193: 81-88.
[21] BOECKLE M, SCHRIMPF M, LIEGL G, et al.Neural correlates of somatoform disorders from a meta-analytic perspective on neuroimaging studies[J].Neuroimage Clin, 2016, 11: 606-613.
[22] HUANG T M, ZHAO Z Y, YAN C, et al.Altered spontaneous activity in patients with persistent somatoform pain disorder revealed by regional homogeneity[J].PLoS ONE, 2016, 11(3): e0151360.
[23] SONG Y, SU Q J, JIANG M L, et al.Abnormal regional homogeneity and its correlations with personality in first-episode, treatment-naive somatization disorder[J].Int J Psychophysiol, 2015, 97(2): 108-112.
[24] SU Q J, YAO D P, JIANG M L, et al.Dissociation of regional activity in default mode network in medication-naive, first-episode somatization disorder[J].PLoS ONE, 2014, 9(7): e99273.
[25] MOCHCOVITCH M D,DA ROCHA FREIRE R C, GARCIA R F, et al.A systematic review of fMRI studies in generalized anxiety disorder: Evaluating its neural and cognitive basis[J].J Affect Disord, 2014, 167: 336-342.
[26] CRAIG A D B.How do you feel—now? The anterior insula and human awareness[J].Nat Rev Neurosci, 2009, 10(1): 59-70.
[27] VALET M, SPRENGER T, BOECKER H, et al.Distraction modulates connectivity of the cingulo-frontal cortex and the midbrain during pain--an fMRI analysis[J].Pain, 2004, 109(3): 399-408.
[28] FRANSSON P, MARRELEC G.The precuneus/posterior cingulate cortex plays a pivotal role in the default mode network: Evidence from a partial correlation network analysis[J].Neuroimage, 2008, 42(3): 1178-1184.
[29] TOMASI D, VOLKOW N D.Association between functional connectivity hubs and brain networks[J].Cereb Cortex, 2011, 21(9): 2003-2013.
[30] CAVANNA, ANDREA E.The precuneus and consciousness[J].Cns Spectr, 2007, 12(07): 545-552.
[31] HUANG Q, REN S H, JIANG D L, et al.Changes in brain glucose metabolism and connectivity in somatoform disorders: an18F-FDG PET study[J].Eur Arch Psychiatry Clin Neurosci, 2020, 270(7):881-891..
[32] VILA-PUEYO M, HOFFMANN J, ROMERO-REYES M, et al.Brain structure and function related to headache: Brainstem structure and function in headache[J].Cephalalgia, 2018, 39(1): 033310241878469.
A Study on the Alteration of Spontaneous Brain Activity in Somatic Symptoms Disorder Combining Regional Homogeneity and Amplitude of Low-frequency Fluctuation
1,3,2,3,3,3,2#,1*
1.Department of Psychology, Shanghai University of Sport, Shanghai 200438, China; 2.Department of Neurology, Shanghai Ninth People’s Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200011, China; 3.Shanghai Key Laboratory of Magnetic Resonance, Department of Physics, School of Physics and Electronic Science, East China Normal University, Shanghai 200062, China
Somatic symptom disorder (SSD) is a common medical disorder characterized by various biological, psychological, and social pathogenic factors.At present, little is known about the neural mechanism of SSD.This study evaluated the dysfunction in 45 patients with SSD and 43 controls by combining the amplitudes of low-frequency fluctuation (ALFF) and regional homogeneity (ReHo) methods with resting-state functional magnetic resonance imaging (fMRI).The patients with SSD exhibited significantly greater ReHo values in the right middle cingulate gyrus, and smaller ReHo values in the right precuneus, the left inferior temporal gyrus extending to the left middle temporal gyrus and the left parahippocampal gyrus, and the right pons compared with the controls.The SSD patients showed higher ALFF values in the middle cingulate gyrus extending to the left middle frontal gyrus, the right insula extending to the right inferior frontal gyrus, and left middle frontal gyrus extending to the left anterior cingulate cortex.These dysfunction areas are involved in self-relevant processes, emotional processing, and body perception, which are closely related to the pathogenesis of SSD.
somatic symptom disorder (SSD), regional homogeneity, amplitudes of low-frequency fluctuation (ALFF), functional magnetic resonance imaging (fMRI)
O482.53
A
10.11938/cjmr20212894
2021-03-01;
2021-06-02
国家自然科学基金资助项目(81571658).
* Tel: 13764809136, E-mail: duxiaoxia@sus.edu.cn;
# Tel: 18616341023, E-mail: liujr021@vip.163.com.
