中国肝癌肝移植临床实践指南(2021 版)
2022-03-13中国医师协会器官移植医师分会中华医学会器官移植学分会肝移植学组
中国医师协会器官移植医师分会,中华医学会器官移植学分会肝移植学组
肝细胞癌(以下简称肝癌)是最常见的原发性肝脏恶性肿瘤,据统计中国每年超过30 万人死于肝癌。肝移植是全世界公认的治疗终末期肝病最有效的手段之一。我国自20 世纪90 年代起肝移植事业发展迅猛,在移植数量和质量方面已达到西方发达国家水平。中国由于乙肝的流行,故而肝癌肝移植占比远高于西方。为指导全国肝癌肝移植工作更规范、有效、安全地开展,中国医师协会器官移植医师分会和中华医学会器官移植学分会肝移植学组等行业学会组织专家于2014 年制定《肝癌肝移植临床实践指南》,重点阐述肝移植受者选择标准、术前降期治疗、抗病毒治疗、免疫抑制剂应用和术后复发防治五部分内容,并于2018 年进行了更新。现组织专家对指南进行再次更新,以适应我国肝癌肝移植发展面临的新形势和新挑战。
1 前 言
肝癌约占所有肝癌类型的75%~85%,是最常见的原发性肝脏恶性肿瘤,同时也是中国60 岁以下成年男性病死率最高的恶性肿瘤[1]。据统计中国每年超过30 万人死于肝癌,占全球肝癌死亡人数的一半左右。肝移植是全世界公认的治疗终末期肝病最有效的手段之一。我国自20 世纪90 年代掀起第二次肝移植热潮以来,特别是2015 年全面开展公民逝世后器官捐献后,肝移植事业发展迅猛,呈专业化和规模化发展态势,在移植数量和质量方面已达到西方发达国家水平。中国肝移植注册中心(China Liver Transplant Registry,CLTR)数据显示,2018 — 2020 年国内肝移植年平均约6 000 例,其中肝癌肝移植占比为35.0%。为指导全国肝移植工作更规范、有效、安全地开展,中国医师协会器官移植医师分会和中华医学会器官移植学分会等行业学会组织专家于2014 年制定《肝癌肝移植临床实践指南》,重点阐述肝移植受者选择标准、术前降期治疗、抗病毒治疗、免疫抑制剂应用和术后复发防治五部分内容,并于2018 年进行了更新。为适应我国肝癌肝移植发展面临的新形势,现再次对指南进行更新。本指南采用的循证医学证据分级主要参考2001 牛津证据分级(表1),推荐意见强度主要参考GRADE 系统推荐分级[2]。

表1 循证医学证据分级
2 肝癌肝移植受者选择标准(表2)

表2 肝癌肝移植受者选择标准
在全球范围内,供肝短缺问题仍然严重。在我国,近年来随着公民逝世后器官捐献的不断发展,供肝短缺问题有所缓解,但供肝数量仍远不能满足患者需求。制定科学的肝癌肝移植受者选择标准,是提高疗效、合理利用宝贵供肝资源的关键。1996 年, Mazzaferro 等[3]率先提出选择合并肝硬化的小肝癌患者进行肝移植,建立了米兰标准。该标准要求单一癌灶直径不大于5 cm 或多发癌灶数目不多于3 个,且最大直径不大于3 cm,此外肿瘤无肝内大血管侵犯及远处转移。符合米兰标准的肝癌肝移植受者获得了长期存活[3-5]。但米兰标准对肝癌大小和数目的限制过于严格,如果根据米兰标准,很多肝癌患者将失去肝移植机会。基于此,国际上出现了一些新的肝癌肝移植受者选择标准,如加州大学旧金山分校(University of California,San Francisco,UCSF)标准、Up-to-Seven 标准等。这些标准经临床验证,不仅扩大了受者人群,并取得与米兰标准相似的移植生存率[4-5]。但上述标准仅关注肿瘤大小、数目,而忽略了肿瘤的生物学特性。
2008 年,中国提出的杭州标准首次引入肿瘤生物学特性和病理学特征作为肝癌肝移植受者选择标准,这是对以往标准局限于肿瘤形态学的突破。多项临床研究证实,符合杭州标准的肝癌受者均获得满意的术后生存率[6-10]。根据全国多中心临床研究结果[11],杭州标准可进一步分为两类:A 类为肿瘤直径≤8 cm 或肿瘤直径>8 cm,但甲胎蛋白(alpha fetal protein,AFP)≤100 ng/ml;B 类为肿瘤直径>8 cm,但AFP 为100 ~400 ng/ml;符合杭州标准A 类的受者预后更好。对于肝癌切除术后复发者,如符合肝癌肝移植准入标准,可行挽救性肝移植[12-13]。
除公民逝世后器官捐献以外,活体供者也是肝癌肝移植供肝来源的有力补充,活体肝移植在经验丰富的移植中心已成为一项成熟技术,可以缩短移植等待时间。亲属捐献部分肝脏的活体肝移植不占用社会供肝资源,在充分考虑受者获益及供者风险的基础上,受者选择标准可适当放宽。亚洲部分移植中心选择无大血管侵犯及肝外转移的肝癌受者实施活体肝移植,取得了良好的效果[14-16]。对于符合肝癌肝移植选择标准的受者,实施活体肝移植后如出现移植物失功,可行二次肝移植。对于超越肝癌肝移植选择标准的受者,实施活体肝移植后如出现肝癌复发导致的移植物失功,不建议再行尸体肝移植[17-18]。
3 肝癌肝移植术前降期治疗(表3)

表3 肝癌肝移植术前降期治疗
肝癌肝移植术前降期治疗目的是减轻肿瘤负荷,降低分期,使超出肝癌肝移植选择标准的患者能够获得肝移植机会。降期治疗主要适用于不符合现有肝癌肝移植选择标准,且无门静脉主干或下腔静脉等大血管侵犯、无远处转移的肝癌患者[17,19-21]。有效的降期治疗方法主要包括经导管动脉化疗栓塞(transcatheter hepatic arterial chemoembolization,TACE)[17,22-23]、钇-90 微球肝动脉放射栓塞(transarterial radioembolization,TARE)[22,24]和局部消融治疗等。TARE 的降期效果令人满意,在减少住院时间及并发症方面相比TACE 更具优势[19,22,24]。局部消融治疗包括射频消融、微波消融、冷冻消融和经皮无水乙醇注射等方法。
近年来兴起的免疫治疗药物和分子靶向药物为降期治疗提供了新的选择。以免疫检查点抑制剂如程序性死亡受体-1(programmed death 1,PD-1)/程序性死亡配体-1(programmed death ligand 1,PD-L1)抗体等为代表的免疫治疗药物在肝癌降期治疗领域的研究日趋增多,但多为个案报道或小样本临床研究。PD-1 抗体联合TACE 和/或分子靶向药物等降期治疗新方案仍需多中心、大样本临床验证。关于免疫治疗与肝移植手术的安全时间间隔目前尚无定论。有个案报道经免疫检查点抑制剂成功降期后停药8 d 行肝移植,受者出现排斥反应[25]。但多数研究结果显示,停药至少4 周后行肝移植的病例术后未发生排斥反应或其他严重并发症[26-27]。这些研究提示经免疫检查点抑制剂降期治疗至符合移植标准后进行肝移植具有一定可行性,但须认识到其可能增加术后发生排斥反应的风险,应加强监测,必要时加强抗排斥反应治疗。越来越多的临床数据表明,索拉非尼、仑伐替尼等分子靶向药物是有效的降期治疗药物,可延长受者的无瘤生存期[28-30]。目前认为,联合运用多种治疗方法可以达到更好的降期疗效。
降期治疗的疗效一般采用对比增强CT 和MRI,并结合AFP 和异常凝血酶原等肿瘤标志物进行综合评估,评价指标包括肿瘤大小、数目、AFP和异常凝血酶原水平变化等[31-34]。国际肝移植及肝癌临床指南中均建议,对于预估等待期长于6 个月的肝癌患者应及时接受抗肿瘤的降期或桥接治疗[35-36]。关于降期治疗的终点,一项多中心临床研究显示,以杭州标准为降期治疗终点,降期成功率可达39.5%,降期成功者肝移植术后可获得与初始符合标准者相似的预后[37]。
4 肝癌肝移植受者抗肝炎病毒治疗(表4)

表4 肝癌肝移植受者抗肝炎病毒治疗
中国肝癌肝移植受者90%以上与乙型肝炎病毒(hepatitis B virus,HBV)感染相关。肝移植前HBV 载量高以及肝移植后乙型肝炎(以下简称乙肝)复发的受者,肝癌复发的风险增加,因此对乙肝肝移植受者尽早行抗病毒治疗,尽快降低HBV DNA 水平,有助于降低移植术后乙肝复发率,提高受者长期生存率[38-40]。HBV 载量高的移植等待期肝癌患者应采用恩替卡韦、替诺福韦等强效、高耐药屏障核苷(酸)类似物(nucleos(t)ide analogues,NAs)。移植术中无肝期应给予乙型肝炎免疫球蛋白(hepatitis B immunoglobulin,HBIG)。移植后的主要抗病毒治疗方案为NAs 联合低剂量HBIG,其中恩替卡韦/替诺福韦联合低剂量HBIG是预防移植术后乙肝复发的一线方案,预防乙肝复发效果可靠[41-46]。近年来,随着高耐药屏障NAs的不断面世及应用,肝移植术后HBIG 的使用剂量及时间有降低趋势[47-49]。最近的研究表明,在低HBV 复发风险个体中,HBIG 只需在围术期使用[47]。中国香港大学的一项研究发现,对于接受恩替卡韦单药治疗的无拉米夫定耐药慢性乙肝肝移植受者,移植后8 年HBsAg 阴性率为92%,HBV DNA 阴性率为100%[50]。该方案在不降低疗效的同时更加经济、便利,可作为NAs 联合低剂量HBIG 方案的有效补充。还有研究表明,应用无糖皮质激素免疫抑制方案可降低移植术后乙肝复发率[51]。此外也有移植术后接种乙肝疫苗预防乙肝复发的报道,其临床应用尚有争议[52-55]。目前,肝移植术后主张长期应用NAs,完全停用NAs 尚不推荐。需要注意的是,为提高抗病毒药物的疗效,建议恩替卡韦空腹服用,富马酸丙酚替诺福韦与含脂食物同服。
根据CLTR 统计数据,近年来我国成人肝移植中HBcAb 阳性供肝比例已超过20%。因此,非乙肝相关肝移植受者亦可能接受HBcAb 阳性供肝,导致移植术后新发乙肝甚至肝癌。对于这部分受者,移植等待期及时接种乙肝疫苗联合术后NAs,是减少后续接受HBcAb阳性供肝导致HBV感染的经济、有效方案[48,56]。肝移植术后恩替卡韦单药治疗已被证实可有效预防新发乙肝[49]。但是,上述受者的NAs 使用时间目前尚无定论。美国移植学会召集多学科专家小组提出共识,推荐无乙肝免疫或乙肝疫苗免疫状态的肝癌肝移植受者长期服用NAs,但自然免疫状态受者可不采取预防措施[57]。也有研究表明,供者HBcAb 状态对肝移植后肝癌复发风险并无影响[58]。
肝移植术后慢性肾损伤并不罕见,部分与围术期急性肾损伤相关,部分与长期应用阿德福韦、富马酸替诺福韦二吡呋酯等NAs 和钙调磷酸酶抑制剂(calcineurin inhibitor,CNI)等肾毒性药物相关[59]。因此,英国相关指南推荐,对于肝移植术后肾功能不全的受者可增加霉酚酸类药物剂量,同时减少CNI 剂量,并注意NAs 的肾脏安全性[60]。多项研究指出,相比其他NAs,富马酸丙酚替诺福韦更能有效抑制HBV 并保护肾功能[61-63]。
中国丙型肝炎病毒(hepatitis C virus,HCV)感染患者呈增多趋势,传统的干扰素联合利巴韦林治疗丙型肝炎(以下简称丙肝)应答率较低且耐受性较差。随着直接抗病毒药物(direct-acting antivirals,DAAs)的上市,HCV 感染的治疗取得了重大突破。目前,新一代强效DAAs 组合索磷布韦/维帕他韦、索磷布韦/来迪派韦已进入国家医保药品目录。相比干扰素,DAAs 持续病毒学应答(sustained virologic response,SVR)率高,耐受性好,使得治愈HCV 感染成为现实[64-67]。对于HCV RNA 阳性的移植等待期肝癌患者,移植前抗病毒治疗是预防肝移植后丙型肝炎(以下简称丙肝)复发的最好方法,建议根据肝功能、肾功能、HCV RNA 水平及基因型选择合适的DAAs[68-70]。术前经抗病毒治疗HCV RNA 转阴的受者,术后无需预防性抗病毒治疗。但对于术前未接受足疗程抗病毒治疗的HCV RNA 阳性受者,以及移植后出现丙肝复发者,术后均应采用DAAs 治疗,以期获得SVR,并降低肝癌复发率,治疗时机建议在肝移植术后3 ~6 个月开始[70-74]。
5 肝癌肝移植受者免疫抑制剂应用(表5)

表5 肝癌肝移植受者免疫抑制剂应用
CNI 的应用是肝癌肝移植术后肿瘤复发的独立危险因素。对于肝癌肝移植受者,肿瘤的复发风险与其侵袭性及机体的免疫功能有关,受者处于强免疫抑制状态时其免疫监视系统受到破坏,促进肿瘤复发、转移,而免疫抑制强度不足则容易诱发排斥反应。如何维持这一平衡,目前尚无统一的临床方案和监测手段。肝癌肝移植受者目前尚不建议免疫抑制剂的全线撤除,但主张个体化的低剂量免疫抑制方案[75]。近年来,包括糖皮质激素早期撤除、无糖皮质激素及使用具有肿瘤抑制作用的哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)抑制剂(西罗莫司和依维莫司为代表)的免疫抑制方案日趋增多[76-85]。目前临床上主要的免疫抑制方案为:① CNI+霉酚酸类药物+糖皮质激素。② 白介素-2 受体阻滞剂+西罗莫司+霉酚酸类药物+糖皮质激素。③ 白介素-2 受体阻滞剂+霉酚酸类药物+他克莫司/西罗莫司。对于糖皮质激素早期撤除或无糖皮质激素方案,建议白介素-2 受体阻滞剂免疫诱导治疗,并延迟使用CNI和减少其剂量。现有证据表明,应用mTOR 抑制剂的肝癌肝移植受者肝癌复发率显著低于应用CNI的受者,其中应用基于依维莫司的免疫抑制方案可使肝癌肝移植受者获得更好的预后[86]。对肿瘤侵袭性强、超越移植标准的受者应用依维莫司可能获益更大[83-84]。一般可在术后4 ~6 周转换为以mTOR 抑制剂为基础的免疫抑制方案,并联合霉酚酸类药物或低剂量CNI,该方案也有助于保护肾功能[87]。对肝癌肝移植术后肿瘤复发的受者,建议应用以mTOR 抑制剂为基础的免疫抑制方案[88-90]。
6 肝癌肝移植术后复发的防治(表6)
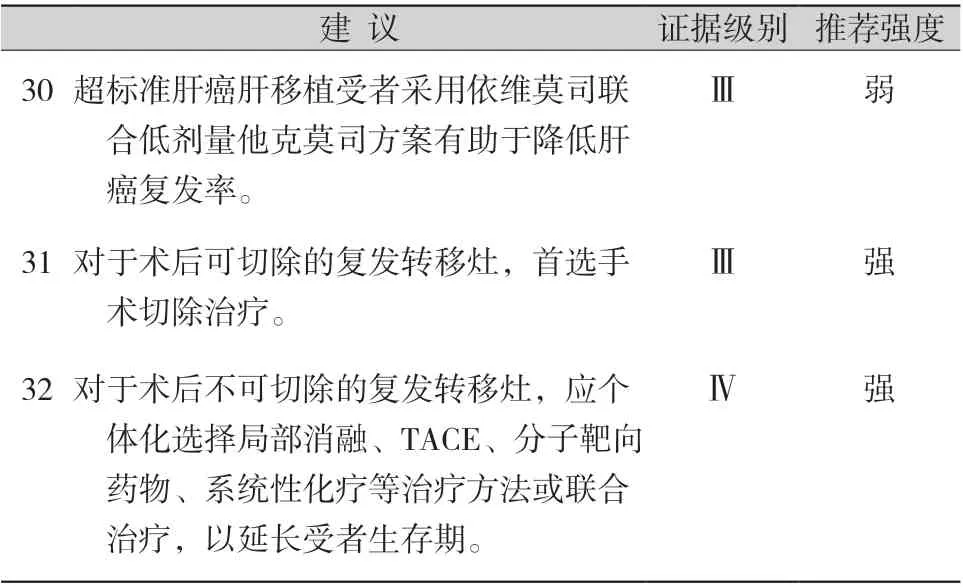
表6 肝癌肝移植术后复发的防治
肝癌肝移植术后5 年肿瘤复发率达20.0%~57.8%[5,11,88,91],合理把握肝癌肝移植指征是降低术后复发率的关键。即使执行最为严格的米兰标准,肝癌肝移植术后5 年肿瘤复发率也有4.3%[5],而随着肝癌肝移植指征的扩大,术后肿瘤复发率的增加不可避免[89]。肝癌肝移植术后复发的常见部位依次为肺(37.2%~55.7%)、移植肝(37.8%~47.9%)、腹腔(27.3%~37.7%)和骨(22.3%~25.5%)[92-93]。肝癌复发后受者中位生存期仅10.6 ~12.2 个月[92-93],因此复发转移的防治十分重要。肝癌的形态学特征(大小、数目等)、大血管和微血管侵犯、组织学分级以及AFP、异常凝血酶原等肿瘤标志物,均可作为预测肿瘤预后的重要指标,也是个体化防治方案的重要参考[94]。
肝癌肝移植术后肿瘤复发的预防策略主要包括免疫抑制方案的调整和辅助治疗。免疫抑制方案的调整见本指南第5 部分。有研究显示,超标准肝癌肝移植受者采用依维莫司联合低剂量他克莫司方案,术后2 年肝癌复发率仅为5.9%[83]。目前,用于预防肝癌肝移植术后复发的辅助治疗包括分子靶向药物和系统性化疗(如奥沙利铂+亚叶酸钙+氟尿嘧啶)等,这些辅助治疗均可为部分受者尤其是超标准受者提供一定的生存获益[95-98]。新近研究报道,对肝癌高复发风险者移植术后辅助性应用仑伐替尼有助于延长无瘤生存期[30]。
肝癌复发的早期诊断有利于治疗方案的选择以及治疗效果的提高。对于可切除的复发病灶,手术切除是首选治疗方案,术后3 年生存率可以达到60%[92-93]。当复发病灶难以手术切除时,应个体化选择局部消融、TACE、分子靶向药物、系统性化疗或综合上述治疗方案,以延长受者生存期[92-93,99-101]。有证据表明,索拉非尼序贯瑞戈非尼全程治疗肝癌肝移植术后复发受者,中位生存时间可达38.4 个月[102]。免疫检查点抑制剂作为目前肝癌治疗的有效手段之一,有报道部分肝移植受者应用后发生了严重排斥反应,因此对于肝移植术后肿瘤复发者建议谨慎使用;如确需使用,建议密切监测肝功能,并延长免疫抑制剂疗程或增加剂量[103]。有研究表明,移植肝PD-L1 表达阴性的受者,应用PD-1 或PD-L1 抗体后排斥反应发生率低。因此,对其他抗肿瘤方案治疗无效的肝癌复发者进行移植肝PD-L1 检测,表达阴性者可应用PD-1或PD-L1 单抗作为挽救性治疗,同时密切监测肝功能等变化,警惕急性排斥反应的发生[103]。此外,对于肝癌复发晚期受者,可考虑减少或停止免疫抑制剂的使用。
编审专家组组长:郑树森 。
编审专家组副组长:董家鸿、窦科峰、陈孝平、徐骁。
编审专家组成员(按姓氏笔画排序):万云乐、王正昕、王立明、卢 倩、叶啟发、冉江华、吕国悦、吕凌、吕毅、朱志军、朱晓峰、朱海涛、朱继业、刘永锋、刘军、刘连新、刘作金、刘景丰、刘磊、孙玉岭、孙诚谊、孙倍成、孙煦勇、杜成友、李文岗、李玉民、李立、李宁、李志强、李启勇、李波、杨占宇、杨扬、杨洪吉、杨家印、时军、吴刚、吴向未、吴忠均、吴泓、吴健、何晓顺、张水军、张武、张珉、张峰、张雷达、张磊、陈规划、陈忠华、陈知水、明英姿、易述红、郑虹、郎韧、赵顺云、钟林、贺强、栗光明、贾长库、夏强、徐剑、徐钧、高良辉、郭文治、陶开山、黄建钊、黄磊、彭志海、蒋文涛、景鸿恩、程颖、傅志仁、焦作义、温浩、窦剑、蔡阳、蔡金贞、滕木俭、薛武军、霍枫。
执笔:陈峻、沈恬、李建辉、凌孙彬、杨喆、汪国营、孙丽莹、杨诏旭、庄莉、高杰、郭闻渊、李捷、许圣均、卫强、徐骁。
