《移植前实体器官恶性肿瘤和器官移植候选资格:专家共识声明》解读
2022-03-13王辉郑虹天津市第一中心医院器官移植中心天津300192
王辉,郑虹(天津市第一中心医院器官移植中心,天津 300192)
随着癌症治疗方法的进步及新型治疗药物的涌现,癌症患者的生存率在最近几十年里有了很大的提高,并且移植前罹患恶性肿瘤(pretransplant malignancy,PTM)的患者接受实体器官移植治疗的数量也大幅增加。美国器官共享联合网络(the United Network for Organ Sharing,UNOS)的数据显示,在2016 年,8.3%的肾移植患者术前罹患恶性肿瘤[1]。2021 年美国一项研究报道,有0.05%的癌症(非肝脏恶性肿瘤)患者接受实体器官移植(solid organ transplantation,SOT)[2]。移植受者必须接受免疫抑制药物治疗,这增加癌症复发的风险,移植的益处与肿瘤复发的风险需慎重权衡,还需要考虑伦理和公平的原则,为了平衡稀缺资源的公平分配与PTM 患者移植的益处,美国移植协会于2019 年9 月29 日至30 日在德克萨斯州达拉斯-沃斯堡举行共识研讨会,旨在帮助移植医生确定罹患恶性肿瘤病史的患者是否适合移植以及移植的时机[3]。
1 共识范围
本共识提出的建议包括常见的实体器官癌,包括乳腺癌、结肠直肠癌、肛门癌、泌尿系统癌症、妇科癌症、非小细胞肺癌。
2 与会专家及共识形成的过程
本次研讨会邀请30 余位专家,包括移植医生(外科医生、内科专家和麻醉师)以及肿瘤外科和内科专家和癌症流行病学专家,探讨PTM 成功治疗后SOT 的时机。基于目前关于癌症治疗、不同分期癌症的预后、普通人群癌症复发的动力学,以及现有的免疫抑制对癌症影响的有限研究数据,进行讨论并达成共识,通常以在进行移植前的5 年癌症生存率接近80%作为可接受移植的标准。
3 乳腺癌
对低风险的女性患者,如导管原位癌和Ⅰ期乳腺癌,移植候选人完成所有标准治疗(如手术、放射和/或非内分泌系统性治疗)后,即可进行移植。乳腺癌的内分泌治疗可能会持续5 ~10 年,但这些药物的耐受性好、不良反应少,不影响移植的时机。对于Ⅱ期患者,5 年总生存率为78%~83%,治疗后经1 ~2 年无复发可进行移植。晚期乳腺癌(Ⅲ期)患者的5 年生存率为50%~70%[4],但大多数复发时间在前3 年,治疗后3 ~5 年无复发,可以考虑接受移植。但需注意激素受体阴性的肿瘤在治疗后2 ~3 年复发风险可能会增高。炎性乳腺癌是乳腺癌中最具侵袭性类型,中位生存期约为2.9 年,总体5 年生存率低于55%[5],所有乳腺癌转移的女性预后都很差,平均总生存期为2 ~3 年[6]。炎性乳腺癌和乳腺癌转移的患者一般不考虑移植治疗。
4 结肠直肠癌
建议结肠癌患者经完整规范治疗后可考虑行移植手术,移植时间建议为:低风险患者(Ⅰ期:T1 或 T2,N0,M0)在结肠癌治疗后1 年;中低风险患者(Ⅱ期:T3,N0,M0)在结肠癌治疗后2 年,如果有高危特征,考虑延长时间;中高风险患者(Ⅱ期:T4,N0,M0;Ⅲ期:任意T,N+,M0)在结肠癌治疗后3 年,有高危特征时需要5 年;高风险患者(Ⅳ期:任意T,任意N,M+)5 年内不推荐实体器官移植,要求5 年内无肿瘤复发。高危特征包括:淋巴、血管侵犯或外周神经侵犯;黏液癌或印戒癌;组织学低分化;肠梗阻;肿瘤性穿孔;检查淋巴结数量<12 个。
有直肠癌手术史的患者可以考虑在相似的时机进行移植。低风险患者(Ⅰ期:T1 或T2,N0,M0;肿瘤完整切除)需等待1 年,如有高危特征可考虑2 年;中低风险患者(Ⅰ期:T1,N0,M0;局部切除)需等待2 年;中高风险患者(Ⅱ期:T3 或T4,N0,M0;Ⅲ期:任意T,N+,M0)需等待3 年,有高危特征时需5 年;高风险患者(Ⅳ期:任意T,任意N,M+)5 年内无肿瘤复发。高危特征包括:淋巴、血管侵犯或外周神经侵犯;黏液癌或印戒癌;组织学低分化;肠梗阻;肿瘤性穿孔;检查淋巴结数量<12 个;直肠下1/3 处;不完整的直肠及系膜切除。
未接受手术切除的患者需要对针对患者情况进行多学科讨论。随着直肠癌非手术治疗的引入,这些患者的移植评估更具挑战性,因为对直肠癌患者何时被认为是“无癌”的困惑越来越多。目前,非手术治疗的直肠癌患者至少要接受5 年的随访监测。
对于结直肠肝转移患者,如果残肝不足和无肝外受累者,可选择肝移植治疗。在严格的选择标准下,肝移植术后1 年和5 年的总生存率分别为100%和83%[7]。
5 肛门癌
没有关于移植时已罹患肛门癌患者的数据,但是来自普通人群的数据表明:浸润性肛门鳞状细胞癌患者的5 年生存率低于70%[8]。共识建议浸润性、人类乳头瘤病毒相关肛门癌病史的患者需经5 年无复发的时间后可以进行移植。非浸润性肛门病变的患者在移植前需慎重权衡,因移植后这些病变进展的风险增加,移植后积极监控肿瘤的复发。
6 泌尿系统恶性肿瘤
6.1 前列腺癌:多项预测工具(如前列腺癌风险评分,nomogram)可用于预测前列腺癌的男性未来15 年癌症特异性死亡的可能性。即使对于“中危”前列腺癌的高危人群(PSA=19 ng/ml,Gleason 4 + 3=7,T3a, 切缘阳性,淋巴结阴性),15 年的癌症相关死亡的可能性低于5%[3]。没有证据表明免疫抑制会增加前列腺癌的风险,增加既往治疗后复发的风险[9],增加移植后诊断前列腺癌的5 年癌症相关病死率(<1%)[10]。前列腺癌诊断后推荐的等待时间和治疗见表1[3]。
6.2 肾细胞癌:在考虑移植的患者中发现的大多数肾脏肿物为偶然发现的小肿物,大小≤4 cm,大多数小肿物为肾细胞癌(占75%~80%),并且大多数为低分级(占85%),出现转移的风险<2%,接受治疗后,3 年的转移概率≤2%[11]。考虑到疾病进展的风险低,器官衰竭患者行肾切除术发生术后并发症的风险很大,这可能超过手术带来的好处。因此,在挽救生命的移植(如心、肺、肝)背景下,肾小肿物(<3 cm)可考虑监控策略。移植成功后,在移植后3 ~6 个月再行肾切除术,预后良好。在等待心脏、肺、肝移植的监测患者和射频消融治疗的肾肿瘤患者中,没有数据表明增加免疫抑制剂是否会产生有害影响。因此,建议移植后进行限期处理肾肿瘤,并对经消融治疗的增大或生长的肾肿物行肾脏切除术。共识推荐的等待时间如下:T1a(≤4 cm)、N0、M0 患者无需等待;T1b(>4 cm,≤7 cm)、N0、M0 患者,Fuhrman 分级1/2 无需等待,Fuhrman分 级3/4 需1 ~2 年 无 复 发;T2 (7 ~10 cm)、N0、M0 患者需等待2 年无复发;T3、N0、M0 或T4、N0、M0 患者至少2 年无复发后重新评估;任何T、淋巴结阳性、肿瘤转移为不适合移植(如果是孤立转移并切除,需要肿瘤专家讨论评估候选人);任何T、伴有肉瘤样和/或横纹肌样的组织学特征或者集合管/髓性肾细胞癌为移植禁忌。
6.3 膀胱癌:膀胱癌5 年生存率为77%,10 年生存率为70%[12]。局限性膀胱癌复发率高但进展缓慢。对于非肌肉浸润性膀胱癌患者,大多数复发可局部切除,由于进展罕见,膀胱可以保持完整。低风险非肌肉浸润性膀胱癌患者尽管在5 年复发率高达28%,但因为进展风险极低(超过5 年时为1%~2%)[13],如果6 个月内没有复发,可以考虑移植。对于中等风险的非肌肉侵袭性膀胱癌患者,复发的风险略高,但进展的风险仍然较低,且复发是可以控制的,建议等待6 个月。对于高风险非肌肉浸润性膀胱癌患者,在确诊后进展的风险高(5 年约为18%)[14],移植的时机仍存在争议,在局部控制和膀胱内治疗后,通常建议至少等待2 年。对于接受根治性膀胱切除术的肌肉浸润性膀胱癌患者,大多数复发发生在手术后2 年内,可以发生局部转移、残余尿路内转移,或远处转移,超过2 年后则复发率低,可以考虑对根治性膀胱切除术2 年后没有复发转移证据的患者进行移植。在使用放化疗保留膀胱方法治疗的肌肉浸润性膀胱癌患者中,局部复发风险高,这些患者应根据个体的具体情况考虑是否行实体器官移植。
7 妇科癌症
关于移植前罹患妇科恶性肿瘤的患者,移植后的生存和癌症复发风险的文献很少。对最常见类型的子宫内膜癌、卵巢癌和宫颈癌按复发风险可分为低(复发风险<5%)、中(复发风险5%~15%)、高(复发风险>30%)及极高(复发率>80%)。
低复发风险包括:ⅠA /ⅠB 期1 ~2 级子宫内膜癌,且无淋巴及管腔浸润;ⅠA/ⅠB/ⅠC 期1 ~2 级上皮性卵巢癌;ⅠA1 /ⅠA2 期宫颈鳞状细胞癌/腺癌。在初次治疗结束后,低风险的患者任何时间都可以考虑移植。
中复发风险包括:Ⅰ/Ⅱ期子宫内膜癌伴高龄、淋巴管腔浸润、2 级或3 级子宫内膜样癌、深浸润性肿瘤;ⅠB 期宫颈鳞状细胞状/腺癌。中风险患者的5 年生存率超过90%,前2 年疾病复发风险最大,在治疗结束后至少2 ~3 年没有疾病复发的迹象,可考虑移植。
高复发风险包括:子宫浆液性、透明细胞性或子宫癌肉瘤(所有分期);Ⅲ期1 ~3 级子宫内膜样癌;Ⅱ/Ⅲ期上皮性卵巢癌;Ⅱ/Ⅲ期宫颈鳞状细胞癌/腺癌。复发风险高的患者包括晚期子宫癌、卵巢癌或宫颈癌。在卵巢癌症治愈后,超过一半的患者会在前2 年的随访中复发,然而选择多聚ADP 核糖磷酸化酶抑制剂治疗的女性,可以通过维持治疗延长3 年或更长的无进展生存期[15]。对于高危子宫内膜癌的妇女,约40%会在前3 年内复发[16]。对于Ⅲ期宫颈癌的妇女,4 年无进展生存率为80%[17]。高风险的患者在治疗后5 年没有疾病复发时可考虑移植。
极高复发风险包括:Ⅳ期子宫内膜癌(所有级别);复发或转移性子宫内膜癌;Ⅳ期上皮性卵巢癌(任何级别);复发性卵巢癌;Ⅳ期宫颈鳞状细胞癌/腺癌;转移性或复发性宫颈癌。此类患者为不适宜行移植手术。
8 非小细胞肺癌
在美国,非小细胞肺癌仍然是癌症相关死亡的第1 位原因,早期疾病可以通过手术切除和/或放射治疗治愈。大多数非小细胞肺癌的复发发生在明确治疗后的前2 年,但有1 / 3 的患者可在5 年后复发[18]。因为癌症和终末期肺病的影像学表现重叠,有些肺癌可能无法在肺移植前做出诊断。近年来,由肺移植引起的肺癌总发病率上升到2.5%[19]。
是否可以将非小细胞肺癌患者列入移植名单取决于疾病的分期、治疗史,对于胸部器官移植候选者,还需要考虑之前的放疗和/或手术导致的胸部解剖的复杂程度。专家共识建议治疗效果良好的早期病例在3 年后可以考虑移植,但需要非常谨慎。由于移植后使用免疫抑制剂,使用检查点抑制剂控制或缓解癌症的作用可能会失效,导致癌症复发。有肺癌病史的实体器官移植候选者的推荐等待时间见表2[3]。
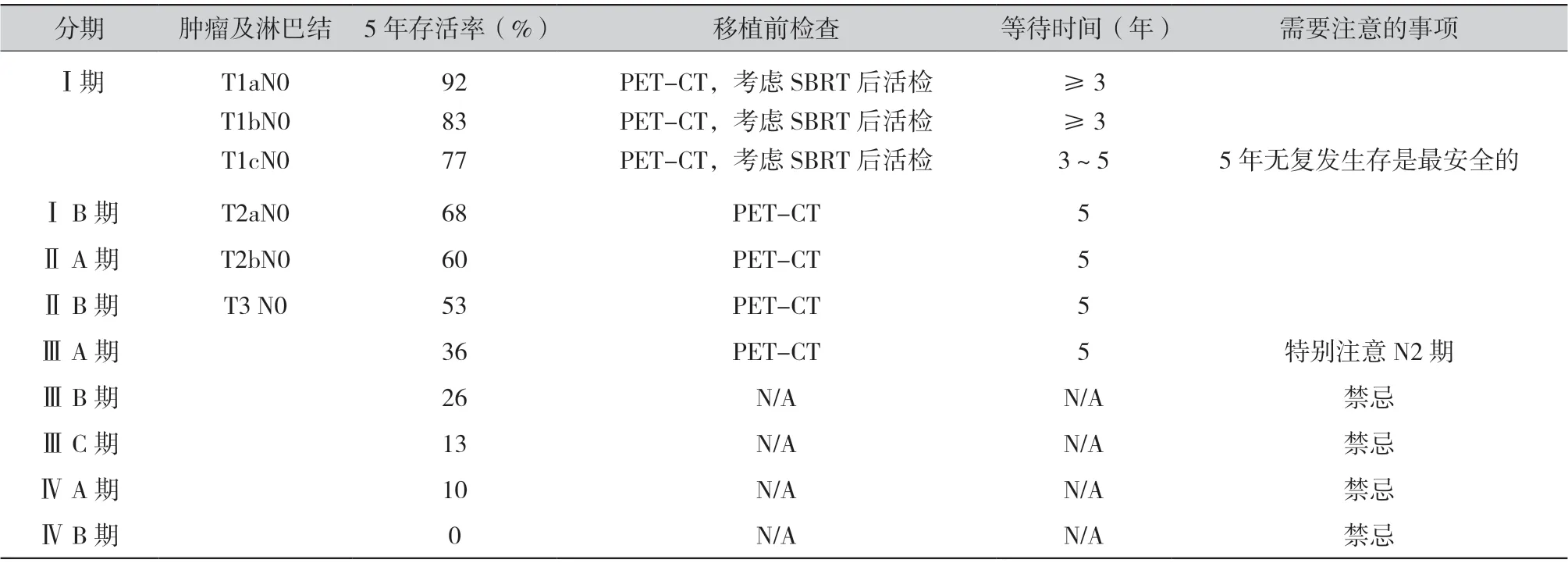
表2 肺癌病史的实体器官移植候选者的推荐等待时间
9 小 结
在接受SOT 评估的终末期器官疾病患者中,PTM 很常见,可能影响移植后的效果。随着当代癌症治疗的进步和总体生存率的提高,美国移植协会更新了PTM 患者的移植时机的共识文件,也正在制定PTM 患者移植后的标准化监控的指导方针。本次会议发表的共识仅是建议而非临床指南,且大部分数据是从一般人群中推断出来的,证据的等级也没有分级。为提高这些建议的证据级别,未来的目标是创建一个多机构的数据库,收集和共享移植患者的前瞻性数据。未来的研究领域应集中在适当的癌症监控和减少PTM 患者移植后癌症复发的可控危险因素。
