功能化银-氧化锌纳米颗粒比色法检测废水中重金属离子
2022-03-12吴小媚
吴小媚
(利诚检测认证集团股份有限公司,广东 中山 528400)
随着人类工业化的发展,包括采矿、电镀、制革、纺织、人造丝工业,以及电池制造等企业会产生大量废水。所有工厂和工业产生的废水都含有某种形式的重金属,如果不加以处理直接排放,会导致人类饮用水水源受到重金属污染的严重威胁[1]。某些重金属即使非常少量也可能对个人和环境造成危险。重金属离子很容易通过水被生物吸收,并通过食物链扩散,对人类、植物和动物构成严重威胁[2]。
研究人员开发了多种方法,利用仪器检测水中的这些重金属,如电化学方法、电子传感器、光学传感器等[3]。大多数情况下,这些方法都是针对特定的重金属离子。在某些情况下,传感方法复杂、昂贵,而且需要操作人员具有良好的专业知识。因此,对这些重金属离子进行特异性的鉴定和定量是非常重要的。因此,开发一种低成本、简单易行的方法非常重要。ZnO 和Ag 纳米颗粒已用于水中重金属离子的检测。但将ZnO 和Ag 纳米颗粒与比色法结合的方法目前还少见报道。该文通过纳米粒子成功地检测了水中的Cr6+、Ni2+重金属离子。然后,通过紫外-可见光谱法对不同浓度的重金属离子进行比色检测。
1 材料与方法
1.1 试验试剂与仪器设备
试剂:二水合醋酸锌、硝酸银、乙醇、氨溶液都是分析级,购自Sigma-Aldrich 公司。
仪器:TDM-20 高功率X 射线衍射仪(丹东通达科技有限公司,辽宁省);Gemini 型扫描电子显微镜(昆山友硕新材料有限公司,江苏省);FT-IR 6600 傅里叶变换红外光谱仪(天瑞仪器股份有限公司,江苏省);UV-vis 光谱仪(谱朗光波(杭州)科技有限公司,中国)。
1.2 Ag-ZnO 纳米颗粒的合成
采用共沉淀法[4]制备Ag-ZnO 纳米颗粒。将6.5 g 二水合醋酸锌溶解到100 mL 的去离子水中,搅拌30 min 形成溶液A。将0.20 g 硝酸银与40 mL 乙醇混合,搅拌30 min 形成另一个溶液B。将2 种溶液混合在一起,并将氨溶液缓慢添加到该混合溶液中。在低氨浓度下,由于氢氧化锌沉淀的形成,溶液混合物变成白色。不断地加入氨水,直到溶液混合物变清。最后,将NaOH 溶液滴加到形成沉淀的透明溶液中。将溶液在恒温下搅拌1 h,然后离心,将沉淀在500 ℃下加热1 小时,得到固体物质。最后,将得到的固体物质用电机粉碎成粉末,得到Ag-ZnO 纳米颗粒。
1.3 Ag-ZnO 纳米颗粒的表征
采用X 射线衍射仪在20°~80°分析了Ag-ZnO 纳米颗粒的晶体结构;使用扫描电子显微镜观察了Ag-ZnO 纳米颗粒的形貌;采用傅里叶变换红外光谱对Ag-ZnO 纳米颗粒进行结构表征。使用UV-vis 光谱检测各种浓度的重金属离子。
2 结果与讨论
2.1 结晶性能
合成的Ag-ZnO 纳米颗粒的XRD 谱图如图1 所示。从X射线衍射图中证实纳米颗粒为具有P63mc的六角形纤锌矿结构(JCPDS No.01-080-0075)。在2θ 值分别为31.85°、34.52°、36.35°、47.69°、56.75°、63.09°、66.56°、68.16°、69.29°、72.87°、77.21°、81.72°、89.95°出现衍射峰,分别对应 [100]、[002]、[101]、[102]、[110]、[103]、[200]、[112]、[201]、[004]、[202]、[104]平面。得到的尖峰表明,粒子在本质上是高度纯净和结晶的[5]。此外,银的掺杂增强了峰的强度。

图1 合成的Ag-ZnO 纳米颗粒的XRD 谱图
2.2 形态和元素分析
利用扫描电镜对合成的Ag-ZnO 纳米颗粒的表面形貌进行了研究。Ag-ZnO 纳米颗粒的SEM 图像如图2(a)所示。在低分辨率下,粒子的形状不清晰可见,但随着放大,粒子清晰可见。SEM 图像显示纳米颗粒呈棒状。利用imageJ 软件绘制的SEM 图像直方图如图2(c)所示,表明Ag 掺杂纳米颗粒的平均粒径为95.5 nm。
利用FTIR 光谱对合成的Ag-ZnO 纳米颗粒的结构进行研究。Ag-ZnO 纳米颗粒的FTIR 光谱如图2(b)所示。在571.45 cm-1附近的峰值对应Zn-O 键的特征拉伸模式[6]。约864.51 cm-1附近较强的带是银掺杂造成的。在1425.15cm-1和2981.58 cm-1处观察到的吸收带对应的是纳米粒子表面水分子的吸收导致的O-H基团的拉伸模式。设备中CO2的存在导致在2324.91cm-1处观察到峰值。2981.58cm-1处的能带属于C-H 拉伸振动,而1396 cm-1处的峰值则属于C-O 双键拉伸[7]。FTIR 光谱的结构表征也表明成功合成了Ag-ZnO纳米颗粒。因此,从形态、结晶和结构分析表明,采用共沉淀法成功制备了高纯的、结晶的、棒状Ag-ZnO 纳米颗粒。

图2 Ag-ZnO 纳米颗粒的SEM 图像、FTIR 光谱图以及平均粒径直方图
2.3 重金属离子的检测
制备的Ag-ZnO 纳米颗粒用于重金属离子Ni2+和Cr6+的比色检测。将所需数量的三氧化铬(VI)和六水合硝酸镍(II)溶解于去离子水中,即可得到重金属离子溶液。为每种重金属离子制备了不同浓度的溶液,从摩尔到微摩尔不等。将每种重金属离子溶液(以不同的浓度)加入Ag-ZnO 纳米颗粒溶液中。在大多数报道的工作中,ZnO 或Ag 掺杂的ZnO 纳米颗粒的吸收峰在350 nm~400 nm。该文中制备的纳米颗粒是棒状的,尺寸更小。因此,由于粒径减少,会发生蓝移,在360nm~370 nm 处的峰消失。在较高的浓度下,试验结果清晰可见。图3(a)为在Ag-ZnO 纳米颗粒溶液中加入1 M 重金属离子得到的不同颜色溶液。结果表明,Ag-ZnO纳米颗粒能检测到这些重金属离子的存在。图 3(b )所示的 UV-vis 光谱表明,加入重金属离子,如Ni2+和Cr6+使峰值位置发生了偏移。
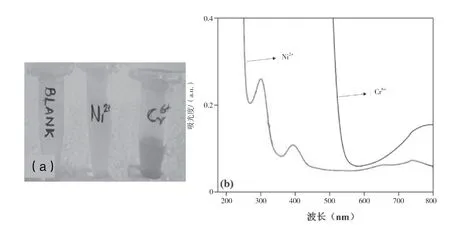
图3 在Ag-ZnO 纳米颗粒溶液中加入Ni2+和Cr6+离子后可见的颜色变化(a)以及相应的紫外-可见光谱图(b)
然而,在较低的浓度下,颜色变化是不可见的,因此,可用紫外可见光谱进一步分析检测。图4 为不同浓度下各重金属离子的紫外-可见光谱。对所有的重金属离子,强度随着重金属离子浓度的增加而增加。根据比尔·兰伯特定律,这很容易解释,该定律指出紫外光谱的强度与浓度成正比[8]。除此之外,对较高浓度(1 M)的可见光区吸收是由于溶液的颜色。重金属离子浓度的降低导致溶液颜色强度的降低[9]。因此,在低浓度的可见区域没有吸收。从图4可以清楚地看出,Ag-ZnO 纳米颗粒成功地检测到不同浓度的Ni2+和Cr6+离子的存在。两种金属离子检测到的最低浓度为100μM。

图4 Cr6+和Ni2+离子在不同浓度下的紫外可见光谱
2.4 重金属离子的降解
使用Ag-ZnO 纳米颗粒作为催化剂,NaBH4作为降解剂,将Ag-ZnO 纳米颗粒扩展到研究重金属离子降解中。在去离子水中配制成0.1 M 浓度的重金属离子溶液。另一种0.1M NaBH4的溶液在去离子水中与Ag-ZnO 纳米颗粒的胶体溶液中制成。对每个重金属离子,在相应的重金属离子溶液中加入硼氢化钠溶液,然后加入纳米颗粒溶液。紫外-可见光谱在10min 后记录,持续时间为30min。从图5 所示的UV-vis光谱可以明显看出,纳米颗粒和NaBH4一起能够降解所检测到的两种重金属离子。各重金属离子的紫外-可见光谱强度随时间的增加而减小,表明重金属离子的降解,且两种重金属都在30min 内完全降解。
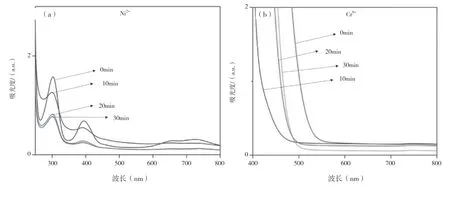
图5 Ag-ZnO 纳米颗粒降解重金属离子
3 结论
该研究采用共沉淀法合成了Ag-ZnO 纳米颗粒。首先利用XRD、SEM 和FTIR 光谱技术对纳米颗粒的形貌和结构化学进行了表征。结果证实了纳米颗粒的成功合成,这些颗粒是高度结晶,棒状的,粒径为95.5 nm。
然后将合成的纳米颗粒用于重金属离子的比色检测,成功检测到Ni2+、Cr6+重金属离子。Ni2+、Cr6+重金属离子在高浓度下,肉眼可见其颜色变化。低浓度下,通过紫外可见光谱分析,检测到的最小浓度为100μm。
除了检测外,纳米颗粒还被用作催化剂,用于NaBH4降解上述检测到的重金属离子。在30 min 的降解时间内,两种重金属离子都被降解。因此,Ag-ZnO 纳米颗粒成功地检测了水溶液中的重金属离子,并在降解过程中作为催化剂。
