钛石膏-H2SO4-H2O体系中石膏-硬石膏的相变规律
2022-03-12彭同江孙红娟丁文金
王 倩,彭同江,4,孙红娟,丁文金,林 艳
(1.西南科技大学环境与资源学院,绵阳 621010;2.西南科技大学,固体废物反应与资源化教育部重点实验室,绵阳 621010; 3.西南科技大学矿物材料及应用研究所,绵阳 621010;4.西南科技大学,分析测试中心,绵阳 621010)
0 引 言
钛石膏是采用硫酸法生产钛白粉时,用石灰(或电气渣)中和酸性废水所产生的以石膏为主要成分的废渣。钛石膏含有更高含量的氧化铁等杂质,在资源化利用过程中可用硫酸法进行除杂。由于同离子效应,绝大部分硫酸钙没有进入酸溶液而以石膏或硬石膏的形式存在,但在钛石膏-H2SO4-H2O体系中石膏转变为硬石膏的工艺条件和转化路径尚未查明,这直接影响到除杂后产物的性能和应用。
钛石膏一般含质量分数为30%~50%的游离水,黏度大,pH值偏弱碱性,因氧化程度的大小呈灰褐色~红棕色[1-3]。除杂质组分,钛石膏中矿物组分主要为二水石膏(dihydrate,DH;CaSO4·2H2O)[4-5]。相较于天然石膏、脱硫石膏和磷石膏,钛石膏由于其杂质含量高,经热反应后形成的制品不仅外表泛黄,而且抗折、抗压强度低,难以在建材方面推广应用[6-7]。
为了去除杂质改善钛石膏的应用性能,常用萃取法、还原漂白法、酸浸法、浮选法等对钛石膏进行湿法除铁[6]。其中,酸浸法除铁效果好,更易工业化。酸浸法常用盐酸、硫酸、草酸等,在除铁过程中,H+会促进石膏的相变[8]。Li等[9]基于OIL化学模型,构建了HCl-CaCl-H2O体系中石膏、烧石膏(hemihydrate,HH;CaSO4·0.5H2O)和硬石膏(anhydrite,AH;CaSO4)三相的相变图,结果表明HCl浓度的增加导致二水石膏向烧石膏快速转化,并降低相变的转变温度。在高温高压下,各学者对石膏的脱水反应有不同的观点。有学者认为,脱水反应可分为两个步骤,从石膏到烧石膏再到硬石膏[10]。Comodi等[11]采用拉曼光谱和同步X射线衍射技术研究了在2.5 GPa时,石膏在428 K左右开始脱水,形成烧石膏;在488 K时完全脱水形成γ-硬石膏。有的学者报道了石膏直接脱水生成硬石膏的一步反应[12]。Chio等[13]利用拉曼光谱在常压约373 K温度条件下,直接观察到石膏脱水形成硬石膏,没有中间产物烧石膏的形成。由于石膏、烧石膏和硬石膏在不同温度的溶液中的溶解度不同,从而出现一种相向另一种相的转变。CaSO4-H2O体系[14]、CaSO4-H3PO4-H2O体系[15]和氯化物电解质体系[4,16-17]之前已被重点关注,而对CaSO4-H2SO4-H2O电解质水溶液体系的研究尚少有报道。
本文基于硫酸法对钛石膏进行除杂过程中沉淀产物的物相变化特征,在常压下,对钛石膏-H2SO4-H2O体系中石膏-硬石膏的相转变进行了研究,探索硫酸浓度、反应时间和反应温度对石膏转变为硬石膏的影响,以获得石膏相变为硬石膏的工艺技术参数,并揭示在钛石膏-H2SO4-H2O体系中石膏-硬石膏的转化规律。
1 实 验
1.1 原料、试剂和装置
原料:钛石膏,采自攀枝花某钛石膏堆场,呈块状、棕红色,pH值为7.48,编号为T-DH。
试剂:硫酸,质量分数96%~98%,分析纯,购自成都科龙化学试剂厂;实验室自制去离子水,电阻率>18.2 MΩ·cm。
装置:恒温加热磁力搅拌器-DF-101S型,循环水式真空泵SHZ-D(Ш)(巩义市予华仪器有限公司),电热恒温干燥箱202-1型(上海浦东荣丰科学仪器有限公司),电子天平JT2003(JinNuo Balance Instrument Co, Ltd)。
1.2 试验方案与步骤
采用单因素试验方法,考察硫酸浓度、反应温度与反应时间3个因素对石膏转化为硬石膏的影响。样品编号为L-c-T-t(其中L表示试验标识;c表示硫酸浓度,单位:mol/L;T表示反应温度,单位:℃;t表示反应时间,单位:min)。所涉及的试验均采用2或3个平行样。具体试验方案如表1所示。

表1 试验方案Table 1 Experimental program
按表1试验方案进行试验,具体步骤为:将钛石膏按固液比(g/mL)1 ∶10与一定浓度的硫酸溶液在250 mL锥形瓶中混合均匀形成悬浊液;将锥形瓶置于恒温加热磁力搅拌器上,在一定温度和搅拌转速300 r/min条件下,反应一定时间趁热对悬浊液进行过滤(或隔一定时间取样趁热过滤,以1、2、3……标记取样次序);将过滤所得滤渣用沸水洗涤至中性,用乙醇冲洗以固定其物相防止水化,然后置于45 ℃的烘箱中干燥至恒重。过滤时获得的滤液用于测定钙离子和总铁离子的浓度变化,干燥至恒重的滤渣用于分析物相的变化。
1.3 样品表征
采用X射线荧光光谱仪(X-ray fluorescence spectrometer,XRF,Axis型,PANalytical B.V.)测定钛石膏化学成分;采用X射线衍射仪(X’pert Pro型,PANalytical B.V.)测定产物的物相组成;采用光学显微镜(BK-POL系列偏光显微镜,奥特光学)分析产物微观形貌;采用电感耦合等离子体发射光谱仪(iCAP6500型,Thermofishher scientific)分析滤液中钙离子和总铁离子的浓度。
2 结果与讨论
2.1 钛石膏原样的化学与矿物组分特征
表2为钛石膏原样的化学成分分析结果。由表2可以看出,钛石膏原样的主要化学成分(质量分数)为SO333.58%,CaO 31.70%,TFe2O310.63%,另含有少量SiO2、Al2O3、TiO2、MgO、MnO等杂质,烧失量为18.38%,烧失量主要由钛石膏在焙烧过程中石膏和铁的水合氧化物失水所致。

表2 钛石膏原样的主要化学成分Table 2 Main chemical composition of the original titanium gypsum sample
图1为钛石膏原样的XRD谱。由图1可知,钛石膏原样中出现的强峰与标准卡片石膏(PDF#33-0311)的衍射峰全部吻合,主要特征衍射峰有d020=0.762 1 nm、d021=0.427 9 nm、d040=0.379 4 nm、d041=0.306 6 nm,没有发现烧石膏、硬石膏和其他杂质物相的衍射峰。
图2为钛石膏原样光学显微镜下的微观形貌。可以看出,颗粒大小主要在1.6~14.0 μm之间,形貌多呈大小不同的片状晶体,少量为细小的粒状。片状晶体为石膏,细小颗粒为石膏或铁的水合氧化物[18-19]。
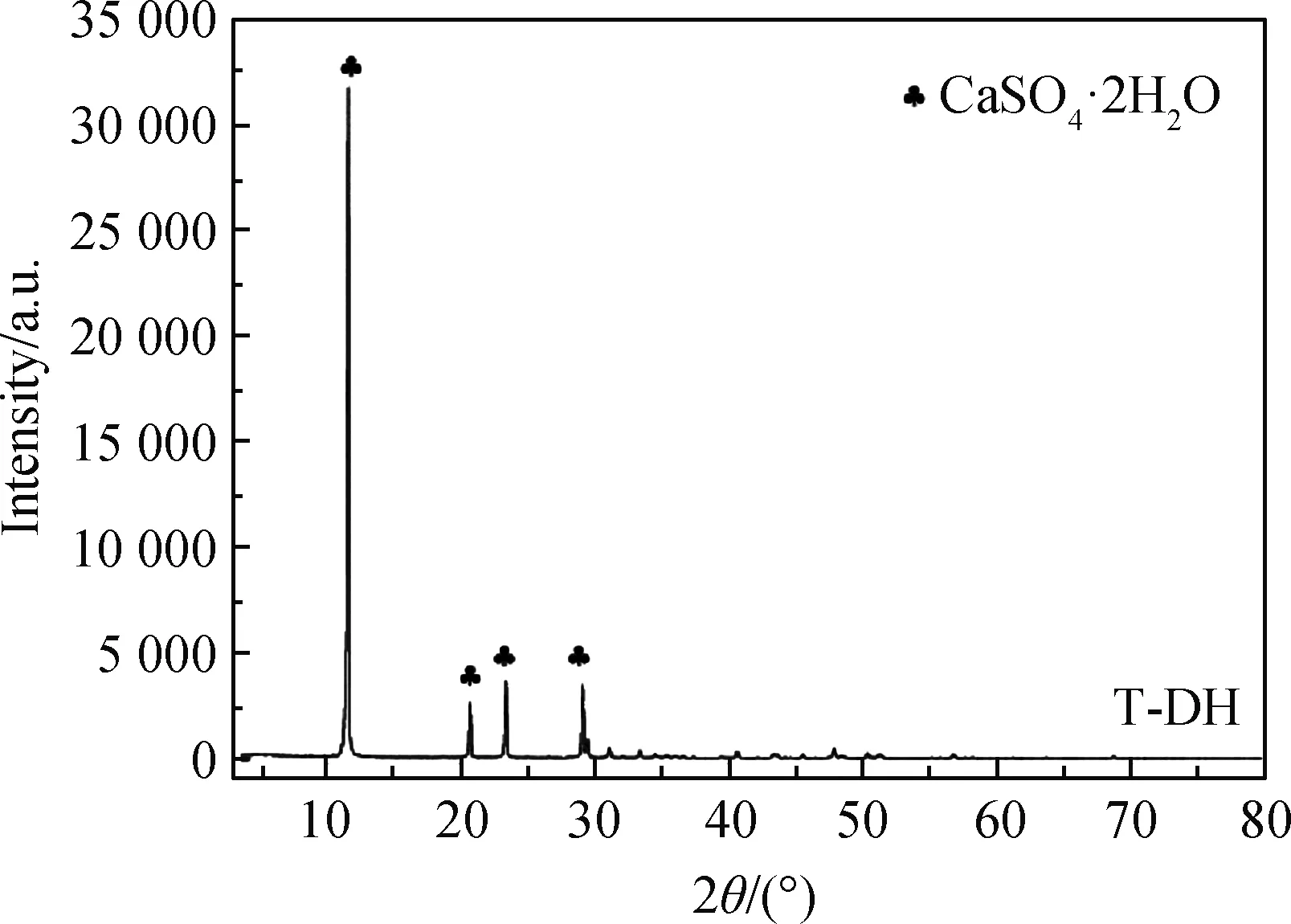
图1 钛石膏原样的XRD谱Fig.1 XRD pattern of the original titanium gypsum sample

图2 钛石膏原样的光学显微镜照片Fig.2 Optical micrograph of the original titanium gypsum sample
2.2 不同硫酸浓度溶液中钛石膏的物相变化
图3为不同硫酸浓度时,反应温度为70 ℃下,反应90 min后样品的XRD谱。由图3可知,硫酸浓度为1.5 mol/L、3.5 mol/L和4.5 mol/L时,石膏相保持稳定,未观察到明显变化。在硫酸浓度提高至5.5 mol/L、6.5 mol/L和7.5 mol/L后,所获得的样品石膏的衍射峰全部消失,新出现了d111=0.388 2 nm,d020=0.348 7 nm、d012=0.284 4 nm和d121=0.273 7 nm等硬石膏的特征衍射峰,与标准卡片硬石膏(PDF#72-0916)的衍射峰全部吻合,表明石膏完全转化为硬石膏。这表明,随着硫酸浓度的升高,即反应体系中电解质浓度增加,水活度降低,进而有利于石膏向硬石膏的转化。
上述研究发现,石膏向硬石膏转变的过程发生在硫酸浓度为4.5~5.5 mol/L时。为了进一步细化石膏向硬石膏转变的硫酸浓度区间,并探索在石膏向硬石膏转化过程中是否有中间产物烧石膏的形成,在已确认区间内进一步缩小溶液的硫酸浓度梯度。
图4为反应温度为70 ℃,在硫酸浓度为4.5~5.5 mol/L,硫酸浓度梯度为0.2 mol/L,反应时间为90 min时获得各样品的XRD谱。可以看出,反应后产物的主要物相为石膏,仅在硫酸浓度为5.3 mol/L时,所获得的样品L-5.3-70-90在d020=0.348 7 nm处出现了硬石膏的峰。
图3和图4表明,当温度为70 ℃,时间为90 min时,在硫酸溶液中钛石膏中的石膏向硬石膏转化的起始硫酸浓度为5.3 mol/L,至5.5 mol/L时转化结束,随着硫酸浓度进一步增大,所形成的硬石膏不再发生相变化,且在石膏向硬石膏转化过程中没有发现烧石膏的衍射峰。
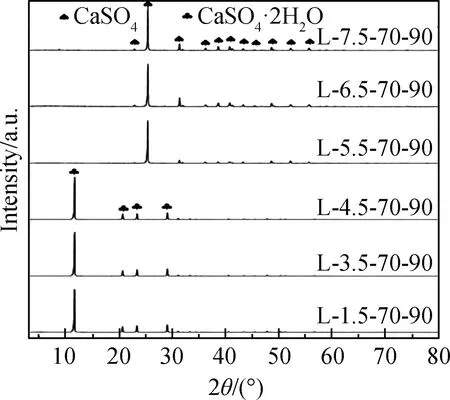
图3 不同硫酸浓度下反应90 min后样品的XRD谱Fig.3 XRD patterns of samples after reaction for 90 min under different sulfuric acid concentrations
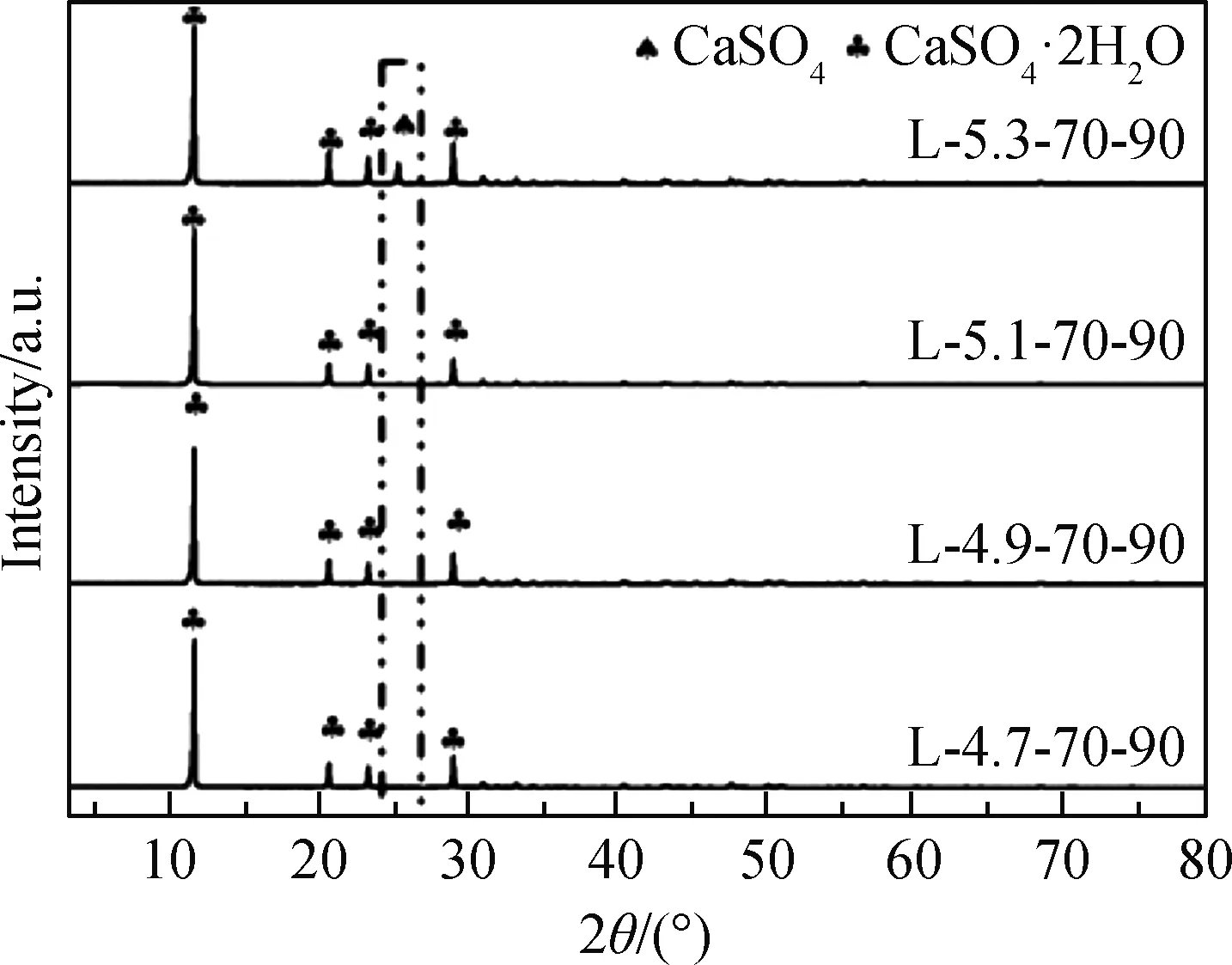
图4 不同硫酸浓度处理后样品的XRD谱Fig.4 XRD patterns of samples processed under different sulfuric acid concentrations
2.3 不同温度下钛石膏的物相变化

图5 不同温度处理后样品的XRD谱Fig.5 XRD patterns of samples processed at different temperatures
图5为硫酸浓度为5.3 mol/L时,不同温度下反应90 min后样品XRD谱。由图5可知:在温度为50 ℃、60 ℃时,未发生石膏向硬石膏的转化;当温度为70 ℃和80 ℃时,即随温度的升高,在样品L-5.3-70-90和L-5.3-80-90中d020=0.348 7 nm处出现硬石膏的衍射峰,并随着温度增加而增强,表明硬石膏的转化量随温度的升高而增加;当温度升高至90 ℃和100 ℃时,石膏完全转化为硬石膏。温度有利于石膏向硬石膏的转化,未发现温度的变化可使石膏向硬石膏转化过程中形成其他产物。
图6为硫酸浓度为5.3 mol/L时,不同温度下反应90 min后各样品在光学显微镜下的照片。由图6(a)和图6(b)可知,当温度为50 ℃和60 ℃时,所对应样品中晶体形貌都为片状,结合图5可知,此时样品物相均为石膏;由图6(c)和图6(d)可知,当温度为70 ℃和80 ℃时,样品L-5.3-90-70和L-5.3-90-80主要为片状和少量长方板状两种形貌的晶体,在对应样品的XRD谱上也以石膏为主,仅含有少量硬石膏。图6(d)相对于图6(c)长方板状晶体含量较多,表明随着温度升高,硬石膏含量增加。由图6(e)和图6(f)可知,当温度到达90 ℃和100 ℃时,样品中硬石膏(见图5)晶体全部呈长方板状。上述分析表明,片状晶体为石膏,长方板状晶体为硬石膏。相对于图6(c)和图6(d)中长方板状硬石膏,后两者中硬石膏晶体长度增加显著。这说明,随温度的升高,晶体形貌逐渐由片状的石膏转化为长方板状的硬石膏。

图6 不同温度处理后样品的光学显微镜照片Fig.6 Optical micrographs of samples processed at different temperatures
2.4 不同硫酸浓度和不同反应时间下钛石膏的物相变化
图7为在90 ℃下,不同硫酸浓度的溶液中反应不同时间后石膏向硬石膏转化样品的XRD谱。由图7(a)可知,在硫酸浓度为1.5 mol/L的溶液中反应15 h的钛石膏中只有石膏的衍射峰,未出现石膏向硬石膏的转化现象。由图7(b)和(c)可知:在硫酸浓度为3.5 mol/L和4.5 mol/L的溶液中,反应30 min和60 min后的样品中只有石膏的衍射峰,反应90 min后样品L-3.5-90-90和L-4.5-90-90出现了d020=0.348 7 nm硬石膏的衍射峰,且硫酸浓度大的溶液中样品L-4.5-90-90硬石膏的衍射峰更明显;当反应时间至120 min后,在硫酸浓度为3.5 mol/L和4.5 mol/L的溶液中都完成了石膏向硬石膏的完全转化。由图7(d)可以看出:在硫酸浓度为4.7 mol/L的溶液中反应30 min,未观察到硬石膏的衍射峰;当反应时间为60 min时样品中出现了很弱的硬石膏衍射峰;至时间为90 min时,样品L-4.7-90-90完全转化为硬石膏。由图7(e)和(f)可以看出:在硫酸浓度为4.9 mol/L和5.1 mol/L的溶液中,反应10 min后的样品中只有石膏的衍射峰;反应20 min后的样品则出现了弱的硬石膏的衍射峰;当反应时间增加至40 min及以上后,在硫酸浓度为4.9 mol/L和5.1 mol/L的溶液中都完成了石膏向硬石膏的完全转化。
由以上可以发现,随溶液中硫酸浓度在3.5~5.1 mol/L增高,石膏开始转化为硬石膏所需的时间越来越短,且随着时间的延长,最终都可完全转化为硬石膏。在完成石膏向硬石膏的完全转化后,继续延长反应时间,硬石膏物相不再发生变化。在石膏向硬石膏转化过程中未发现其他杂质物相的出现。
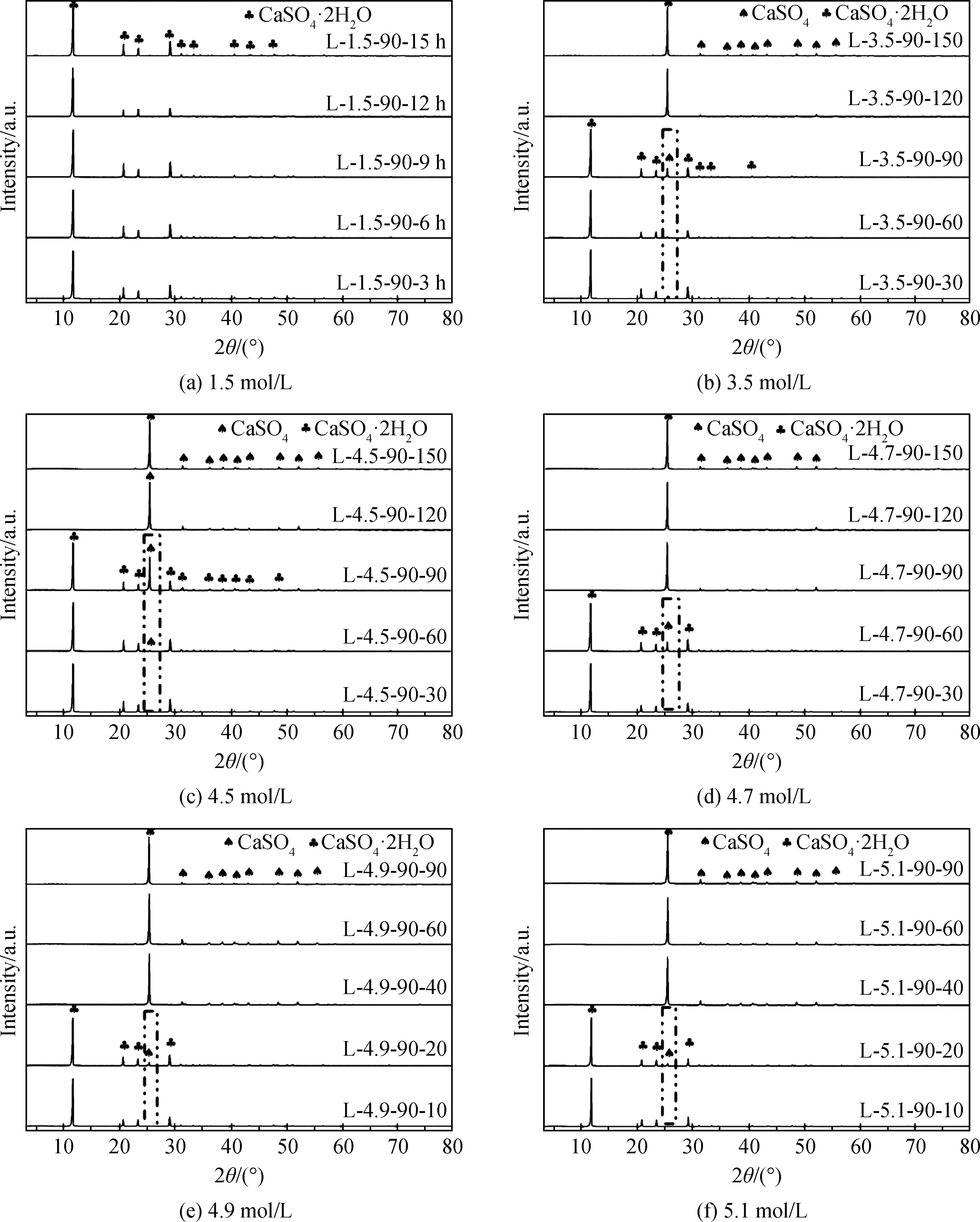
图7 不同硫酸浓度溶液中反应不同时间后样品的XRD谱Fig.7 XRD patterns of samples treated in solutions of different sulfuric acid concentrations for different reaction times
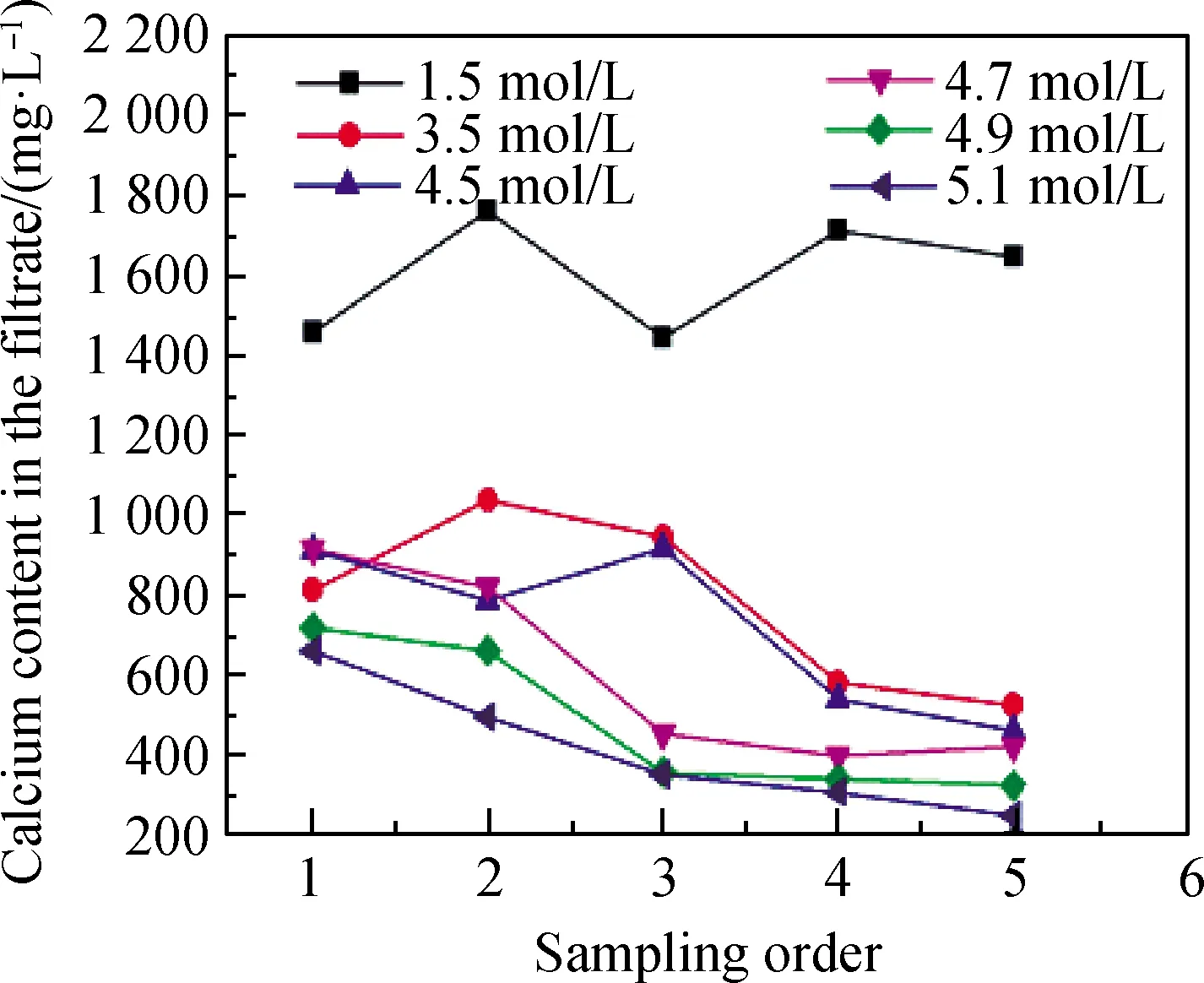
图8 石膏向硬石膏转化过程中钙离子浓度的变化Fig.8 Changes of calcium concentration during the conversion of gypsum to anhydrite
图8为钛石膏在不同硫酸浓度溶液中,90 ℃下反应不同时间时滤液中钙离子浓度变化的折线图。由图8可知,在硫酸浓度为1.5 mol/L的体系中,钙离子浓度较高,并在1 400~1 800 mg/L范围中波动,该体系中没有发生石膏向硬石膏的转化。在硫酸浓度为3.5 mol/L、4.5 mol/L、4.7 mol/L、4.9 mol/L和5.1 mol/L的体系中,随硫酸浓度的增加,钙离子浓度逐渐下降;在相同的硫酸浓度条件下,随反应时间的增加,钙离子浓度总体趋势表现为逐渐下降。
随硫酸浓度的增加,体系中钙离子的平均浓度总体呈下降趋势,与同离子效应相关。随硫酸浓度的增加,硫酸在溶液中电离出的硫酸根离子数量增加,进而抑制了石膏的溶解,根据难溶电解质溶度积公式,硫酸浓度越高使得体系中钙离子浓度越低。除硫酸浓度为1.5 mol/L的体系外,随反应时间的增加,溶液中钙离子浓度逐渐降低。当硫酸浓度为3.5 mol/L和4.5 mol/L时,第4次取样时钙离子浓度出现大幅度降低,对应于溶液中石膏完成了向硬石膏的转化;当硫酸浓度为 4.7 mol/L、4.9 mol/L和5.1 mol/L时,第3次取样时溶液中钙离子浓度明显降低,对应于溶液中石膏完全转化为硬石膏。在石膏完全转化为硬石膏后,随着反应继续进行,溶液中钙离子浓度变化不大。形成硬石膏后溶液中钙离子浓度明显降低,本质上是由硬石膏结晶生长获取溶液中钙离子和硬石膏的溶解度小所致。
2.5 石膏-硬石膏相变机理分析
在H2SO4-H2O体系中石膏转化为硬石膏的反应式[20]:
(1)
式中:KDH-AH为转化(脱水)反应的平衡常数;aw为水活度。
在固定温度和低于平衡值的水活度水平下,石膏脱水转化为硬石膏,直到水活度等于规定值[20]。根据Ostwald阶梯法则[21],石膏由于具有相对较高的溶解度而形成亚稳相,然后逐渐转变为溶解度较低的硬石膏。
由图3~图5和图7可知,在硫酸浓度为3.5~7.5 mol/L,温度在50~100 ℃时,石膏向硬石膏转化的过程中未出现烧石膏。Azimi等[20]认为石膏向硬石膏转化主要通过低温和高温两种不同的机理进行。在100 ℃以上,石膏可脱水形成半水合物,再脱水转化为硬石膏,转化过程中形成硬石膏核,然后通过溶解-沉淀的方式使硬石膏晶体长大;但在100 ℃以下,没有中间半水合物形成,石膏可直接脱水形成硬石膏核,然后通过石膏溶解和硬石膏的生长最后全部转化为硬石膏。
在钛石膏-H2SO4-H2O体系中,当石膏的活化能(与温度相关)达到一阈值时,石膏可脱水形成硬石膏核,然后通过石膏的溶解,钙离子释放到溶液中并沉淀于硬石膏晶核上使晶体长大。随溶液体系中硫酸浓度的增大,水活度降低,石膏脱水作用增强,转化为硬石膏的作用也增强。
3 结 论
(1)常压下,钛石膏在硫酸浓度为5.5 mol/L、6.5 mol/L、7.5 mol/L的H2SO4-H2O体系中,70 ℃下反应90 min可以使石膏完全转化为硬石膏。在硫酸浓度为1.5~7.5 mol/L范围内,以5.3 mol/L为临界点,浓度低于5.3 mol/L未发现物相转化的现象,浓度高于5.3 mol/L时石膏可完全转化为硬石膏。随着硫酸浓度的增加,石膏向硬石膏的转化速度加快。
(2)在温度为50~100 ℃条件下,随着温度的升高,会促进石膏转化生成硬石膏,在转化过程中未出现中间物相烧石膏;片状的石膏晶体在脱水转化为硬石膏过程中,晶体形貌也发生了变化。升温至70 ℃和80 ℃时,片状石膏晶体与长方板状硬石膏晶体共存。温度进一步升高至90 ℃和100 ℃时,晶体均为长方板状的硬石膏。
(3)不同浓度硫酸体系下,石膏完成向硬石膏转化所需的时间不同。硫酸浓度越高,完成石膏向硬石膏转化所需时间越少。当石膏-硬石膏转化完成后,其物相不会再随着时间的延长而变化。采用硫酸溶液体系实现石膏向硬石膏的转化,没有引入新的杂质组分,容易实现废水的回收利用。
