绵羊成纤维细胞OAR-L1高效转染方法的探索
2022-03-12吴飞吴杰陈学秋周静茹张惠黄艳时恒枝杨怡马光旭杜爱芳
吴飞,吴杰,陈学秋,周静茹,张惠,黄艳,时恒枝,杨怡,马光旭,杜爱芳
(浙江大学动物科学学院动物预防医学研究所,杭州 310058)
细胞系(cell line)通常指能够连续传代的细胞,其易于传代和编辑的特性使得其在生物学研究尤其是在探究癌症发生发展机制及治疗方案中具有重要的地位[1−2]。然而,广泛应用的绵羊细胞系仍十分匮乏[3],国内易获得的主要包括绵羊肺成纤维细胞(OAR−L1)和迪庆绵羊皮肤成纤维细胞(DQSHS1),前者是由中国科学院昆明细胞库于1990年从雌性绵羊的肺组织中建立的细胞系,呈纤维状,贴壁生长,2~3 d 以1∶3 的比例传代,生长迅速,连续传代后形态结构稳定,非常适合做细胞模型。目前,在基于绵羊细胞的研究中,仍主要依赖于原代细胞的分离培养,鲜有将现有绵羊细胞系应用于研究中的报道[4−5]。同时,对绵羊细胞系或原代细胞高效转染方法的探索也十分有限,缺乏可推广的普适性结论[6−10]。因此,寻找一种能够简单、便捷地对绵羊细胞进行稳定高效转染的方法十分重要。
真核细胞转染技术是研究细胞内基因及蛋白质功能的一种重要手段,普遍应用于细胞生物学、免疫学和病原学等众多学科的多个领域中,主要可分为物理学、化学和生物学方法[11−12]。每种方法都有其独特的优势和劣势,如电穿孔法、显微注射法、基因枪粒子轰击法和激光转染技术等物理学方法能够实现精准打靶,但这类方法不仅需要特定的高精度仪器和专业的培训,而且通常操作的细胞数量有限或受转染细胞死亡率过高[11,13−14]。因此,这类方法在基于反刍动物细胞研究过程中的应用有限。目前,应用最为广泛的仍是化学转染方法,其中最常用的是脂质体2000 转染试剂(LipofectamineTM2000 transfection reagent, Lipo 2000)、聚乙烯亚胺(polyethyleneimine,PEI)及其类似的产品,其在原代绵羊细胞中转染效果最好,但效率均未超过30%[4−5,15−16]。 另 外,成 纤 维 细 胞 转 染 试 剂 盒(CytofectTMfibroblast transfection kit,CF2)因具有显著提高原代成纤维细胞转染效率的能力[17],亦受到部分学者关注,但其是否能高效转染绵羊成纤维细胞系仍需要进一步探索。至于生物学方法,目前应用更多的仍是慢病毒,首先是因为这类病毒存在缺陷,在侵染了一代细胞后不会在受侵染的细胞中再次包装新的病毒;其次是这类方法在细胞转染效率上具有显著的优势[18−19],甚至能够有效侵染多种公认的难转染细胞系或原代细胞[13]。但这类方法在基于绵羊细胞的研究中,主要用于构建过表达或敲降细胞株,鲜有将之用作普通转染方法[20]的报道。
基于此,本研究拟使用PEI、Lipo 2000、CF2 和慢病毒侵染的方法,对OAR−L1细胞进行转染效果的比较,以寻找能够快捷、高效转染OAR−L1 细胞的方法,为后续基于绵羊细胞的研究奠定理论基础和提供技术支撑。
1 材料与方法
1.1 细胞、菌株和质粒
细胞(HEK 293T细胞)、菌株(大肠埃希菌感受态细胞TOP10)和质粒(pMD2.G、psPAX2 以及荧光质粒pLentiCMV−EGFP−Puro、pLentiCMV−mCherry−Puro)均由本实验室冻存,其中2种荧光质粒图谱如图1所示。

图1 荧光质粒图谱示意Fig.1 Schematic diagram of fluorescent plasmid maps
1.2 试验试剂
2×Taq主混合物购自上海近岸生物科技有限公司;限制性内切酶XbaⅠ、BamHⅠ和SalⅠ,购自宝生物工程(大连)有限公司;转染试剂聚乙烯亚胺(PEI,Linear)(分子量25 000)、脂质体2000 转染试剂(Lipo 2000)和成纤维细胞转染试剂盒(CF2)分别购自美国Polysciences、Thermo Fisher Scientific 和Cell Applications公司;达尔伯克氏改良伊格尔培养基(Dulbecco’s modified Eagle medium, DMEM)和Gibico 胎牛血清(fetal bovine serum,FBS)分别购自以色列Biological Industries 公司和美国Thermo Fisher Scientific 公司;预染彩虹蛋白标志物10~180 kDa、FDbio−Femto ECL 发光液、一步法凝胶制备试剂盒(12%)和辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗鼠IgG,购自杭州弗德生物科技有限公司;质粒提取试剂盒购自浙江易思得生物科技有限公司;绿色荧光蛋白(green fluorescent protein, GFP)抗体(小鼠单抗)、Western一抗稀释液和Western一抗二抗去除液购自上海碧云天生物技术有限公司;mCherry 抗体购自武汉三鹰生物技术有限公司。
1.3 引物及序列测定
质粒鉴定时所用的聚合酶链反应(polymerase chain reaction,PCR)引物为测序通用引物(CMV−F,5´−CGCAAATGGGCGGTAGGCGTG−3´;WPRE−R,5´−CATAGCGTAAAAGGAGCAACA−3´),由浙江尚亚生物技术有限公司提供,且测序亦由该公司完成。
1.4 荧光质粒表达鉴定
将实验室保存的荧光质粒pLentiCMV−EGFP−Puro、pLentiCMV−mCherry−Puro转化至感受态细胞TOP10 中并涂于氨苄抗性的溶菌肉汤(lysogeny broth,LB)平板上,次日挑取单克隆送往公司测序;用测序正确的菌液样品在氨苄抗性的LB平板上划线,次日挑取单克隆,于37 ℃条件下摇菌3 h后进行菌液PCR鉴定,将阳性样品接种至含5 mL氨苄抗性LB溶液的试管中扩繁,16~18 h后按说明书步骤进行质粒抽提;测定所提质粒的浓度并经双酶切鉴定,鉴定正确的质粒在6孔板中按照2 μg/孔的剂量转染HEK 293T细胞,后续结合荧光表达情况和蛋白质印迹法(Western blotting)结果对留存质粒进行鉴定。
1.5 PEI、Lipo 2000 及CF2 转染OAR-L1 细胞
鉴定成功的质粒,分别以PEI(1 mg/mL)、Lipo 2000和CF2为转染试剂,按不同的剂量转染在24孔板中以梯度密度铺板的OAR−L1 细胞(图2)。待满铺的OAR−L1 细胞消化后重悬于2 mL培养基中,计数后将1×104、2×104、4×104、8×104个细胞分别接种至24 孔板A、B、C 和D 行对应的孔中,转染时24 孔板的第1—6 列分别加入1、2、3、4、5、6 μL PEI、Lipo 2000 或CF2转染剂(图2C)。转染参照相应试剂的说明书进行,48 h后观察荧光表达情况。
1.6 慢病毒侵染OAR-L1 细胞
鉴定成功的质粒在6孔板中按照每孔1 μg荧光质粒、0.75 μg psPAX2、0.25 μg pMD2.G 的剂量共转染HEK 293T细胞,转染过程如图2B所示;随后收集表达荧光蛋白的细胞上清液,以800g离心5 min,并经0.45 μm的滤器过滤获得包装完成的病毒液;收集的慢病毒用于侵染以图2C 方式铺板的OAR−L1 细胞,侵染时24 孔板的第1—6 列每孔分别使用100、200、300、400、500、600 μL 病毒液,并补加100 μL 新鲜培养液,6 h后再补加250 μL培养液,24 h后换液,48 h后观察荧光并采用蛋白质印迹法验证(图2B)。
1.7 慢病毒保存条件和时间
包装完成后收集的病毒液共分为8 份,其中2份在收集后立即侵染OAR−L1细胞,其余6份分成2组分别储存在4 和-80 ℃条件下,并在第5、10、15天各自取出1 份侵染OAR−L1 细胞,每次侵染48 h后观察荧光表达情况。
1.8 慢病毒共侵染OAR-L1 细胞
本研究中共侵染以2种方式进行,一种是先包装再共同侵染,另一种是同时包装2种慢病毒质粒,获得混合的病毒液后再进行侵染。前者的病毒包装过程如图2B 所示,获得的2 种病毒液按照1∶1 的比例侵染OAR−L1细胞;后者的包装过程也相似,不同的是在转染时将1 μg 红色荧光质粒、1 μg 绿色荧光质粒与0.75 μg psPAX2 和0.25 μg pMD2.G 充分混合,后续过程与前面一致,48 h后观察荧光表达情况。

图2 转染、侵染流程和细胞铺板情况Fig.2 Protocols of transfection,infection and cell plating
1.9 融合其他外源蛋白的慢病毒共侵染OAR-L1细胞
pLentiCMV−EGFP−Puro 及pLentiCMV−mCherry−Puro 经XbaⅠ和BamHⅠ位点双酶切后连接入一段外源基因,构建能够表达特定蛋白的荧光质粒,再根据1.7节结果选择合适的共侵染方式进行共侵染试验,通过观察荧光表达情况和采用蛋白质印迹法验证结果。
1.10 统计与分析
通过ImageJ 1.52v软件统计转染后表达荧光的细胞数;利用t检验对不同转染方法的转染效率进行统计学分析,以P<0.05表示差异有统计学意义;采用GraphPad Prism 6绘制图形。
2 结果与分析
2.1 2 种荧光质粒的表达鉴定结果
用本实验室留存质粒(pLentiCMV−EGFP−Puro和pLentiCMV−mCherry−Puro)转染TOP10 后挑取单克隆,菌液PCR 鉴定结果显示,所有克隆均扩增出长约750 bp 的目的条带(图3A);BamHⅠ/SalⅠ双酶切结果可见长约750 bp 的目的条带(图3B)。分 别 将 鉴 定 正 确 的pLentiCMV−EGFP−Puro 和pLentiCMV−mCherry−Puro 质粒转染HEK 293T 细胞,结果(图3C)显示,HEK 293T 细胞分别成功表达绿色荧光蛋白和红色荧光蛋白,蛋白质印迹法结果中可见与理论大小一致的目的条带,进一步证明荧光蛋白在细胞中进行了表达。综上所述,本实验室留存的pLentiCMV−EGFP−Puro 和pLentiCMV−mCherry−Puro 质粒能够表达相应的荧光蛋白,且能在HEK 293T 细胞中高效表达,适用于后续的试验。
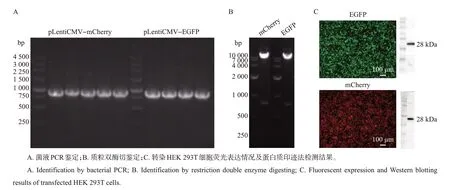
图3 荧光质粒鉴定结果Fig.3 Results of fluorescent plasmid identification
2.2 不同转染试剂转染OAR-L1细胞的效果比较
PEI、Lipo 2000 和CF2 转染OAR−L1 细胞的结果显示,3 种转染试剂对OAR−L1 细胞的转染效率均未超过30%,且CF2 最佳转染效率要显著低于PEI 和Lipo 2000(图4)。同时,根据转染后不同组荧光细胞数目可知,3 种转染试剂对细胞密度和试剂使用量都有比较严格的要求,当转染条件为2 μL CF2 或3 μL Lipo 2000 且铺板细胞量为2×104个时,或1 μL PEI 在铺板细胞量为4×104个时才能达到各自最佳转染效果(图4)。
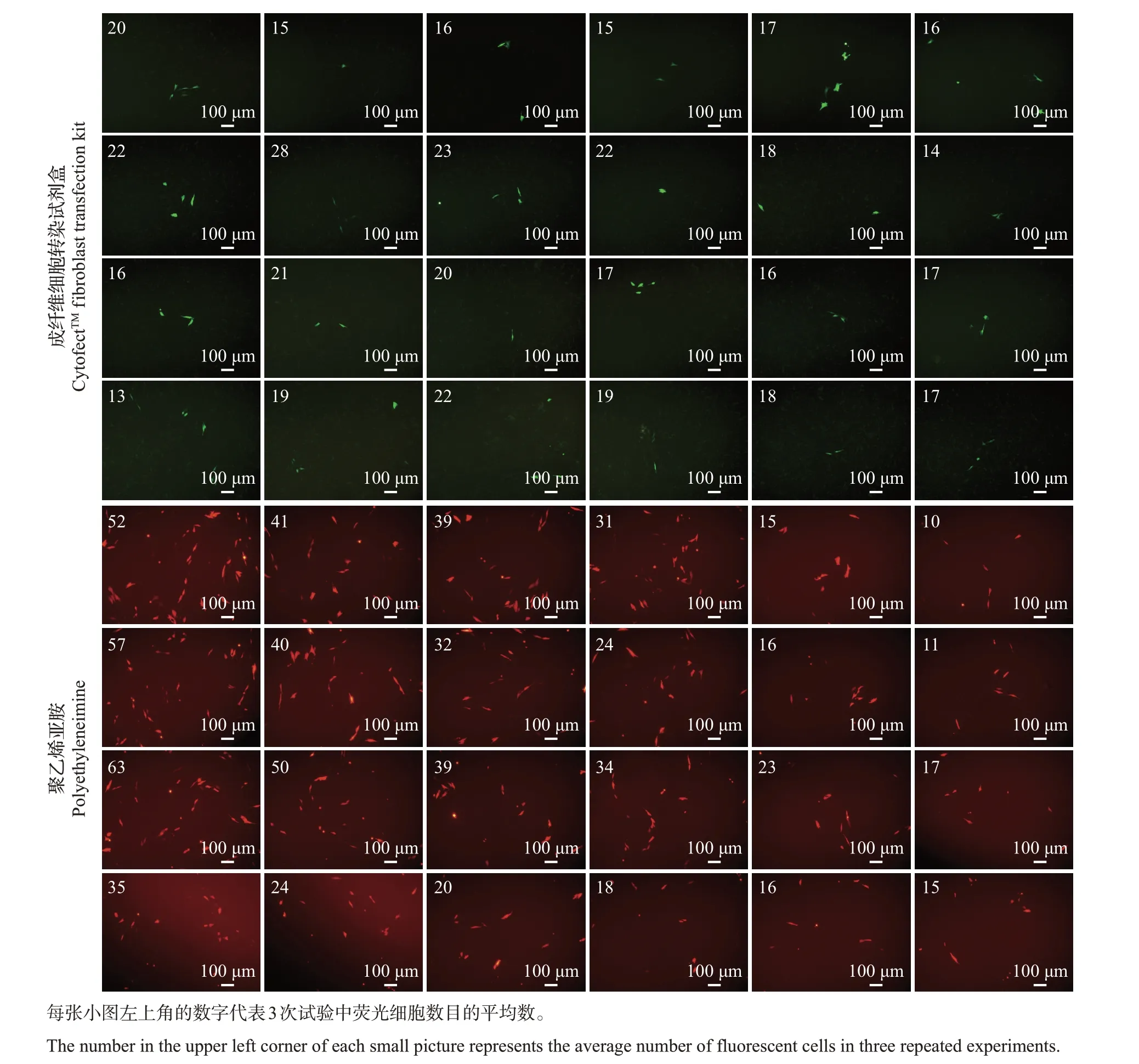
图4 3种试剂转染OAR-L1细胞的效果Fig.4 Effects of three different reagents transfecting OAR-L1 cells

2.3 慢病毒侵染OAR-L1 细胞的效果
由图5 可见,慢病毒侵染能够在OAR−L1 细胞中高效表达异源蛋白,且其侵染效率与细胞铺板密度和病毒液用量没有明显的相关性。但该种方法得到的表达效率要显著高于PEI、Lipo 2000、CF2组最佳转染效率(图6)。

图5 慢病毒侵染OAR-L1细胞的效果Fig.5 Effects of lentivirus infecting OAR-L1 cells

图6 不同转染试剂最佳转染效率下的荧光细胞数目Fig.6 Numbers of fluorescent cells under the best transfection efficiencies of different regents
2.4 储存条件和时间对慢病毒侵染效果的影响
在4 或-80 ℃分别存储5、10、15 d 后,慢病毒侵染OAR−L1 细胞的效果如图7 所示。从中可知,慢病毒在4 或-80 ℃条件下保存15 d 内并不会对侵染效率产生明显影响。因此,收集的慢病毒在4或-80 ℃条件下均能保存较长时间。
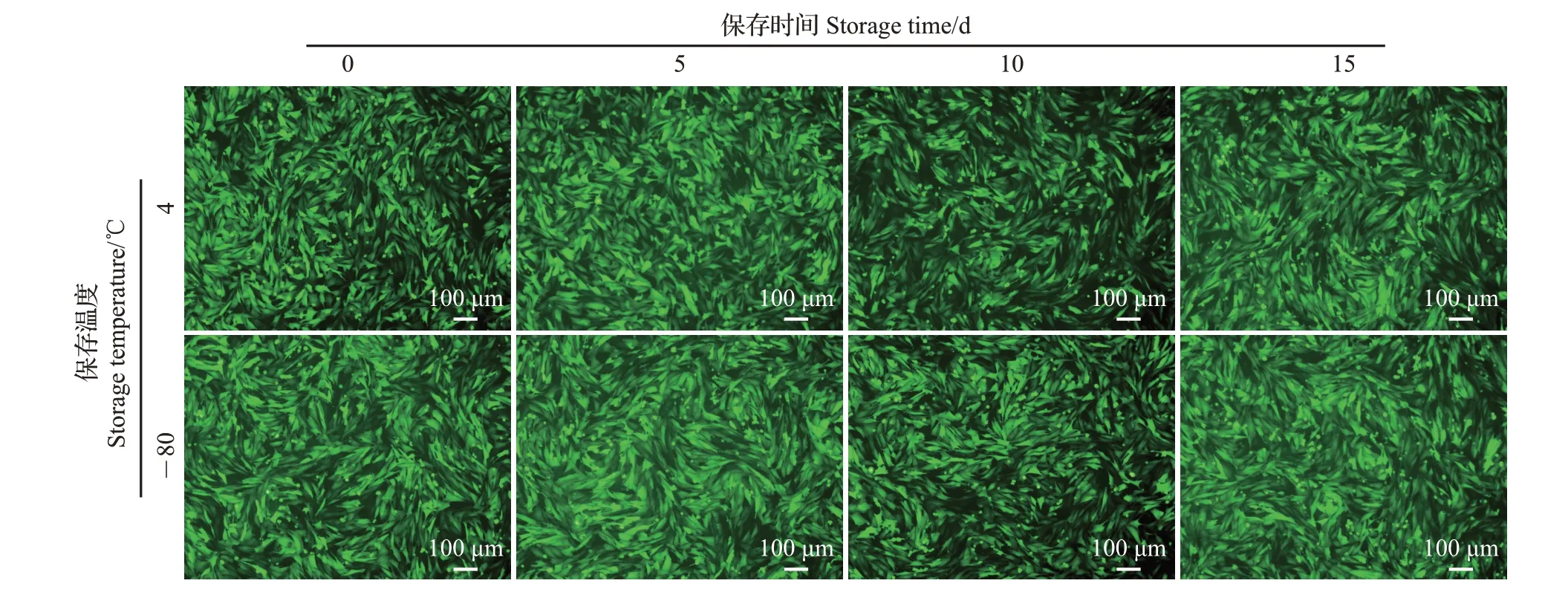
图7 不同保存条件和时间对慢病毒侵染OAR-L1细胞效果的影响Fig.7 Effects of different storage conditions and time on the infection efficiencies of OAR-L1 cells by lentivirus
2.5 不同方式包装慢病毒共侵染OAR−L1的结果
2种慢病毒包装方式共侵染OAR−L1细胞的结果显示,2 种方法都能实现在OAR−L1 细胞中同时表达2 种外源蛋白,但分开包装病毒再共同侵染的方式共表达效率更高(图8)。
2.6 融合其他外源蛋白对慢病毒共侵染OAR-L1细胞的影响
2种荧光质粒连接外源基因后,在HEK 293T细胞中包装相应的慢病毒,再共侵染OAR−L1 细胞,结果显示,OAR−L1 细胞表达的融合外源基因的荧光蛋白强度要明显低于空载荧光蛋白的强度,且前者荧光共定位的比例也明显较后者低,但其本身的共定位比例并不低(图8~9)。

图8 2种包装方式对慢病毒共转染OAR-L1细胞的影响Fig.8 Effects of two packaging methods on co-transfection of OAR-L1 cells by lentivirus
3 讨论
本研究通过比较不同的转染试剂对OAR−L1细胞的转染/侵染效果发现,PEI 介导的细胞转染效率虽然要比Lipo 2000稍高,但PEI的细胞毒性也更大,这与曹慧玲等[15]的研究结果相符。但这2 种目前公认的转染效率较高的转染试剂对受转染细胞应该具有选择性,因为它们对OAR−L1细胞的转染效率都不超过30%,与其他类似的研究结果[4−5,6−10,16]相当;CF2 转染OAR−L1 时也同样没有取得理想的效果,可能是因为这种试剂中含有的能够提高原代细胞转染效率的成分会抑制细胞系的转染效率。值得关注的是,在本试验中,虽然慢病毒包装和侵染过程较其他转染方式用时更长,但结合上述结果可知,慢病毒侵染的方式能够实现高效表达外源荧光蛋白的目的,与在其他细胞系中获得的研究结果[21−23]一致,较本研究中其他转染方法而言是一种更理想的OAR−L1 细胞转染方式。当使用pLentiCMV−EGFP−Puro 和pLentiCMV−mCherry−Puro荧光质粒时,侵染效率超过90%,然而,这2 种质粒融合目的基因后侵染效率会有所降低,后续的试验还发现这种影响与所融合的基因相关,即是否能够取得理想的侵染效果,可能在一定程度上也依赖于所插入的目的基因。
虽然使用慢病毒侵染的方式能够高效地表达外源基因,但收获的病毒液如何保存及有效期的问题值得重视。一般来说,包装的慢病毒常通过4、-80 ℃冰箱或添加其他冻存剂等方式保存[20,24]。基于此,本试验探究了在4和-80 ℃条件下保存不同时间后,病毒液侵染OAR−L1细胞效率的变化。结果显示,无论是在4 ℃还是在-80 ℃保存条件下,15 d内病毒液的侵染效率不会受到影响,因此,可提前包装收集足够的病毒液冻存后使用。另外,随着科学研究日益深入,单个基因的转染越来越难以满足科研需求,因此,本研究还探索了利用慢病毒侵染的方式在OAR−L1 细胞中实现共转染的条件。结果表明,分别包装后再共同侵染OAR−L1细胞能够获得更高的共转率,这种方法在融合目的基因后依然有效,这使得在OAR−L1细胞中研究基因与基因间的相互作用成为可能。
虽然,目前已证实慢病毒在细胞转染效率和保存方面具有优势,但限于细胞系和毒株等试验材料的缺乏,本研究并未就其本身是否影响细胞的各项机能、是否参与其他胞内病原体涉及的信号通路以及是否适用于这些病原体的研究进行深入的探索。另外,近年来转录后修饰相关研究越来越热,通常的单个基因转染或2个基因共转并不能满足这类研究的需求,如泛素化研究需要至少同时向细胞内导入3个基因(靶基因、泛素化连接酶和泛素)[25−26],本试验尚未找到很好的方法去验证慢病毒侵染能否满足这类需求,因为这可能需要表达第3种甚至更多种荧光蛋白,后续可以进行更为深入的探索。

图9 融合其他外源蛋白对慢病毒侵染OAR-L1细胞的影响Fig.9 Effects of fusing with other exogenous proteins on the infection of OAR-L1 cells by lentivirus
4 结论
本研究通过比较PEI、Lipo 2000、CF2以及慢病毒介导的4种转染方法在OAR−L1细胞中的转染效果,确定慢病毒侵染的方式比其他3 种方法更高效地在该细胞内表达了外源蛋白。此外,分开包装再共同侵染的方式能获得更高的共转率,而插入的目的基因会降低共转效率且这种降低程度与插入基因自身特性相关联。综上所述,慢病毒介导的转染方法能够在难转染细胞中实现较高的转染效率,为后续基于OAR−L1 细胞对绵羊甚至其他反刍动物展开相关研究奠定基础,同时,也能够为探索其他难转染细胞的转染方法提供参考。
