乌骨鸡活性肽对糖尿病小鼠血液生化指标和组织病理学的影响
2022-03-12葛莹张雷王欢欢楼立峰李庆海黄沁章学东
葛莹,张雷,王欢欢,楼立峰,李庆海,黄沁,章学东
(杭州市农业科学研究院,杭州 310024)
糖尿病一直是人类健康的巨大威胁,据世界卫生组织预测,全球范围内的糖尿病患者数量将在2030 年达6.43 亿(https://diabetesatlas.org)。作为一种慢性代谢性疾病,糖尿病患者主要表现为体内胰岛素分泌不足或胰岛素抵抗而引起的高血糖症[1]。当血糖浓度长时间过高时,患者会出现一系列并发症,比如心血管疾病、眼部病变和肾功能衰竭等。目前,治疗糖尿病的药物主要有胰岛素类、胰岛素增敏剂、磺酰脲类、双胍类、α−葡萄糖苷酶抑制剂类[2],其中,以α−葡萄糖苷酶抑制剂为代表的口服降糖药在临床上应用广泛,如阿卡波糖、米格列醇、伏格列波糖等[3]。但是,长期服用这些化学合成药物势必会对人体造成一定的毒副作用,所以学者们不断尝试挖掘动植物来源的、具有降血糖功能的天然生物活性物质。已有的研究发现,“苦瓜多肽”“海洋胶原肽”对糖尿病具有一定预防和治疗作用[4−5]。
乌骨鸡是我国历史上传统的药食两用保健型鸡种。据《本草纲目》记载,乌骨鸡具有“补虚劳羸弱,治消渴中恶”的作用,而中医所称消渴症范畴涵盖糖尿病[6]。现代科学研究表明,乌骨鸡的功能活性成分除了黑色素,还包括氨基酸、脂肪酸和肌肽小肽、多肽等生物活性肽。活性肽作为对机体功能或状态有益的特定氨基酸片段,需经蛋白质酶解得到,具有分子量小、易吸收的特点[7−9]。目前,乌骨鸡活性肽在补气血、抗氧化、抗衰老、降血压、免疫调节等方面均有科学报道,但缺乏抗糖尿病方面的研究。因此,本试验旨在制备乌骨鸡活性肽并分析其对糖尿病模型小鼠的体质量、血液生化指标和组织器官的影响,并探讨乌骨鸡活性肽在体内发挥抗糖尿病作用的效果和途径,从而为特色保健食品的开发提供理论参考。
1 材料与方法
1.1 试验材料
试验用乌骨鸡来自杭州市农业科学研究院自行培育的BG系乌骨鸡群体,选择150日龄的乌骨鸡若干只,屠宰后迅速分离两侧胸肌,置于-20 ℃冰箱中冻存,备用;雄性ICR 小鼠(清洁级,5 周龄,体质量20~22 g)购自浙江省医学科学院实验动物中心,饲养于试验小鼠笼内,室内温度(20±2)℃、相对湿度50%~60%、12 h/12 h明暗循环,保证专用饲料和清洁饮水的供应,适应性饲养期1 周。所有动物试验操作均符合《实验动物管理条例》要求。
1.2 试剂及溶液配制
链脲佐菌素(streptozotocin,STZ)、阿卡波糖(德国Sigma 公司),木瓜蛋白酶(2 000 U/mg)、风味蛋白酶(40 U/mg)、柠檬酸、柠檬酸三钠、氯化钠等分析纯[生工生物工程(上海)股份有限公司],4%组织细胞固定液(北京索莱宝科技有限公司),胰岛素(insulin, INS)、超 氧 化 物 歧 化 酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)测试盒(南京建成生物工程研究所有限公司)。
柠檬酸钠缓冲液配制:将2.1 g柠檬酸、2.94 g柠檬酸三钠分别溶于100 mL ddH2O,再将这2 种溶液按体积比1∶1.32 混合,pH 调至4.2~4.5,制成0.1 mol/L柠檬酸钠缓冲液。
注射液配制:将STZ溶于0.1 mol/L柠檬酸钠缓冲液中,制成10 mg/mL 质量浓度的注射液,经0.22 μm滤膜过滤后即刻使用。
1.3 仪器设备
电子天平(瑞士Mettler Toledo公司);台式低温高速离心机(德国Eppendorf公司);SHP−110X型恒温水浴锅(江苏省常州亿通分析仪器制造有限公司);抽滤装置(天津市津腾实验设备公司);真空冷冻干燥机(美国Labconko公司);血糖仪和血糖试纸(美国Roche公司);Infinite M200 Pro多功能酶标仪(瑞士Tecan 公司);Chemray800 型全自动生化分析仪(广东省深圳雷杜生命科技股份有限公司);DM2500 型徕卡显微系统(德国Leica 公司);Pelliconn®3盒式超滤膜包、Congent®μScale切向流超滤系统、超纯水机(美国Millipore公司)。
1.4 试验方法
1.4.1 乌骨鸡活性肽制备
称取适量乌骨鸡肌肉,绞碎成肉泥,以质量体积比1∶5 加水制成悬浊液,然后将木瓜蛋白酶和风味蛋白酶均以质量体积比3∶1 000加入到悬浊液中混匀,pH 7.0,55 ℃酶解3 h,95 ℃灭酶30 min,以1.2×104r/min 离心10 min,收集上清液,经0.45 μm微孔滤膜过滤得到粗酶液,依次通过截留分子量为30 kDa 的超滤膜(操作压力1.03×105Pa,流速180 mL/min)、5 kDa的超滤膜(操作压力1.38×105Pa,流速120 mL/min),得到乌骨鸡活性肽溶液,将其真空冷冻干燥成粉末,于-20 ℃条件下保存。
1.4.2 糖尿病模型小鼠构建
ICR 小鼠(6 周龄)隔夜禁食16 h 后,按照120 mg/kg STZ剂量进行腹腔注射来诱导糖尿病。注射7 d 后断尾取血,当空腹血糖值≥11.1 mmol/L 则视为糖尿病小鼠[10]。
1.4.3 试验分组
将糖尿病小鼠随机分成4 个处理组,每组各10只小鼠,分别灌服100 mg/kg乌骨鸡活性肽(低剂量组)、400 mg/kg乌骨鸡活性肽(高剂量组)、30 mg/kg阿卡波糖(药物组)、生理盐水(阳性对照组)[11]。另设正常对照组小鼠,灌服生理盐水,每日定时灌胃,给药体积均为0.2 mL,持续30 d(7~12周龄)。
1.4.4 采样
分别测定试验起始、终末的小鼠体质量和空腹血糖值。终末时,采集小鼠眼眶静脉窦血,于4 ℃条件下将血液静置24 h,以3 000 r/min 离心15 min,分离出血清,将其保存于-80 ℃冰箱中。采用脱颈法处死小鼠并采集胰腺、肝、肾组织,对肝、肾称量用以计算器官指数:器官指数=器官质量/mg÷活体质量/g。之后将肝、肾、胰腺组织样本固定于4%多聚甲醛中。
1.4.5 血液生化指标测定
使用全自动生化分析仪分别检测血清甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL−C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL−C)含量。参照SOD、MDA、INS测试盒说明书要求,利用酶标仪测定各吸光度值,并根据相关公式分别计算得到血清SOD活性以及MDA、INS含量。
1.4.6 组织病理学观测
取固定后的肝、肾、胰腺组织样本进行石蜡包埋。按组织横断面进行切片,然后用二甲苯脱蜡,再逐级经过100%乙醇及梯度乙醇直至蒸馏水进行水化,最后用苏木精−伊红(hematoxylin−eosin,HE)染色,梯度乙醇−二甲苯脱水至透明,封片镜检。样本切片经显微镜拍照后,使用Image-Pro Plus 软件(美国Media Cybernetics公司)分析并计算胰腺组织中的胰岛面积,设定正常对照组的胰岛面积为1。
1.5 数据分析
采用Excel 2016对试验数据进行初步整理。使用SPSS 22.0 软件对数据进行统计分析,结果以平均值±标准差表示,组间差异显著性采用Tukey 检验,以P<0.05表示差异有统计学意义。
2 结果与分析
2.1 乌骨鸡活性肽对小鼠体质量和空腹血糖的影响
由表1 可知:灌胃起始,与正常对照组相比,低剂量组、高剂量组、药物组、阳性对照组的体质量均下降,空腹血糖水平均显著升高(P<0.05),表明STZ 诱导的糖尿病小鼠呈现体质量减轻、血糖升高的症状;并且,由于糖尿病引发了死亡,低剂量组和阳性对照组小鼠的终末数量减少。比较同一组别中的起始与终末发现:阳性对照组的体质量显著降低(P=0.043),而低剂量组、高剂量组、药物组以及正常对照组的体质量分别增加了2.8%、6.2%、6.2%、4.7%;阳性和正常对照组的空腹血糖水平基本保持不变,而低剂量组、高剂量组、药物组的空腹血糖水平分别显著下降了29.3%(P=0.014)、40.5%(P=0.001)、32.6%(P=0.005),说明乌骨鸡活性肽对糖尿病小鼠的体质量和血糖水平具有一定的调节作用。同时,高剂量组的效果与阿卡波糖药物组相似且均优于低剂量组。

表1 各组小鼠的起始、终末体质量和空腹血糖水平Table 1 Initial,final body mass and fasting blood glucose level of mice in each group
2.2 乌骨鸡活性肽对小鼠血脂指标的影响
TG和TC水平是脂质平衡的重要指标。由表2可知:与正常对照组相比,低剂量组、高剂量组、药物组和阳性对照组的血清TG、TC、LDL−C 水平较高(其中,阳性对照组P=0.001、P=0.001 和P=0.002),表明糖尿病小鼠血脂代谢异常。与阳性对照组相比,低剂量组、高剂量组和药物组的TG、TC、LDL−C水平下降,HDL−C水平升高,其中,药物组的TG、TC下降显著(P=0.020、P=0.007);高剂量组的TC、LDL−C 下降显著(P=0.013、P=0.038)且HDL−C 升高显著(P=0.003),表明灌服的400 mg/kg 乌骨鸡活性肽和阿卡波糖都具有一定的降高血脂作用。

表2 各组小鼠的血脂指标Table 2 Indexes of blood lipids of mice in each group mmol/L
2.3 乌骨鸡活性肽对小鼠血清抗氧化指标的影响
SOD活性和MDA含量是反映机体自由基代谢的重要指标。由表3可知:与正常对照组相比,低剂量组、高剂量组、药物组和阳性对照组的SOD 活性降低且MDA 含量升高(其中,阳性对照组P=0.021),表明糖尿病小鼠清除体内自由基的能力降低且存在脂质过氧化。与阳性对照组相比,低剂量组、高剂量组和药物组的SOD 活性显著提高(P=0.047、P=0.016和P=0.034)且MDA含量降低(其中,高剂量组P=0.027),说明灌服的400 mg/kg 乌骨鸡活性肽具有较好的抗氧化和清除自由基能力。

表3 各组小鼠的血清抗氧化指标Table 3 Serum antioxidant indexes of mice in each group
2.4 乌骨鸡活性肽对小鼠胰腺组织以及血清胰岛素的影响
正常生理状态下的胰岛器官呈边界清晰的球形细胞团,胰岛细胞大小均一,细胞核呈蓝紫色,核仁明显,细胞质丰富。相较于正常对照组,阳性对照组的胰岛形态不规则,多数细胞核大小不一且胰岛面积显著减少(P=0.002),表明其胰岛β细胞的病理损伤较严重。低剂量组、高剂量组和药物组的胰岛形态和面积则与正常对照组无显著差异(图1A~F)。同时,血清胰岛素测定结果显示,低剂量组、高剂量组、药物组和正常对照组之间无显著差异,但均显著高于阳性对照组(P=0.002、P=0.001、P=0.003 和P=0.000)(图1G),表明灌服乌骨鸡活性肽和阿卡波糖有可能修复糖尿病小鼠胰腺损伤并恢复其胰岛素水平。
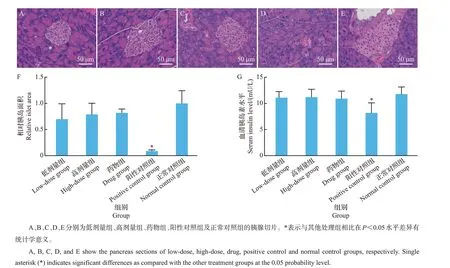
图1 乌骨鸡活性肽对糖尿病小鼠胰腺的影响Fig.1 Effects of the bioactive peptides from black-bone chicken on pancreas of diabetic mice
2.5 乌骨鸡活性肽对小鼠肝脏的影响
由图2 可知:正常对照组小鼠的肝细胞以中央静脉为中心向四周呈辐射状规则排列,而阳性对照组的小鼠肝细胞肿胀、条索状结构消失,存在空泡和纤维化,肝指数显著升高(P=0.013)。低剂量组、高剂量组和药物组的肝指数虽高于正常对照组,但低于阳性对照组;低剂量组、高剂量组和药物组的肝细胞结构较为清晰,空泡和纤维化较少,表明乌骨鸡活性肽和阿卡波糖对糖尿病小鼠肝脏具有保护作用。

图2 乌骨鸡活性肽对糖尿病小鼠肝脏的影响Fig.2 Effects of the bioactive peptides from black-bone chicken on the liver of diabetic mice
2.6 乌骨鸡活性肽对小鼠肾脏的影响
由图3可知:正常对照组小鼠的肾小球大小、形态正常,边界清楚,而阳性对照组的肾小球肿大,肾小管扩张,上皮细胞空泡化,且间质淋巴细胞浸润,病理变化较明显,造成肾指数显著高于低剂量组、高剂量组、药物组和正常对照组(P=0.028、P=0.012、P=0.003 和P=0.000)。低剂量组、高剂量组以及药物组的肾小球较肿大,存在淋巴细胞浸润,但肾小管空泡化程度明显轻于阳性对照组,肾指数与正常对照组相比无显著差异,特别是高剂量组和药物组表现更好,说明乌骨鸡活性肽在一定程度上能缓解糖尿病小鼠的肾脏病变。
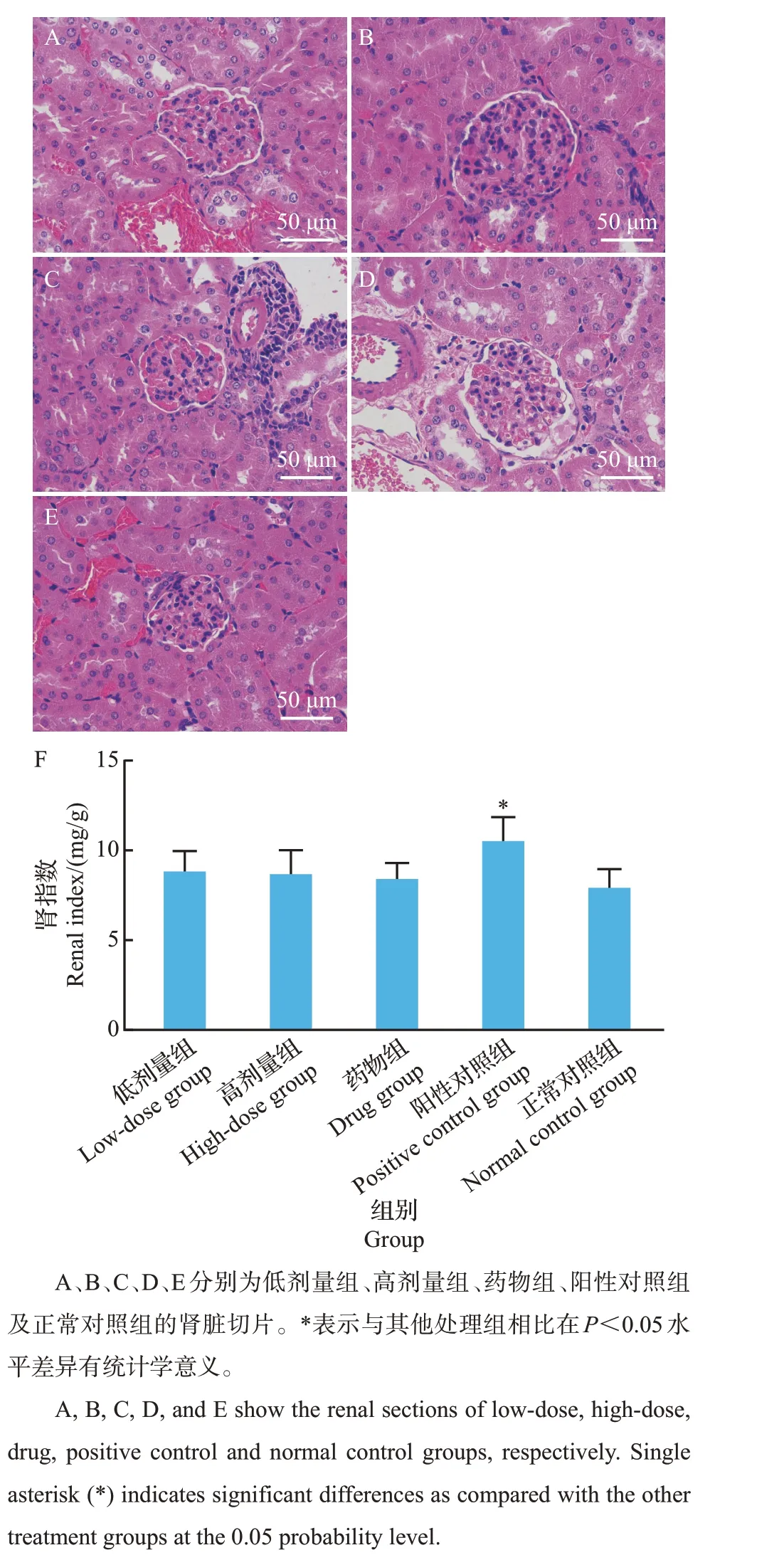
图3 乌骨鸡活性肽对糖尿病小鼠肾脏的影响Fig.3 Effects of the bioactive peptides from black-bone chicken on the kidney of diabetic mice
3 讨论
STZ 是一种氨基葡萄糖−亚硝基脲化合物,结构类似于葡萄糖,进入体内后被葡萄糖转运蛋白(glucose transporter 2,GLUT2)转运至胰腺组织,破坏β细胞以致胰岛素分泌下降,从而诱发高血糖和“三多一少”,即多饮、多食、多尿和体质量减轻等糖尿病症状[12]。本研究显示,通过单剂量注射120 mg/kg STZ构建的糖尿病模型小鼠,除表现这些典型临床症状外,其胰腺细胞呈明显病理形态,胰岛面积减小且血清胰岛素含量显著降低。阿卡波糖是目前治疗2型糖尿病的首选药物,也可用于联合治疗1型糖尿病。有研究报道称阿卡波糖能够降低血糖深度并且提升胰岛素水平,还有利于调节血脂,包括降低TG水平、改善HDL−C[13−15]。本研究发现,灌胃30 d 后,低、高剂量乌骨鸡活性肽均能使糖尿病小鼠的空腹血糖水平有效降低,胰岛素水平接近正常,体质量恢复增加,特别是400 mg/kg高剂量乌骨鸡活性肽的降糖效果与阿卡波糖相当。同时,结合组织切片可以看出,降血糖效果应与胰腺组织的损伤得到缓解、胰腺分泌胰岛素的功能得到修复密切相关。
高脂血症作为糖尿病的常见并发症,是由血糖异常继而诱发脂质代谢紊乱引起的,患者的血脂指标TG、TC 和LDL−C 多数高于正常水平,还伴有HDL−C 水平降低[16]。降低血脂水平有利于改善糖尿病,从而减少心血管疾病等并发症发生的风险[17]。本研究发现,400 mg/kg乌骨鸡活性肽和阿卡波糖都能使糖尿病小鼠的TC、LDL−C 水平显著降低,HDL−C 水平显著升高,血脂趋向正常。同时,肝脏作为体内葡萄糖和脂质代谢的重要器官,其健康状况与血脂指标直接相关。从本研究的组织切片可知,糖尿病小鼠肝细胞肿胀,索状结构消失,炎性细胞浸润,导致肝指数显著升高,而服用一段时间的乌骨鸡活性肽后,糖尿病小鼠的肝结构趋向清晰,小叶空泡等病变情况明显减少。
最近的研究指出,氧化应激反应是糖尿病众多并发症的重要原因,其产生的大量活性氧会导致细胞及组织损伤[18]。林霖等[19]、LIU等[20]进行的体外抗氧化实验发现,乌骨鸡活性肽具有清除多种自由基的能力。田颖刚等[21]在顺铂所致的小鼠肾损伤试验中发现,乌骨鸡活性肽明显改善了抗肿瘤药物顺铂导致的肾小管坏死,肾组织中抗氧化SOD活性增强而脂质过氧化MDA 含量下降。本研究中,糖尿病模型小鼠的SOD活性显著降低且MDA含量显著升高,而灌服乌骨鸡活性肽后,小鼠SOD 活性显著回升,MDA 含量显著下降;肾组织切片显示,肾小球肿大、肾小管扩张和空泡化等病变现象显著减少,说明乌骨鸡活性肽确有较强的抗氧化活性,能够修复糖尿病带来的各种组织器官损伤。
虽然本研究制备的乌骨鸡活性肽分子量已经小于5 kDa,但仍包含大量不同的肽段成分。例如:已有研究发现,乌骨鸡比白肤鸡富含更多的肌肽二肽[22],而肌肽被证实对STZ糖尿病小鼠的血糖、体质量以及胰腺组织会产生有益影响[23];LIU 等通过纯化乌骨鸡活性肽得到一种五肽,具有比肌肽更强的抗氧化活性[20]。因此,有必要进一步开展功能性肽段的分离与鉴定研究,以明确乌骨鸡活性肽发挥抗糖尿病作用的主效成分。
4 结论
通过对糖尿病小鼠连续灌服30 d 乌骨鸡活性肽(分子量小于5 kDa)发现,糖尿病小鼠的体质量增加、空腹血糖水平下降,这充分证实了乌骨鸡活性肽具有一定的抗糖尿病作用,同时还观察到糖尿病小鼠的血脂下降、血清抗氧化水平升高以及胰腺、肝、肾组织形态得到改善及其器官指数降低,说明乌骨鸡活性肽具有保护机体器官组织的功能。另外,对比发现400 mg/kg 剂量的乌骨鸡活性肽效果优于100 mg/kg 剂量。综上所述,乌骨鸡体内富含的活性肽具有降血糖、降血脂、保护器官组织等多重生物保健功能,具有广阔的开发应用前景。
