典型设施菜地中土壤微生物代谢功能多样性
2022-03-11苑学霞杨贵华王文博孙晨曦邬元娟方丽萍
苑学霞,张 勇,杨贵华,王文博,孙晨曦,邬元娟,方丽萍
·农业生物环境与能源工程·
典型设施菜地中土壤微生物代谢功能多样性
苑学霞1,张 勇2,杨贵华3,王文博1,孙晨曦1,邬元娟1,方丽萍1
(1. 山东省农业科学院农业质量标准与检测技术研究所/山东省食品质量与安全检测技术重点实验室,济南 250100;2. 山东省国土空间规划院,济南 250014;3. 济南市农业技术推广服务中心,济南 250099)
土壤微生物代谢功能多样性是维持土壤生态系统健康的关键。为评价设施蔬菜种植对土壤微生物代谢功能多样性的影响,该研究采用Biolog-Eco微平板法,研究2个典型设施蔬菜种植市、不同种植年限设施菜地中土壤微生物代谢功能多样性;采用相关分析和冗余分析分别研究了与碳源利用相关的细菌群落及影响因子。结果表明:两地设施菜地土壤中平均颜色变化率(Average Well Color Development,AWCD)、Shannon指数、Simpson指数和McIntosh指数随着种植年限的增加而降低,但安丘种植14 a和寿光种植10 a菜地土壤不符合此规律。两地间土壤微生物对碳源利用的差异大于种植年限导致的差异。在安丘土壤中,16种碳源(分属糖类、氨基酸类、羧酸类、聚合物类、酚类和胺类)与不同门细菌显著相关(<0.05);是与碳源相关种类最多的细菌,与9种碳源显著相关(<0.05)。在寿光土壤中,11种碳源(分属糖类、氨基酸类、羧酸类和聚合物类)与不同门细菌显著相关(<0.05);是与碳源相关种类最多的细菌,与4种碳源显著相关(<0.05)。在安丘土壤中,Cd对土壤微生物碳源利用有显著负作用(<0.01),是影响土壤微生物碳源利用的最强环境因子,有机质(Organic Matter,OM)对土壤微生物碳源利用有显著正作用(<0.01)。在寿光土壤中,Zn、OM、Cd对土壤微生物碳源利用有显著负作用(<0.05),As、pH值对土壤微生物碳源利用有显著正作用(<0.05)。综上,两地之间土壤微生物代谢功能多样性、与之相关的细菌群落及影响因子均有差异,因此,不同地区应因地制宜,采取不同耕作措施以改善土壤微生态环境,保障设施菜地土壤健康。
土壤;微生物;设施菜地;栽培年限;Biolog-Eco
0 引 言
设施蔬菜种植因其突破了气候对蔬菜生长的限制、高产出、高收益等优势,成为蔬菜种植体系中极为重要的一部分。中国设施蔬菜产业发展迅猛,其栽培面积已达386万hm2 [1]。设施蔬菜长期种植经常引起土壤质量的变化,其主要原因包括以下两个方面:一是由于设施菜地内封闭性、可控性、缺少雨水淋洗、复种指数高等因素,其土壤环境与露地土壤环境显著不同[2-3];二是设施蔬菜栽培过程中化学品的大量施用和土地利用强度增加导致的土壤质量问题,具体包括:大量的化肥施用导致的土壤酸化、次生盐渍化及营养元素失衡[4-5],畜禽粪便、农膜、农药等农业投入品施用导致的污染物(重金属、抗生素、有机氯农药、邻苯二甲酸酯等[6])增加。
土壤微生物多样性和功能的时空演变规律及其驱动机制是近年来土壤微生物学主要研究方向之一[7]。土壤微生物是土壤生态系统的重要组成部分,其通过调节碳、氮、磷、硫等元素水平,直接或间接地促进养分循环和肥力维持[8],在维护陆地生态系统健康方面发挥着重要作用。土壤微生物多样性通过提高土壤微生物功能而促进作物生长[9],维持土壤的可持续利用。由于对环境因素和土壤养分状况高度敏感,土壤微生物多样性被广泛用作土壤健康的重要评价指标[10-11]。土壤微生物对不同碳源代谢功能多样性是土壤微生物多样性变化的重要表征[12]。Biolog-Eco微平板因其灵敏度高、分辨力强、最大限度保留微生物群落原有的代谢特征等特点,而被广泛应用于表征农田[12]、园地[13]、森林[14]、草地[15]、湿地[16]生态系统中土壤微生物代谢功能多样性变化。不同的耕作方式和种植年限均会影响土壤微生物代谢功能多样性。贾鹏丽等[17]发现玉米地中土壤微生物的Shannon指数、McIntosh指数、Simpson指数均高于水稻、土豆、大豆地。顾美英等[18]对Biolog碳代谢功能进行分析,发现随着核桃定植年限的增加,土壤中细菌活性和Shannon指数先升高后降低,在10~15 a达到最高。
关于设施菜地种植对土壤微生物影响的研究发现,设施黄瓜连作显著影响土壤细菌群落结构[19]。对安徽地区设施菜地进行研究,发现不同种植年限(3、5、7、10 a)显著影响土壤中细菌多样性、丰富度和群落组成[20]。设施菜地中土壤微生物群落变化主要源于栽培过程中土壤理化性质、重金属等的变化。土壤中大多数细菌与As、Cd、Cr、Ni和Pb呈显著正相关,而与Cu、Mn和Zn呈负相关[21]。pH值、Ni[22]、Pb[3]和空间距离[23]等均是引起土壤微生物群落变化的主导因素。以上研究多采用针对核酸的高通量测序方法,研究重点为微生物分类多样性和遗传多样性。但微生物碳代谢活性是了解土壤碳素循环和储存的核心[24],因此,有必要从土壤微生物碳代谢角度对设施菜地土壤中微生物代谢功能的变化,尤其是对不同种植年限和地点导致的差异及影响因素进行深入研究。
山东省是中国重要的设施蔬菜生产地,其设施菜地种植面积占全国总面积的50%以上[25]。本文选取山东省2个典型设施蔬菜生产市(寿光、安丘),采用Biolog-Eco微平板法,研究不同种植年限、不同区域设施菜地中土壤微生物代谢功能多样性的差异,进一步分析与碳源利用相关的细菌群落及利用碳源的主要影响因子。本研究将设施蔬菜栽培作用下土壤微生物对碳的代谢功能和细菌群落、土壤中非生物物质联系起来,以期为深入了解设施菜地长期连续种植下土壤质量变化、促进设施菜地土壤的可持续利用提供科学依据。
1 材料与方法
1.1 研究地点及样品采集
研究地点位于山东省安丘市和寿光市。通过调查,在安丘市选择5个蔬菜大棚:大棚集中在300 m范围内,大棚结构、种植作物等基本一致,种植年限分别为3 a(AQ1)、7 a(AQ2)、10 a(AQ3)、14 a(AQ4)和16 a(AQ5)。土壤类型为潮土。以猪粪、牛粪为基肥(用量约为7.5 kg/m2),种植过程中根据生长期冲施化学肥料。种植作物为黄瓜、西红柿,种植时间从9月下旬至来年6月中旬。在寿光市选择6个蔬菜大棚:大棚集中在600 m范围内,大棚结构、种植作物等基本一致,种植年限分别为3 a(SG1)、5 a(SG2)、7 a(SG3)、10 a(SG4)、15 a(SG5)和17 a(SG6)。土壤类型为褐土。以稻壳鸡粪为基肥(用量约为8.3 kg/m2),种植过程中根据生长期冲施化学肥料。种植作物为茄子,种植时间从8月中旬至来年6月底。
土壤取样深度为0~20 cm。每个大棚设3个重复:由东向西一条直线上均匀分布3个区域,每个区域采用梅花采样法取样,将土壤现场混合均匀,去除土样中植物根系、石块等杂质,然后将其置于4 ℃车载冰箱中运回实验室。按四分法分为三份:一份置于4 ℃冰箱保存,用于微生物代谢功能多样性分析;一份风干后用玛瑙棒研磨,过筛(孔径0.25 mm),4 ℃避光保存,用于土壤pH值、有机质(Organic Matter,OM)和重金属测定;最后一份置于-80 ℃超低温冰箱保存,用于细菌群落分析。
1.2 微生物代谢功能多样性测定
微生物代谢功能多样性测定采用Biolog-Eco微平板法[12]。将10 g新鲜土壤置于100 mL 0.85%的无菌NaCl溶液中,在200 r/min下避光振荡1 h。用0.85%的无菌NaCl溶液再稀释100倍。将稀释液接种到Biolog Eco微平板中,每个微孔接种150L。微平板置于(25±1) ℃下恒温培养7 d,每24 h在BIOLOG EmaxTM(Biolog,Hayward,CA,USA )上读取590 nm和750 nm 波长下的吸光值(上述操作均在无菌条件下进行)。
土壤微生物对碳源的利用强度采用每孔平均颜色变化率(Average Well Color Development,AWCD)来描述,计算见式(1)。
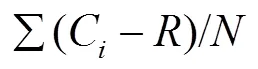
式中C为第孔的吸光值;为对照孔的吸光值;为涉及的碳源的个数。
用Shannon、Simpson和McIntosh 3个指数表征土壤微生物对碳源利用的功能多样性。其中Shannon指数用于评价微生物的丰富度,计算见式(2);Simpson指数用于评价土壤微生物群落中最常见物种的优势度,计算见式(3);McIntosh指数用于评价群落物种的均一性,计算见式(4)。


式中P是第孔相对吸光值(C-)与相对吸光值总和的比;n是第孔相对吸光值。
1.3 数据分析与统计
采用SPSS 17.0 Duncan多重比较判断处理间显著性差异(<0.05)。采用SPSS 17.0进行主成分分析(Principal Componets Analysis,PCA)。基于SPSS 17.0 Spearman相关性分析结果,采用Gephi 0.9.2绘制相关性网络关系图。采用Canoco 5.0对微生物对碳源的利用情况进行冗余分析(Redundancy Analysis,RDA)。
2 结果与分析
2.1 设施菜地中土壤微生物对碳源的利用
AWCD与土壤中能利用单一碳源的微生物的数量和种类有关,可反映土壤微生物的密度和活性[26]。AWCD的值越大,土壤微生物的密度和活性越高,土壤微生物对碳源的总利用强度越高。AWCD随培养时间变化见图 1。由图1可知,除AQ4外,安丘其他菜地土壤的AWCD随着种植年限的增加而降低。除SG4外,寿光其他菜地土壤的AWCD差异如下:SG1和SG2(两者之间差异不显著)>SG3和SG5(两者之间差异不显著)>SG6。综上,设施菜地中土壤微生物对碳源的总利用强度随着种植年限的增加而降低。但AQ4和SG4并不遵循此规律:AQ4土壤的AWCD均显著高于AQ2、AQ3和AQ5,SG4土壤的AWCD为寿光土壤中最低。
Biolog-Eco微平板有31种碳源,根据化学基团分为6类:糖类、氨基酸类、羧酸类、聚合物类、酚类和胺类[24]。为分析设施菜地中土壤微生物对6类碳源的利用情况,分别计算6类碳源AWCD随培养时间变化,结果见图 2。由图2可知,在安丘土壤中:AQ1中6类碳源的AWCD相对较高。AQ5中6类碳源的AWCD相对较低。在寿光土壤中:SG1和SG2中糖类、羧酸类、聚合物类和胺类碳源的AWCD相对较高,但SG1中氨基酸类和酚类碳源的AWCD均为较低。其他处理各类碳源AWCD没有明显规律。表明两地土壤对各分类碳源的利用偏好不同,较为复杂。综合分析培养168 h后6类碳源AWCD,在6类碳源中,氨基酸类碳源AWCD最高(0.791~1.211,平均值1.014),酚类碳源AWCD最低(0.251~0.900,平均值0.562)。表明土壤微生物对氨基酸类碳源的利用能力最强,对酚类碳源的利用能力最弱。
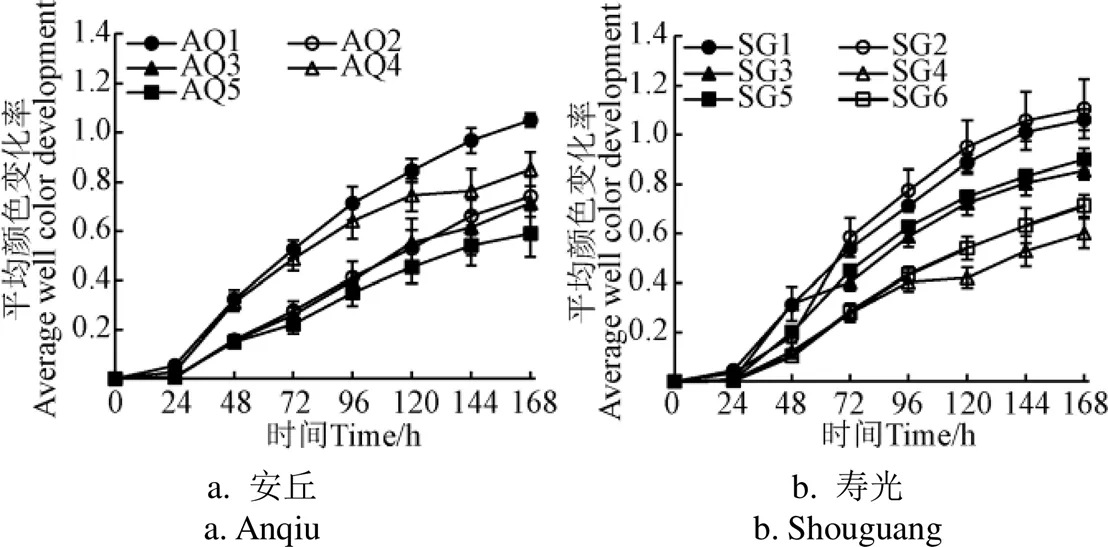
注:AQ1~AQ5分别代表安丘种植年限3、7、10、14和16 a设施菜地;SG1~SG6分别代表寿光种植年限3、5、7、10、15和17 a设施菜地。下同。
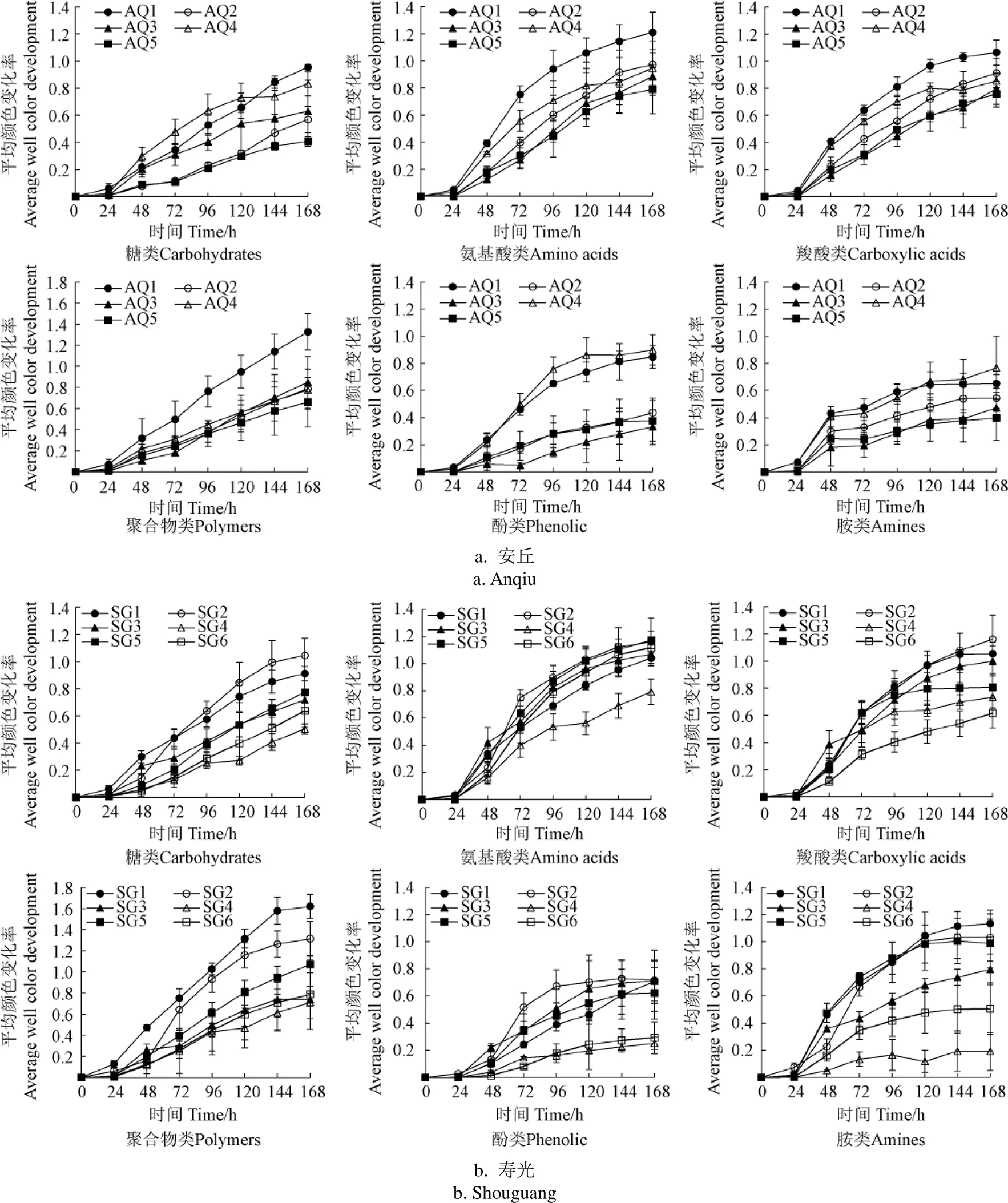
图2 每类碳源利用平均颜色变化率
2.2 设施菜地中土壤微生物功能多样性指数
不同的多样性指数表征土壤微生物功能多样性的不同方面。由表1知,除AQ4外,安丘菜地土壤中Shannon指数随着种植年限的增加而降低,其中AQ1的Shannon指数显著高于AQ2和AQ3,AQ2和AQ3的Shannon指数显著高于AQ5(<0.05)。在寿光,除SG4外,SG1和SG2的Shannon指数显著高于SG3和SG5,SG3和SG5的Shannon指数显著高于SG6(<0.05)。Simpson指数、McIntosh指数与Shannon指数的变化规律相一致,只在统计显著性上略有不同。表明设施菜地中土壤微生物的丰富度、群落中最常见物种的优势度、群落物种的均一性随种植年限的增加而降低,但AQ4和SG4并不遵循此规律。综合分析两地之间各指数差异,发现安丘土壤中Shannon指数和Simpson指数均显著高于寿光(<0.05),而安丘土壤中McIntosh指数却显著低于寿光(<0.05)。表明安丘土壤中微生物的丰富度、群落中最常见物种的优势度高于寿光,但群落物种的均一性低于寿光。

表1 设施菜地土壤中微生物碳源利用多样性指数
注:同地区中同列不同字母表示差异显著(<0.05);AQ,安丘;SG,寿光。下同。
Note: Different letters in the same column of one county means significant difference (<0.05). AQ, Anqiu; SG, Shouguang. Same as below.
2.3 设施菜地中土壤微生物群落代谢多样性
主成分分析可直观显示不同土壤微生物对31种碳源的利用情况。对培养168 h 后AWCD数据标准化变换后进行典型变量分析,提取前2个主成分因子作荷载图,结果见图3。由图3知,第一主成分(PC1)方差贡献率为28.83%,第二主成分(PC2)方差贡献率为11.63%。两地之间土壤微生物对碳源的利用存在明显的空间分异。安丘土壤主要分布在第1、第2象限,寿光土壤主要分布在第3、第4象限。在同一个地方不同种植年限设施菜地土壤之间有一定的分异,但其差异小于两地之间的差异。表明不同的土壤类型、种植模式等对土壤微生物群落代谢多样性的影响大于种植年限的影响。
2.4 与碳源利用相关的细菌群落
不同设施菜地土壤中细菌群落结果见文献[22]。相对丰度很低的微生物群落其生态功能相对有限,故本文中选择优势细菌群落(相对丰度大于1%[27])(门水平,13种),分析其与碳源利用的相关性,结果见图4。结果发现,在安丘土壤中,6类16种碳源与不同门细菌显著相关(<0.05),表明以上16种碳源可被土壤细菌利用;在寿光土壤中,糖类、氨基酸类、羧酸类和聚合物类等4类11种碳源与不同门细菌显著相关(<0.05),表明以上11种碳源可被土壤细菌利用。

图3 设施菜地土壤中微生物碳源利用的主成分分析

注:只显示显著正相关(P<0.05)。
由图4知,在安丘土壤中,、、和等4个门细菌与不同碳源显著相关(<0.05)。其中与9种碳源显著相关(<0.05),是与碳源相关种类最多的细菌,表明此地可利用的碳源种类最多。在寿光土壤中,、、等9个门细菌与不同碳源显著相关(<0.05)。其中与4种碳源显著相关(<0.05),是与碳源相关种类最多的细菌,表明此地可利用的碳源种类最多。
2.5 土壤微生物利用碳源的影响因子
不同设施菜地土壤的理化性质和重金属含量结果见文献[22]。对两地土壤理化性质、重金属和微生物对31种碳源的利用情况进行RDA分析,以评估土壤微生物利用碳源的主要影响因子,结果见图5,其中箭头连线的长度和夹角分别代表作用的大小和正负。由图5可知,在安丘土壤中,RDA1和RDA2可分别解释30.92%和16.26%的土壤微生物对碳源的利用情况。Cd对土壤微生物碳源利用的负作用显著(<0.01),是影响土壤微生物碳源利用的最强环境因子,对总效应的贡献率为23.4%;OM对土壤微生物碳源利用的正作用显著(<0.01)。在寿光土壤中,RDA1和RDA2分别可解释31.02%和9.97%的土壤微生物对碳源的利用情况。Zn、OM、Cd对土壤微生物碳源利用的负作用显著(<0.05),As、pH值对土壤微生物碳源利用的正作用显著(<0.05)。

注:1.β-甲基-D-葡萄糖苷;2.D-半乳糖酸γ-内酯;3.D-木糖;4.i-赤藻糖醇;5.D-甘露醇;6.N-乙酰-D-葡萄糖胺;7.D-纤维二糖;8.α-D-葡萄糖-1-磷酸;9.α-D-乳糖;10.D, L-α-磷酸甘油;11.L-精氨酸;12.L-天冬酰胺;13.L-苯丙氨酸;14.L-丝氨酸;15.L-苏氨酸;16.甘氨酰-L-谷氨酸;17.丙酮酸甲酯;18.D-半乳糖醛酸;19.γ-羟丁酸;20.D-葡糖胺酸;21.衣康酸;22.α-丁酮酸;23.D-苹果酸;24.吐温40;25.吐温80;26.α-环式糊精;27.肝糖;28.2-羟基苯甲酸;29.4-羟基苯甲酸;30.苯乙胺;31.腐胺。
3 讨 论
Biolog-Eco微板上的31种碳源多为植物根系分泌物的主要成分,是根际土壤微生物有效碳源的代表[2]。在东北不同土地利用类型下土壤微生物对不同碳源的利用强度不同,种植玉米、水稻、土豆、大豆和荒地土壤中微生物利用最强的碳源种类均有不同[17]。云南森林中土壤微生物对氨基酸类和羧酸类碳源的利用强度高,对酚类和胺类的利用强度低,并且受季节的影响[14]。本研究发现土壤微生物对氨基酸类碳源的利用能力最强,对酚类碳源的利用能力最弱。由此可知,土壤类型、植被、季节等均可影响土壤微生物对不同碳源的利用强度。
连续多年的蔬菜种植可引发严重的土壤问题,进而导致土壤微生物多样性减少[2]。高通量测序结果发现设施蔬菜种植对土壤微生物群落的影响:Tian等[28]发现随着设施蔬菜种植年限的延长,细菌中大部分属的相对丰度在第3年略有增加后逐渐下降;Song等[29]发现真菌的多样性随设施蔬菜种植年限的增加而降低,但细菌的多样性没有显著变化。土壤中微生物群落与代谢功能密切相关[30]。设施蔬菜连作过程中,人为干扰和自毒性物质引起根际土壤微生物群落的改变,进而导致土壤微生物代谢功能的失调[31]。赵辉等[32]研究发现,设施蔬菜种植5、7 a后,AWCD和3个多样性指数均随种植年限的增加而逐渐降低,与本研究结果一致。但本研究中AQ4和SG4并不符合其他年限菜地土壤中代谢功能多样性变化的规律,具体原因有待进一步研究。
本研究发现两地之间土壤微生物对碳源利用具有差异,可能有几个方面原因:土壤类型是土壤微生物丰度和多样性的主要驱动因素[33],研究发现土壤类型对土壤微生物群落结构的影响甚至大于重金属Cd的影响[34],本研究中两地土壤分别属于潮土和褐土,这可能是两地之间土壤微生物代谢功能多样性差异的原因之一;由于不同种类粪肥中含有的动物肠道菌、抗生素含量及营养成分等不同,施用牛粪、鸡粪和猪粪对土壤微生物多样性的影响也截然不同[35-36],本研究中寿光施用稻壳鸡粪,而安丘施用牛粪和猪粪。因此,粪肥种类也可能是导致两地土壤微生物代谢功能多样性差异原因;两地种植的作物不同对土壤微生物代谢功能多样性不同也有贡献。不同作物产生的植物凋落物的成分和数量[37]、根系分泌物的成分和数量[38]、植物根系的特征[39]等不同。由于植物为土壤微生物提供了大量的碳源(特别是可溶性碳源),其对微生物代谢活性及多样性起决定性作用[40];另外,连续单作是减少土壤微生物多样性的主要原因之一[2],本研究中寿光为茄子单作,而安丘是黄瓜和西红柿轮作。综上,本研究中两地之间土壤微生物对于碳源利用的差异主要源于土壤类型、粪肥种类、种植作物及种植方式的差异。
糖类、氨基酸类、羧酸类等根系分泌物的主要功能是为土微生物提供营养物质[41]。本研究结果进一步证实了这一点。安丘土壤中细菌可利用16种碳源(6类)、寿光土壤中细菌可利用11种碳源(4类)。在细菌利用碳源种类数量方面:在安丘土壤中,丰度为第二[22],是利用碳源种类最多的细菌,可以利用9种碳源。在寿光土壤中,虽然丰度较低[22],但是可利用4种碳源,是此地利用碳源种类最多的细菌。另外,两地中虽然是丰度最高的细菌[22],但利用碳源的种类都不是最多。因此,细菌的丰度的高低与可利用碳源的种类数量多少并不一致。这个结果的另一个原因也可能是,本研究所选择的碳源种类只有31种,所覆盖的碳源种类有限。
土壤微生物主要利用土壤中的可溶性有机碳进行碳代谢,因此土壤中可溶性有机碳是影响微生物碳源利用的决定性因素[40]。本研究发现OM是碳源利用的重要影响因子,但是在两地中作用截然不同,在安丘土壤中OM对土壤微生物碳源利用的影响是正作用,而在寿光土壤中其影响是负作用。这可能是因为OM的成分复杂,不同土壤类型中能溶解的碳的种类和浓度可能存在差异,这一点还有待进一步研究。重金属对土壤微生物种群具有抑制或毒性作用,其作用取决于重金属类型和浓度[3,42],而连续多年设施蔬菜栽培可引起土壤中重金属的积累[6,43]。在重金属污染的土壤中,具有更高金属耐受性的微生物比其他微生物生长得更好,导致微生物物种替换或多样性改变。研究发现重金属污染对土壤中真菌的多样性抑制大于细菌,土壤中微生物碳储存和对碳的利用模式随之改变[42]。本研究中重金属Cd(安丘、寿光)、Zn(寿光)对土壤微生物对碳源的利用强度的负作用,进一步证实了重金属(特别是Cd)对土壤微生物代谢功能多样性的抑制作用。另外,多项研究发现pH值显著影响土壤微生物群落[20,22],本研究在寿光土壤中发现pH值显著影响土壤微生物对碳源的利用。因此,pH值可能通过影响土壤中微生物群落而影响其对碳源的代谢功能。
4 结 论
本研究从不同种植年限和地点2个方面,初步揭示了设施菜地连续种植对土壤微生物代谢功能多样性的影响,得到如下结论:
1)除AQ4(安丘种植14 a)和SG4(寿光种植10 a)外,其他设施菜地土壤中平均颜色变化率、Shannon指数、Simpson指数和McIntosh指数随着种植年限的增加而降低。
2)两地导致的土壤微生物对碳源利用的差异显著,大于种植年限导致的差异。在安丘土壤中,是与碳源相关种类最多的细菌,与9种碳源显著相关。在寿光土壤中,是与碳源相关种类最多的细菌,与4种碳源显著相关。
3)在安丘土壤中,Cd对土壤微生物碳源利用有显著负作用,是影响安丘土壤微生物碳源利用的最强环境因子,有机质对土壤微生物碳源利用有显著正作用。在寿光土壤中,Zn、OM、Cd对土壤微生物碳源利用有显著负作用,As、pH值对土壤微生物碳源利用有显著正作用。设施蔬菜长期种植引起的土壤质量下降及重金属(特别是Cd)对土壤微生物的负作用应引起重视。
[1] 成臣,易艳红,廖雅汶,等. 赣南地区设施菜地土壤全硒含量分布特征[J]. 农业工程学报,2022,38(9):333-338.
Cheng Chen, Yi Yanhong, Liao Yawen, et al. Distribution characteristics of the total selenium content in greenhouse vegetable soil in southern Jiangxi Province of China[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(9): 333-338. (in Chinese with English abstract)
[2] Shen W S, Hu M C, Qian D, et al. Microbial deterioration and restoration in greenhouse-based intensive vegetable production systems[J]. Plant and Soil, 2021, 463: 1-18.
[3] Sun J, Pan L, Li Z, et al. Comparison of greenhouse and open field cultivations across China: Soil characteristics, contamination and microbial diversity[J]. Environmental Pollution, 2018, 243: 1509-1516.
[4] Li J, Wan X, Liu X, et al. Changes in soil physical and chemical characteristics in intensively cultivated greenhouse vegetable fields in North China[J]. Soil and Tillage Research, 2019, 195: 104366.
[5] 蔡祖聪. 我国设施栽培养分管理中待解的科学和技术问题[J]. 土壤学报,2019,56(1):36-43.
Cai Zucong. Scientific and technological issures of nutrient management under greenhouse cultivation in China[J]. Acta Pedologica Sinica, 2019, 56(1): 36-43. (in Chinese with English abstract)
[6] Kianpoor Kalkhajeh Y, Huang B, Hu W, et al. Environmental soil quality and vegetable safety under current greenhouse vegetable production management in China[J]. Agriculture, Ecosystems & Environment, 2021, 307: 107230.
[7] 陈香,李卫民,刘勤. 基于文献计量的近30年国内外土壤微生物研究分析[J]. 土壤学报,2020,57(6):1458-1470.
Chen Xiang, Li Weimin, Liu Qin. Bibliometric-based analysis of researches on soil microbes at home and abroad in the past 30 years[J]. Acta Pedologica Sinica, 2020, 57(6): 1458-1470. (in Chinese with English abstract)
[8] Li L, Li T, Meng H, et al. Effects of seven-year fertilization reclamation on bacterial community in a coal mining subsidence area in Shanxi, China[J]. International Journal of Environmental Research and Public Health, 2021, 18(23): 12504.
[9] Shu X, He J, Zhou Z, et al. Organic amendments enhance soil microbial diversity, microbial functionality and crop yields: A meta-analysis[J]. Science of the Total Environment, 2022, 829: 154627.
[10] 王宇峰,孟会生,李廷亮,等. 培肥措施对复垦土壤微生物碳氮代谢功能多样性的影响[J]. 农业工程学报,2020,36(24):81-90.
Wang Yufeng, Meng Huisheng, Li Tingliang, et al. Effects of fertilization regime on the functional diversity of microbial carbon and nitrogen metabolism in reclaimed soil[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(24): 81-90. (in Chinese with English abstract)
[11] Wang C N, Wu R L, Li Y Y, et al. Effects of pesticide residues on bacterial community diversity and structure in typical greenhouse soils with increasing cultivation years in Northern China[J]. Science of the Total Environment, 2020, 710: 136321.
[12] He W, Ye W, Sun M, et al. Soil phosphorus availability and stoichiometry determine microbial activity and functional diversity of fluvo-aquic soils under long-term fertilization regimes[J]. Journal of Soils and Sediments, 2022, 22(4): 1214-1227.
[13] Zhu Z, Bai Y, Lv M, et al. Soil fertility, microbial biomass, and microbial functional diversity responses to four years fertilization in an apple orchard in North China[J]. Horticultural Plant Journal, 2020, 6(4): 223-230.
[14] 何中声,陈佳嘉,朱静,等. 戴云山南坡不同海拔森林土壤微生物功能多样性特征及影响因素[J]. 生态学报,2022,42(9):3504-3515.
He Zhongsheng, Chen Jiajia, Zhu Jing, et al. Characteristics of microbial functional diversity and its influecing factors of forest soils at different elevations on the southern slope of Daiyun Mountain[J]. Acta Ecologica Sinica, 2022, 42(9): 3504-3515. (in Chinese with English abstract)
[15] Furtak K, Grządziel J, Gałązka A, et al. Prevalence of unclassified bacteria in the soil bacterial community from floodplain meadows (fluvisols) under simulated flood conditions revealed by a metataxonomic approachss[J]. Catena, 2020, 188: 104448.
[16] Yin Y, Yan Z. Variations of soil bacterial diversity and metabolic function with tidal flat elevation gradient in an artificial mangrove wetland[J]. Science of The Total Environment, 2020, 718: 137385.
[17] 贾鹏丽,冯海艳,李淼. 东北黑土区不同土地利用方式下农田土壤微生物多样性[J]. 农业工程学报,2020,36(20):171-178.
Jia Pengli, Feng Haiyan, Li Miao. Soil microbial diverstiy of black soil under different land use patterns in northeast China[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(20): 171-178. (in Chinese with English abstract)
[18] 顾美英,徐万里,马凯,等. 不同定植年限核桃园土壤细菌群落多样性及碳代谢功能特征[J]. 生态学杂志,2021,40(7):2045-2056.
Gu Meiying, Xu Wanli, Ma Kai, et al. Soil bacterial communtiy diversity and carbon source emtabolism function in walnut orchard with different stand ages[J]. Chinese Journal of Ecology, 2021, 40(7): 2045-2056. (in Chinese with English abstract)
[19] Zhao Y N, Mao X X, Zhang M S, et al. Response of soil microbial communities to continuously mono-cropped cucumber under greenhouse conditions in a calcareous soil of north China[J]. Journal of Soils and Sediments, 2020, 20(5): 2446-2459.
[20] Zhang J, Wang P, Tian H, et al. Pyrosequencing-based assessment of soil microbial community structure and analysis of soil properties with vegetable planted at different years under greenhouse conditions[J]. Soil and Tillage Research, 2019, 187: 1-10.
[21] Deng W, Zhang A, Chen S, et al. Heavy metals, antibiotics and nutrients affect the bacterial community and resistance genes in chicken manure composting and fertilized soil[J]. Journal of Environmental Management, 2020, 257: 109980.
[22] Yuan X, Zhang Y, Sun C, et al. Profile of bacterial community and antibiotic resistance genes in typical vegetable greenhouse soil[J]. International Journal of Environmental Research and Public Health, 2022, 19(13): 7742.
[23] Zhang K, Adams J M, Shi Y, et al. Environment and geographic distance differ in relative importance for determining fungal community of rhizosphere and bulk soil[J]. Environmental Microbiology, 2017, 19(9): 3649-3659.
[24] Liu Z D, Song Y Y, Ma X Y, et al. Deep soil microbial carbon metabolic function is important but often neglected: A study on the Songnen Plain reed wetland, Northeast China[J/OL]. Fundamental Research, 2022. [2022-12-20]. https://doi.org/10.1016/j.fmre.2022.06.013.
[25] Zhao X, Wang J, Zhu L, et al. Field-based evidence for enrichment of antibiotic resistance genes and mobile genetic elements in manure-amended vegetable soils[J]. Science of the Total Environment, 2019, 654: 906-913.
[26] Choi K H, Dobbs F C. Comparison of two kinds of Biolog microplates (GN and ECO) in their ability to distinguish among aquatic microbial communities[J]. Journal of Microbiological Methods, 1999, 36(3): 203-213.
[27] Yang Y, Chen Q, Yu W, et al. Estimating soil bacterial abundance and diversity in the Southeast Qinghai-Tibet Plateau[J]. Geoderma, 2022, 416: 115807.
[28] Tian T, Chen Z, Tian Y Q, et al. Microbial diversity in solar greenhouse soils in Round-Bohai Bay-Region, China: The influence of cultivation year and environmental condition[J]. Environmental Science and Pollution Research, 2017, 24(29): 23236-23249.
[29] Song Y, Xu M, Li X N, et al. Long-term plastic greenhouse cultivation changes soil microbial community structures: A case study[J]. Journal of Agricultural and Food Chemistry, 2018, 66(34): 8941-8948.
[30] Song Y, Li X N, Yao S, et al. Correlations between soil metabolomics and bacterial community structures in the pepper rhizosphere under plastic greenhouse cultivation[J]. Science of the Total Environment, 2020, 728: 138439.
[31] Li Y, Chi J, Ao J, et al. Effects of different continuous cropping years on bacterial community and diversity of cucumber rhizosphere soil in solar-greenhouse[J]. Current Microbiology, 2021, 78(6): 2380-2390.
[32] 赵辉,王喜英,徐仕强,等. 贵州武陵片区不同种植年限设施菜地土壤微生物群落的结构和功能多样性[J]. 河南农业科学,2021,50(1):81-91.
Zhao Hui, Wang Xiying, Xu Shiqiang, et al. Soil microbial communtiy structure and functional diversity in vegetable greenhouse for differetn plantin years in Wuling area of Guizhou province[J]. Journal of Henan Agricultural Sciences, 2021, 50(1): 81-91. (in Chinese with English abstract)
[33] Sadet-Bourgeteau S, Houot S, Karimi B, et al. Microbial communities from different soil types respond differently to organic waste input[J]. Applied Soil Ecology, 2019, 143: 70-79.
[34] Liu H, Yang Y, Yang Y, et al. Dynamics of fungal and bacterial communities in different types of soil ageing with different dosages of cadmium[J]. Ecotoxicology and Environmental Safety, 2022, 242: 113860.
[35] Han X M, Hu H W, Chen Q L, et al. Antibiotic resistance genes and associated bacterial communities in agricultural soils amended with different sources of animal manures[J]. Soil Biology & Biochemistry, 2018, 126: 91-102.
[36] Yuan X, Zhang Y, Fan L, et al. Temporal dynamics of antibiotic resistance genes in vegetable greenhouse soils following different manure applications[J]. Journal of Soil Science and Plant Nutrition, 2022, 22: 5144-5158.
[37] Xu Z, Yu G, Zhang X, et al. Divergence of dominant factors in soil microbial communities and functions in forest ecosystems along a climatic gradient[J]. Biogeosciences, 2018, 15: 1217-1228.
[38] Williams A, Langridge H, Straathof A L, et al. Root functional traits explain root exudation rate and composition across a range of grassland species[J]. Journal of Ecology, 2022, 110(1): 21-33.
[39] Spitzer C M, Lindahl B, Wardle D A, et al. Root trait–microbial relationships across tundra plant species[J]. New Phytologist, 2021, 229(3): 1508-1520.
[40] Hernández-Cáceres D, Stokes A, Angeles-Alvarez G, et al. Vegetation creates microenvironments that influence soil microbial activity and functional diversity along an elevation gradient[J]. Soil Biology and Biochemistry, 2022, 165: 108485.
[41] 吴林坤,林向民,林文雄. 根系分泌物介导下植物-土壤-微生物互作关系研究进展与展望[J]. 植物生态学报,2014,38(3):298-310.
Wu Linkun, Lin Xiangmin, Lin Wenxiong. Advances and perspective in research on plant-soil-microbe interactions mediated by root exudates[J]. Chinese Journal of Plant Ecology, 2014, 38(3): 298-310. (in Chinese with English abstract)
[42] Xu Y, Seshadri B, Bolan N, et al. Microbial functional diversity and carbon use feedback in soils as affected by heavy metals[J]. Environment International, 2019, 125: 478-488.
[43] 苑学霞,方丽萍,张太平,等. 不同年限设施菜地土壤中重金属和抗生素污染特征[J]. 生态环境学报,2020,29(8):1669-1674.
Yuan Xuexia, Fang Liping, Zhang Taiping, et al. Characteristics of heavy metals and antibiotics pollution in vegetabel greenhouses after different culivation years[J]. Ecology and Environmental Sciences, 2020, 29(8): 1669-1674. (in Chinese with English abstract)
Soil microbial metabolism functional diversity in typical facility vegetable fields
Yuan Xuexia1, Zhang Yong2, Yang Guihua3, Wang Wenbo1, Sun Chenxi1, Wu Yuanjuan1, Fang Liping1
(1.-,,250100,;2.,250014,;3.,250099,)
Metabolic functional diversity of soil microorganisms can greatly contribute to the health of the soil ecosystems in facility vegetable field. However, the soil quality is seriously deteriorated in recent years, due to the frequency input of organic and chemical fertilizers, pesticides, and fungicides. The Biolog-Eco method has been widely used to demonstrate the carbon metabolic activity of culturable microorganisms. The ecological status of microbial communities can also be characterized by the metabolic functional diversity in diverse environments. In this study, a systematic investigation was carried out to clarify the impacts of cultivation periods and geographical location on the functional diversity of soil microbial metabolism using a Biolog-Eco microplate. Correlation analysis and Redundancy Analysis (RDA) were used to reveal the relative bacterial phyla and effect factors. The soil samples were collected from 11 facility vegetable fields in the two typical vegetable cultivation counties (Anqiu and Shouguang) of China. The key influencing factors were then identified for the microorganisms and carbon source utilization. The results showed that the Average Well Color Development (AWCD), Simpson index, McIntosh index, and Shannon index decreased with the increase of cultivation years, except for the AQ4 (cultivation history of 14 a in Anqiu), and SG4 (cultivation history of 10 a in Shouguang). The Principal Component Analysis (PCA) result demonstrated that the difference in the soil microbial utilization of carbon sources between two counties was much more significant than those among the soils with different cultivation histories in the same county. It infers that the geographical location played a more important role than the cultivation years. Correlation analysis showed that 16 different carbon sources (six types of carbon source involved) were closely related to the different bacterial phyla (<0.05), andof soil bacterial phylum was positively related to the most kinds of carbon sources (9 kinds) in the Anqiu soil. In Shouguang soil, 11 different carbon sources (four types: carbohydrates, amino acids, carboxylic acids, and polymers) were closely related to the different bacterial phyla (<0.05), andpositively related to most kinds of carbon sources (4 kinds). RDA showed that the Cd was the top environmental factor, negatively affecting the soil microbial carbon sources utilization in Anqiu soil (<0.01), while the positive effect of organic matter was significant (<0.01). Zn, organic matter, and Cd were negatively dominated the utilization of microbial carbon sources (<0.05) in Shouguang, whereas, the effects of As and pH were significantly positive (<0.05). This finding can provide direct evidence that the significant decrease in soil microbial functional diversity was caused by the long-term cultivation of facility vegetable, different relative bacteria and effect factors caused by location in the north of China. It is urgent to take different measures according to different situation to improve the soil micro-environment for the healthy environments in the vegetable fields.
soils; microorganism; facility vegetable field; cultivation years; Biolog-Eco
10.11975/j.issn.1002-6819.2022.24.016
X172
A
1002-6819(2022)-24-0145-08
苑学霞,张勇,杨贵华,等. 典型设施菜地中土壤微生物代谢功能多样性[J]. 农业工程学报,2022,38(24):145-152.doi:10.11975/j.issn.1002-6819.2022.24.016 http://www.tcsae.org
Yuan Xuexia, Zhang Yong, Yang Guihua, et al. Soil microbial metabolism functional diversity in typical facility vegetablefields[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2022, 38(24): 145-152. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2022.24.016 http://www.tcsae.org
2022-10-10
2022-11-16
国家自然科学基金项目(41907030)
苑学霞,研究员,研究方向为农业环境安全与风险评估。Email:xuexiayuan@163.com
