胆囊神经内分泌癌临床特征及诊治分析:附3例报告并文献回顾
2022-03-11章正威张秀梅王翔章应峰翟华敏张彤
章正威,张秀梅,王翔,章应峰,翟华敏,张彤
(扬州大学附属兴化市人民医院肝胆胰外科,江苏兴化225700)
神经内分泌癌 (neuroendocrine carcinoma,NEC)起源于弥散的神经内分泌细胞,占所有恶性肿瘤的不足1%。大多数神经内分泌癌存在于胃肠道(66.0%) 和呼吸道(31.0%) 系统中,而胆囊神经内分泌癌(gallbladder neuroendocrine carcinoma,GB‐NEC)罕见,仅占所有胃肠道神经内分泌癌的0.2%和胆囊癌的2%左右[1-2]。近年来由于影像技术等改善,提高了GB‐NEC 早期检出率[3]。
该病没有特异性临床表现,以右上腹不适或疼痛为最常见症状,多合并胆囊结石及胆囊炎,而类癌综合征很少出现[4]。由于缺乏有助于将其与其他类型胆囊癌区分开的典型影像学特征,MRI 和CT 等手段只能发现胆囊壁的增厚及隆起样病变等,因此很难对GB‐NEC 做出正确的术前诊断。同时神经内分泌癌缺乏特异性的肿瘤指标,糖类抗原19‐9(CA19‐9)、糖类抗原125(CA125)等肿瘤标志物指标常为阴性结果[4];血清嗜铬粒蛋白A(chromogranin A,CgA)水平可用于GB‐NEC 诊断及随访,但低分化NEC 的CgA 分泌量相对较低,且易出现假阳性。明确诊断需要病理学和免疫组化检查。CgA 与突触素(synaptophysin,Syn)及Ki‐67是神经内分泌肿瘤诊断的必测项目,并根据细胞形态将神经内分泌癌分为大细胞癌,小细胞癌和混合性腺神经内分泌癌[5]。
NEC 是高度恶性肿瘤,通常进展迅速,可引起早期肝浸润和淋巴结转移[4];根据美国SEER(Surveillance,Epidemiology,and End Results,SEER)数据库统计,2004—2015 诊断的88 例GB‐NEC 患者,有45.4%诊断时已经转移,总体1年生存率约为50%,5年生存率约为10%[3]。GB‐NEC 的诊疗尚无标准,目前在临床实践中常采用美国肿瘤联合委员会(AJCC)第七版中的胆囊癌TNM 分期方法对胆囊神经内分泌癌进行分期。治疗上强调手术、化疗和放疗等多学科综合疗法,但最佳治疗策略尚存在争议。手术是目前最重要也是首选的治疗方法,方式包括单纯胆囊切除术和各种扩大的手术方法(局部淋巴结清扫,转移灶切除)[4]。
由于GB‐NEC 病例非常少见,因此只有很少的研究总结了其特征。本文回顾收治的3 例GB‐NEC患者以及过去20年中报道的GB‐NEC 病例,总结GB‐NEC 的临床病理表现、治疗和预后。
1 资料与方法
1.1 临床资料
从2008年1月—2020年12月,扬州大学附属兴化市人民医院肝胆外科对176 例胆囊癌患者进行了手术治疗,其中3 例根据术后病理和免疫组织化学检查诊断为GB‐NEC,占1.7%。统计并分析患者一般情况、临床表现、手术方式、实验室检查、影像学检查、病理检查结果及随访资料,随访截止至2021年8月。肿瘤的定义基于HE 染色切片上的典型形态特征,并使用神经内分泌分化的免疫组化标志物(CgA,CD56 和Syn)染色。放射成像方式包括MRI 和CT 以检查疾病的位置和范围。研究已由医院伦理委员会审查和批准。
1.2 文献检索
使用Medline,Google Scholar 和中国知网数据库对2000年1月—2020年12月发表的文章进行了系统的搜索。用于检索的关键词包括:“胆囊”,“神经内分泌癌”,“小细胞癌”,“混合腺嘌呤内分泌癌”,“大细胞癌”和“类癌”的中英文。剔除了分期不明确、治疗及随访时间缺失和随访时间少于3 个月的数据后,共保留121 例GB‐NEC患者[1,4,6-49]。
1.3 统计学处理
将我院收治的3 例和文献检索的121 例共124 例患者纳入分析。采用SPSS 25.0 软件进行统计学分析。Kaplan‐Meier 方法和对数秩检验用于单变量生存分析;Cox 风险回归模型用于多变量生存分析,并计算危害比(hazard ratio,HR)和95%置信区间(confidence interval,CI)。χ2检验用于组之间构成比差异比较,Spearman 分析法用于等级变量的相关性分析[50]。P<0.05 为差异有统计学意义。
2 结果
2.1 病例报道
病例1 男,70 岁。因“发作性右上腹痛”于2013年12月入院。腹部查体见右上腹轻度压痛,无明显反跳痛及肌紧张;既往20年前行食道癌根治术,未见食管癌复发。行CT 提示:厚壁型胆囊癌(图1A)。肿瘤标志物:CA125 90.3 U/mL(正常范围0~35 U/mL),癌胚抗原(carcinoembryonic antigen,CEA)、CA19‐9 处于正常范围。行胆囊切除术,术中见胆囊癌侵犯结肠肝曲,遂行胆囊癌根治+右半结肠切除术。术后病理(胆囊+右半结肠):⑴胆囊颈部浸润型神经内分泌癌,小细胞形态,癌已侵及全层至升结肠浆膜近肌层,切缘未见癌残留,胆囊内见混合性结石;胆囊周围找见癌结节2 枚;送检(XII 组)淋巴结2 枚示慢性炎。⑵结肠壁示轻度慢性浅表性炎伴管状腺瘤样增生及上皮轻度不典型增生,肠壁周围找见淋巴结4 枚,均示慢性炎。CK19 阳性、CK20 阴性;CgA阴性、Syn 局灶阳性、CD56 阳性(图1B-E)。病理分期IIIA 期。术后1年因纳差、消瘦、下肢水肿复查CT(2014年12月)示:胆囊窝旁软组织密度团块,与肝左叶、胰头及邻近肠管分界不清(图1F)。考虑肿瘤复发,行放疗及依托泊苷+卡铂(EC)方案化疗。辅助治疗后症状未缓解;2015年3月患者症状进一步加重,复查肿瘤标志物示:CA125 51.4 U/mL,CEA、CA19‐9 处于正常范围。患者因恶病质于2015年6月死亡。
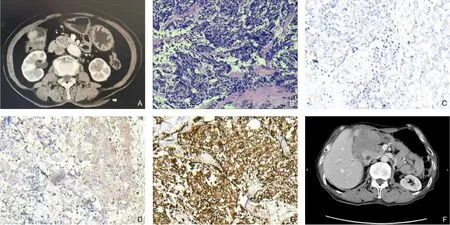
图1 病例1影像学与病理学资料A:术前CT(胆囊增大,局部壁不规则增厚,与邻近肠管分界不清,增强后强化不均);B:HE 染色(×40);C-E:免疫组化染色(×400)(CgA 阴性、Syn 局灶阳性、CD56 阳性);F:术后1年复查CT(胆囊窝旁软组织团块,内见条状高密度影,大小约65 mm×59 mm,增强后不均匀强化,与肝左叶、胰头及邻近肠管分界不清)Figure 1 Imaging and pathological data of case 1A:Preoperative CT image(enlargement of the gallbladder,with irregular thickening in local region of the gallbladder wall,and the indistinct boundary with the surrounding bowel with uneven enhancement); B:HE staining(×40); C-E:Immunohistochemical staining(×400)(negative for CgA,locally positive for Syn,positive for CD56); F:CT image on one year after surgery(soft tissue mass in the gallbladder bed,containing a high density of stripe‐like inside shadows,with a size approximately of 65 mm×59 mm,uneven strengthening after enhancement,and unclear boundary with the left lobe of the liver,the head of the pancreas and the adjacent intestine)
病例2(意外胆囊癌) 女,67 岁。因“右上腹胀痛伴眼黄、尿黄3 d”于2018年1月急诊入院。腹部查体见右上腹轻度压痛,无明显反跳痛及肌紧张;既往史无特殊。行CT 提示:胆总管结石伴急性胆管炎;胆囊结石伴急性胆囊炎(图2A)。肿瘤标志物:CEA 5.26 ng/mL(正常范围0~5 ng/mL)、CA19‐9 188 U/mL(正常范围0~35 U/mL);CA125 处于正常范围。因入院时存在急性重症胆管炎倾向,急诊行“内镜下逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography,ERCP) +十二指肠乳头括约肌切开术(endoscopic sphincterotomy,EST) + 胆管取石术+ 经内镜鼻胆管引流术(endoscopic nasobiliary drainage,ENBD)”,当日同时急诊行腹腔镜下胆囊切除术,术中及术后胆囊标本未见呈肿瘤样病变。术后病理:⑴胆囊浸润型低分化神经内分泌癌,小细胞形态,癌已累及深肌层。⑵胆囊混合性结石;送检组织破碎,无法明确切缘情况。免疫组化标记示:CK8/18 阳性;CK20 阴性;CK5/6 阴性;P40 阴性;CK19 阳性、Ki‐67 约70%;CgA 阳性、Syn 阳性、CD56 阳性(图2B-E);P53 示错义突变。病理分期I 期。患者术后曾在上海长海医院行胆囊癌根治术,并于外院行EC 方案化疗,于2020年7月死亡。

图2 病例2影像学与病理学资料A:术前CT(胆囊壁稍均匀增厚,强化不明显,胆总管扩张);B:HE染色(×40);C-E:免疫组化染色(×400)(CgA阳性、Syn阳性、CD56阳性)Figure 2 Imaging and pathological data of case 2A:Preoperative CT image(slight and homogeneous thickening of the gall bladder wall,unobvious enhancement and dilation of the common bile duct); B:HE staining(×40); C-E:Immunohistochemical staining(×400)(positive for CgA,positive for Syn,positive for CD56)
病例3 女,55 岁。因“中上腹胀痛伴眼黄、尿黄半月”于2020年9月入院。腹部查体未见明显异常体征;既往史无特殊。行CT 提示:肝内胆管明显扩张,肝门胆管占位(图3A)。肿瘤标志物:癌胚抗原CEA 20.44 ng/mL (正常范围0~5 ng/mL)、CA19‐9 120.8 U/mL(正常范围0~35 U/mL);CA125处于正常范围。拟诊断肝门部胆管占位性病变,排除手术禁忌后行“高位胆管癌根治术”,术中见:腹腔少量淡黄色腹水,肝脏淤胆伴硬化,胆囊慢性炎症改变,胆囊颈及肝门处胆管质地硬,肿块向上侵犯至左右肝管汇合处,向下侵犯至胆总管中下段,周围淋巴结肿大。术中诊断:胆囊癌伴胆管侵犯,遂行胆囊癌根治术,术后病理:胆囊神经内分泌癌,小细胞形态,见神经及脉管侵犯;慢性胆囊炎;送检淋巴结均未见转移,其中第8 组、第12 组反应性增生,免疫组化:CgA 阴性、Syn 阳性、CD56 阳性(图3B-E);NSE 阴性、S‐100 阴性、CKpan 阳性、Ki‐67 80%、CK20 阳性、CK19 阳性、P53 阴性(示无义突变)、CK7 阳性。病理分期IIIA。术后复查肿瘤标志物均处于正常范围。患者于外院行善龙(生长抑素微球,每月1 次至今)治疗及吉西他滨+奥沙利铂方案(每月3 次,共6 个月)化疗,于2021年8月随访复查无复发及不适。

图3 病例3影像学与病理学资料A:术前CT(肝左叶及其边缘可见高密度管状影;肝门部胆管似稍增厚伴轻度强化;肝门部可见轻度强化软组织团块,大小约30 mm×41 mm);B:HE染色;C-E:免疫组化染色(CgA阴性、Syn阳性、CD56阳性)Figure 3 Imaging and pathological data of case 3A:Preoperative CT image(high‐density tubular shadows in the left lobe of the liver and its edges; seemingly slight thickening of hilar bile duct with mild enhancement; mild enhanced soft tissues in the hilar region with a size about of 30 mm×41 mm); B:HE staining; C-E:Immunohistochemical staining(negative for CgA,positive for Syn,positive for CD56)
2.2 GB‐NEC患者一般特征
共124 例患者纳入分析,中位年龄58 岁;女性占62.9% (78/124);72.1% (44/61) 为小细胞癌,32.5%(29/84)为混合型神经内分泌癌。绝大部分以腹痛、纳差等症状就诊,仅4 例患者为体检时发现胆囊占位性病变(胆囊肿块和/或胆囊壁增厚),2 例表现为类癌综合征,1 例表现为副肿瘤综合征[47]。采用美国肿瘤联合委员会(AJCC)第七版中的胆囊癌TNM 分期方法对GB‐NEC 进行分期。I、II 期患者分别占13.7%(17/124)和9.7%(12/124);31.5%为III 期(39/124),45.2%为IV 期(56/124)。有5 例为意外胆囊(5/49),即术前影像学检查未发现胆囊占位病变,其中4 例为I 期,1 例为II 期;其余患者均术前由腹部平扫及强化CT、MRI 明确肿瘤。
血清肿瘤标志物检测:CEA 升高者占23.5%(8/34),CA19‐9 升高者占33.3%(19/57),CA125升高46.7%(7/15),未见甲胎蛋白升高(0/9)。相关性分析发现,CA125 水平的升高与更晚的临床分期相关(r=0.727,P<0.05);小细胞癌比大细胞癌更常见于进展期(III期:39.5%vs.27.8%)及晚期(IV期:48.8%vs.33.3%)(r=0.319,P<0.05)。免疫组化结果中阳性率较高的分别是:Syn 96.3% (52/54),CgA 83.6% (46/55),CD56 92.0% (23/25),CK 81.8% (18/22),CK19 87.5% (7/8),P53 错译62.5%(5/8),NSE 44.4%(4/9)。
总体手术率为81.5%(101/124),其中IV 期患者手术率为66.0%(37/56),分期较晚患者手术率更低(P<0.05)。61 例患者接受化疗,其中39 例为顺铂和依托泊苷(EP)方案;III 期患者化疗率为64.1%(25/39),而IV 期为49.2%(29/56)。
2.3 GB‐NEC患者生存分析及危险因子
中位随访时间21 个月,总中位生存时间为11 个月,其中II 期患者中位生存时间23 个月,III 期患者19 个月,IV 期患者4 个月;I 期患者存活率高于50%无法评估中位生存时间。共49 例数据完整患者纳入多因素生存分析,发现细胞形态(大细胞vs.小细胞)、合并腺癌(是vs.否)均不是影响预后的危险因素;年龄>80 岁(HR=1.36,95%CI=1.026~1.860,P=0.049)、TNM 分期(II 期vs.I 期:HR=10.408,95%CI=2.554~42.404,P=0.001;III 期vs.I 期:HR=13.167,95%CI=3.288~52.732,P<0.001;IV 期vs.I 期:HR=38.022,95%CI=9.738~148.459,P<0.001)、手术(非根治术vs.未手术:HR=0.122,95%CI=0.022~0.786;P=0.027;根治术vs.未手术:HR=0.088,95%CI=0.019~0.481,P=0.006)、化疗(HR=0.517,95%CI=0.305~0.983,P=0.042)可以独立影响生存结局(表1)。
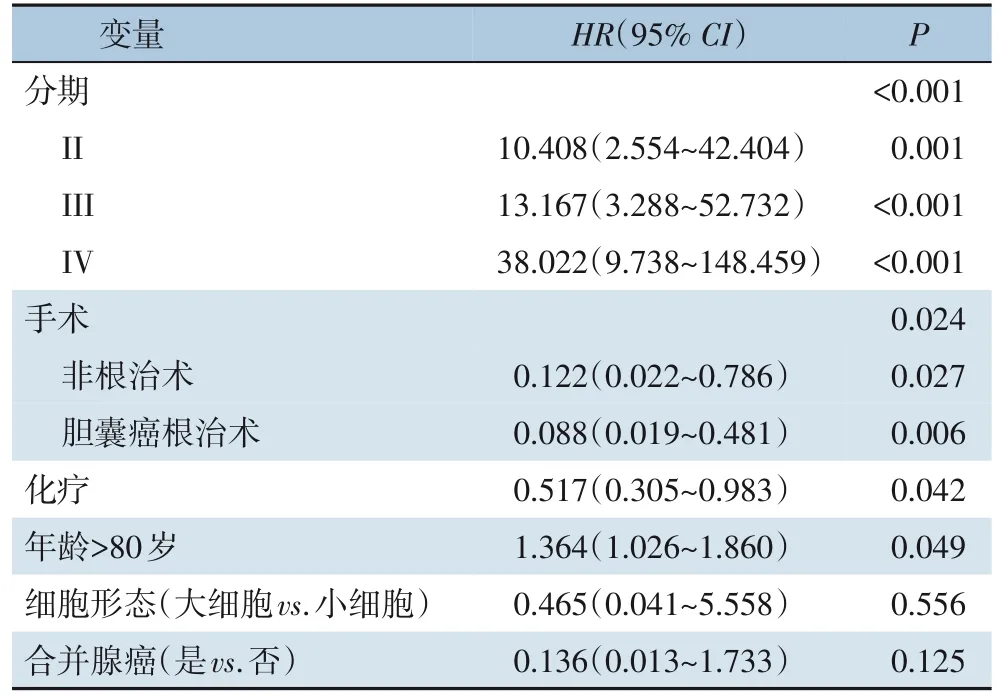
表1 GB-NEC患者多因素Cox生存分析(n=49)Table 1 Multivariate Cox survival analysis of GB-NEC patients(n=49)
2.4 不同疾病阶段GB‐NEC患者的手术及化疗结局
17 例I 期患者中,4 例行单纯胆囊切除术+术后化疗;10 例行单纯胆囊切除术未化疗;1 例行胆囊癌根治术+术后化疗;2 例行胆囊癌根治术未化疗。12 例II 期患者中,2 例行单纯胆囊切除术,其中1 例术后化疗;10 例行胆囊癌根治术(其中1 例为R1切除),其中3 例术后化疗。将I、II 期患者共同纳入多因素分析,术式(胆囊切除术vs.根治术:HR=2.889,95%CI=0.908~9.168,P=0.072) 和是否化疗(HR=3.120,95%CI=0.768~12.676,P=0.112)的结局差异没有统计学意义。
39 例III 期患者中,8 例行胆囊切除术+转移灶切除术,其中4 例术后行化疗;27 例行胆囊癌根治术或扩大根治术,其中18 例术后行化疗;3 例只行化疗;1 例未行任何治疗。单因素生存分析,手术+化疗组与单纯手术组生存时间差异无统计学意义(中位值生存时间:21 个月vs.9 个月,P=0.119),与4 例未手术患者生存时间差异明显(中位值生存时间:21 个月vs.3 个月,P<0.001)。多因素分析,术式(胆囊+转移灶切除术vs.根治术:HR=0.675,95%CI=0.113~4.023,P=0.667) 和是否化疗(HR=2.109,95%CI=0.808~5.994,P=0.127)对结局的影响差异无统计学意义。
56 例IV 期患者中,15 例行根治术(1 例R1切除),其中5 例术后行化疗;21 例行非根治术(胆囊切除术±转移灶切除术),其中8 例术后行化疗;14 例只行化疗,6 例未治疗。单因素生存分析发现单纯化疗组与手术+化疗组差异无统计学意义(中位时间:7 个月vs.5 个月,P=0.895),与未化疗(只行手术或未治疗) 组(中位时间:7 个月vs.2 个月,P<0.001)有明显差异。多因素分析证明了化疗的生存优势(HR=2.785,95%CI=1.376~5.636,P=0.004),而手术不能改善预后(根治术vs.未手术:HR=0.533,95%CI=0.232~1.233,P=0.138;非根治术vs.未手术:HR=0.932,95%CI=0.434~2.000,P=0.856)。
2.5 化疗对不同细胞形态IV期GB‐NEC的疗效
对不同细胞形态患者行单因素生存分析,发现小细胞癌患者行化疗能明显获益(中位值生存时间:9 个月vs.3 个月,P<0.001),而大细胞癌患者的化疗效果不明显(中位值生存时间:5 个月vs.2 个月,P=0.247)。但差异不明显可能与IV 期大细胞癌患者总体数少(n=6)有关。
3 讨论
GB‐NEC 罕见,迄今为止,仅有很少的相关病例报告。根据美国SEER 数据库的统计,GB‐NEC占所有NEC 的0.5%,占所有胆囊肿瘤的2.1%[51-52]。目前样本量最大的研究为来自印度的25 例报道[8],国内最大的报道为10 例[1],且IV 期患者占比均超过50%。本研究统计的IV 期患者占45.2%。过去的研究证明尽早发现和尽早手术能显著降低胆囊癌患者病死率[8]。本研究多因素分析的结果与既往的经验一致,因此提高早期诊断率是改善预后的关键。
手术可明显改善GB‐NEC 预后[53],但目前尚无术式选择的指南标准。来自SEER 数据库的研究发现:接受胆囊手术的患者的生存结局明显更好,但同时接受了胆囊手术和淋巴结清扫的患者与仅接受胆囊手术的患者相比,并没有获得更好的生存期[3]。我们通过分组的多因素分析得出与既往研究一致的结论:I 期及II 期患者可行单纯胆囊切除术、III 期患者可行胆囊切除+转移灶切除术,胆囊癌根治术不会为I~III 期患者带来更好的获益;IV 期患者行手术治疗无明显获益。
由于大多数GB‐NEC 患者被诊断为晚期,从而降低了手术率及生存时间,化疗成为晚期患者的主要治疗方案[5]。目前一线化疗方案为EP 或EC 方案[54]。本研究结果显示,尽管有超过一半的III 期患者采取积极的化学疗法,但对I~III 期患者行化疗无明显获益,而化疗能改善IV 期患者的预后,同时单因素分析发现化疗对于小细胞癌亚型似乎更有效。与本研究结果一致,中山大学附属第一人民医院报道了1 例多脏器远处转移的小细胞GB‐NEC 新辅助化疗成功案例[44],来自印度的研究[8]也认为小细胞NEC 患者行EC 方案新辅助化疗可增加R0切除率。但目前尚无大细胞癌成功新辅助化疗达到可切除效果的报道。
尽管手术和化疗对GB‐NEC 患者有一定疗效,目前进展期和晚期GB‐NEC 的生存时间仍不理想。生长抑素类似物即长效生长抑素已在胃肠胰神经内分泌癌的治疗获得成功[54],本研究中,4 例行生长抑素类似物+手术治疗+化疗[20,25,42]的GB‐NEC III 期患者的中位生存时间比18 例未行生长抑素治疗、但行手术+化疗的GB‐NEC III 期患者的中位生存时间长(21 个月vs.19 个月),但差异不具有统计学意义(P=0.479),目前仍缺乏大样本、多中心及前瞻性研究结果数据,因此,生长抑素类似物对GB‐NEC 的作用仍然不确定。靶向治疗已在胃肠胰晚期NEC 患者取得部分疗效[54],酪氨酸激酶抑制剂舒尼替尼,已被证实可延长晚期胰腺神经内分泌肿瘤患者的无进展生存期;但对GB‐NEC 治疗价值不明确[55]。目前仅有伊朗报道的1 例广泛转移的GB‐NEC 患者接受胆囊切除术+吉西他滨联合顺铂化疗+多西他赛联合舒尼替尼化疗+射频消融,在诊断后的46 个月情况良好无复发迹象[49]。国外一项研究通过对10 例GB‐NEC 患者进行了组织测序,发现几乎所有病例都有多种致病性或可能的致病性突变,其中以TP53、CTNNB1、RB1 和ATM最为常见,这对GB‐NEC 的治疗提供了新的线索[56]。程序性死亡1(programmed cell death protein 1,PD‐L1)抑制剂对于突变负荷高的神经内分泌癌应答率较高,且已广泛使用于肺小细胞癌,但在GB‐NEC 中使用却少有报道[57],仅发现1 例TP53 和RB1 突变的GB‐NEC 术后肝转移的患者行EC 方案+PD‐L1 抑制剂+PD‐L1 配体抑制剂治疗3 个月后CT观察到肝转移灶缩小[48]。
一项浙江省人民医院的研究[6]偶然发现血清CA125 升高与GB‐NEC 肝转移可能正相关,但并无其他类似报道。这一结论在本研究中得到了验证:CA125 水平的升高与更晚的临床分期相关。此外已有文献[58-60]报道证明了CA125 在不同肿瘤分期诊断及治疗效果评估中的作用。然而统计相关不等于因果,CA125 是否可作为NEC 的预后预测指标,需要更多研究证明。
总之,GB‐NEC 是一种特殊的胆囊癌,发病率低,恶性率普遍较高且预后差,没有特殊的临床表现,发现时常伴有肝脏和远处转移,需要病理学和免疫组化检查才能明确诊断。I~III 期患者可行单纯手术切除病灶,但胆囊癌根治术并不能延长患者生存期;晚期小细胞癌患者行化疗可以帮助增加患者生存率以及提高切除率可能。靶向治疗和免疫疗法的效果尚未完全验证,最佳治疗策略仍然未定;提高早期诊断率是改善预后的关键。
利益冲突:所有作者均声明不存在利益冲突。
