增龄因素对人牙髓干细胞生物学行为影响的研究
2022-03-11蔡逸馨王畇钦
蔡逸馨,王畇钦,王 娟,李 谨
随着微创理念和生物活性材料的发展,活髓保存治疗受到了广泛关注,其可最大限度保留剩余健康牙髓组织,提高牙齿远期保存率,但长期以来被认为适用范围有限,疗效不稳定。这一治疗的生物学基础在于人牙髓干细胞(human dental pulp stem cells,hDPSCs)具有良好的增殖与成牙/成骨向分化能力。
目前关于hDPSCs的研究多局限于乳牙、根尖未发育完成的年轻恒牙以及40岁以下患者根尖已发育完成的恒牙[1-4],对40岁以上患者恒牙研究较少[5-6]。至2020年底,我国60岁及以上人口比重已达到18.7%,老年人牙齿保存不容忽视。有研究发现,随着年龄的增长,牙髓组织中细胞成分减少,纤维成分增加,同时牙髓干细胞的生物学活性也可能存在增龄性的改变[7-8],然而关于hDPSCs生物学行为随年龄变化的基本规律尚不可知。
本研究拟比较不同年龄患者hDPSCs的生物学特性,了解增龄因素对其影响的基本规律,以期为老年人活髓保存治疗提供一定依据。
1 材料与方法
1.1 试剂与仪器
1.1.1 主要试剂 α-MEM培养基、PBS缓冲液、0.25%胰酶、Ⅰ型胶原酶(Gibco,美国);胎牛血清(FBS)(Sciencell,美国);3-异丁基-1-甲基黄嘌呤(IBMX)(Biosharp,中国);油红O染色试剂盒、茜素红染液、维生素C、氯化十六烷基吡啶(Solarbio,中国);双抗(新赛美,中国);β甘油磷酸钠、吲哚美辛(Sigma,美国);地塞米松、胰岛素、CCK8检测试剂盒(APExBIO,美国);CD34-FITC、CD90-APC、CD73-PEcy、CD146-PE(BD Pharmingen,美国);RNA提取试剂盒、逆转录试剂盒(TaKaRa,日本);qPCR试剂盒(Vazyme,美国)。
1.1.2 主要仪器 超净工作台、离心机、二氧化碳恒温孵箱(Thermo,美国);倒置相差显微镜(Leica,德国);多色分析流式细胞仪(BD,美国);微孔板分光光度计(MD,美国);ABI荧光定量PCR仪(QuantStudio7,美国)。
1.2 研究对象
本研究经南京医科大学机构伦理委员会批准(PJ2020-094-001),选择2020年4月至2020年9月就诊于江苏省口腔医院口腔颌面外科门诊患者,获取拔除的完整前磨牙或磨牙共计15颗。纳入标准:①患者无系统性疾病,口腔卫生状况良好;②牙齿无累及牙髓的病变;③牙齿根尖已发育完成。
根据Harms等[9]研究及我国年龄划分标准,本实验分为3组:A组患牙提供者≤18岁,共5例;B组19~59岁,共6例;C组≥60岁,共4例。
1.3 hDPSCs体外分离、培养与传代
牙齿拔除后立刻浸泡于含2%双抗的PBS溶液中,置于超净台,PBS充分冲洗血块等表面杂质,无菌纱布包裹,砸开牙齿,取出牙髓组织,胰酶、胶原酶联合处理,放入37 ℃、5%CO2孵箱培养,每3 d更换培养液。细胞从组织块中爬出,达到80%~90%融合后,37 ℃胰酶消化,按1∶3比例传代。倒置显微镜下观察各组原代和传代后细胞的形态。
1.4 hDPSCs表面抗原测定
选取第2代hDPSCs,以1×103个/μL密度置于EP管内,每管100 μL,在避光条件下分别加入抗体CD34-FITC、CD90-APC、CD73-PEcy、CD146-PE,4 ℃避光孵育30 min后,流式细胞仪上机检测。
1.5 成骨向分化诱导实验
提取第2代hDPSCs,以1×105个/孔密度接种于6孔培养板,A、B、C组均设置对照组及成骨诱导组。对照组常规培养液培养2周,每3 d换一次液。成骨诱导组常规培养液培养1 d后更换为成骨诱导液(α-MEM+10%FBS+2%双抗+10 mmol/L β-甘油磷酸钠+50 mg/L维生素C+10 nmol/L地塞米松),每3 d换一次液,培养2周。2周后PBS清洗各组细胞,4%多聚甲醛固定30 min,弃固定液。双蒸水清洗细胞3次,茜素红染色液染色10 min,双蒸水洗去残留染液,每孔加1 mL PBS,显微镜下观察矿化结节形成情况。镜下观察后,用10%氯化十六烷基吡啶溶解,置于脱色摇床上30 min,至矿化结节全部无色,将洗脱液转移至96孔板内,于酶标仪405 nm波长处测定OD值,实验重复3次取均值。
1.6 成脂向分化诱导实验
提取第2代hDPSCs,以1×105个/孔细胞密度接种于6孔培养板,每组均设置对照组及成脂诱导组。阴性对照组常规培养液培养3周,每3 d换一次液。成脂诱导组常规培养液培养细胞1 d后更换成脂诱导液(α-MEM+10%FBS+2%双抗+1 mg/mL胰岛素+0.5 mmol/L IBMX+0.2 mmol/L吲哚美辛+2 mmol/L地塞米松)。每3 d换一次液,诱导3周。3周后PBS清洗各组细胞,按油红O染色试剂盒说明书操作,4%多聚甲醛固定30 min,弃固定液。双蒸水冲洗3次,加入油红O染色工作液染色30 min,双蒸水冲洗2~3次后显微镜下观察脂滴形成情况。
1.7 细胞增殖实验
提取第4代hDPSCs,以1×103个/孔细胞密度接种于96孔培养板,每3 d换液,培养1周。分别于第1、3、5、7天加入CCK-8,加入2 h后分光光度计450 nm波长下测定OD值,实验重复3次取平均值。
1.8 成骨诱导下不同年龄组成牙/成骨矿化基因表达的差异
选取第4代hDPSCs进行实验,实验分为对照组和成骨诱导组,对照组采用常规培养基培养,成骨诱导组采用成骨诱导液培养,置于37 ℃、5%CO2培养箱培养7 d,每2~3 d换液。7 d后,RNA提取试剂盒提取总RNA,逆转录试剂盒合成cDNA。以cDNA为模板,荧光定量PCR检测牙本质涎磷蛋白(dentin sialophosphoprotein,DSPP)、骨钙素(osteocalcin,OCN)、核心结合因子α1(Runt-related transcription factor 2,RUNX2)、骨桥蛋白(osteopontin,OPN)、Ⅰ型胶原(collagen type Ⅰ,COL-1)。采用2-ΔΔCt法计算目的基因的相对表达量。引物由北京擎科生物有限公司合成,引物序列见表1。

表1 引物序列
1.9 统计学分析
用SPSS 23.0软件对数据进行统计学分析,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。实验数据用均值±标准差表示。P<0.05即差异有统计学意义。
2 结 果
2.1 hDPSCs体外分离、培养与传代
各年龄组hDPSCs贴壁后基本呈长梭形,胞体较大,胞核居中。其中C组细胞出现衰老征象:细胞拉长,多形性细胞增多,且细胞核溶解、破裂情况增多(图1)。患者年龄直接影响细胞爬出时间,随着年龄增长,细胞爬出所需时间更长,A组、B组与C组之间有明显统计学差异(P<0.05)(表2)。
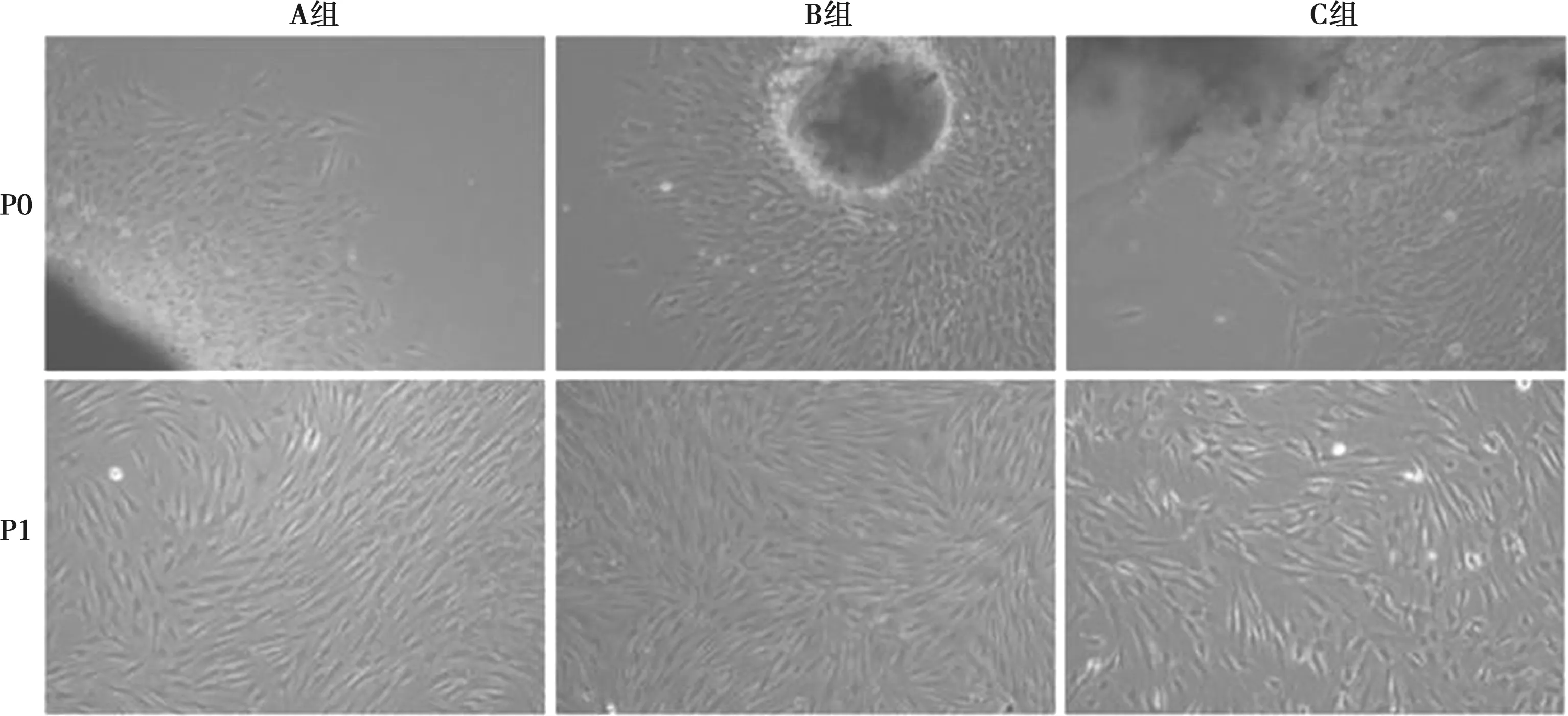
P0:原代细胞培养;P1:传代后的细胞

表2 各组细胞爬出时间比较
2.2 hDPSCs表面抗原测定
本研究将各组分离培养的hDPSCs培养扩增后,用荧光标记的流式抗体CD146-PE、CD90-APC、CD73-PEcy、CD34-FITC检测hDPSCs表面标志物的表达。结果发现,3组hDPSCs均高表达CD73、CD90(表达率>90%),低表达CD146(表达率<20%),不表达CD34(表达率<1%)(图2)。
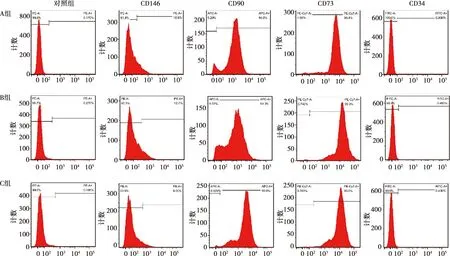
图2 各组牙髓干细胞表面抗原测定
2.3 成骨向分化诱导实验
茜素红染色大体观察发现各成骨诱导组染色均呈阳性,与对照组有明显差异(图3a)。倒置显微镜下观察发现,与对照组相比,各诱导组细胞均可见散在的、密度与大小不一的红色矿化结节。且年龄越大,矿化结节分布越松散、数量减少、单个结节面积减少(图3b)。茜素红半定量分析钙盐沉积量结果显示,3组hDPSCs经成骨诱导处理后, 细胞钙盐沉积量均显著高于相应对照组(P<0.05),而且随着年龄的增长,钙盐沉积量明显下降(P<0.05)(图3c)。
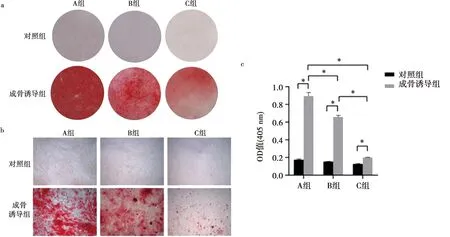
a:茜素红染色结果肉眼观;b:茜素红染色镜下观( ×4);c:茜素红半定量测定;*:P<0.05
2.4 成脂向分化诱导实验
各组细胞经3周成脂诱导液培养后油红O染色,倒置显微镜下观察均可发现明显的脂滴,与对照组有明显差异(图4)。此外,镜下观察显示C组较其余两组脂滴形成明显增多。
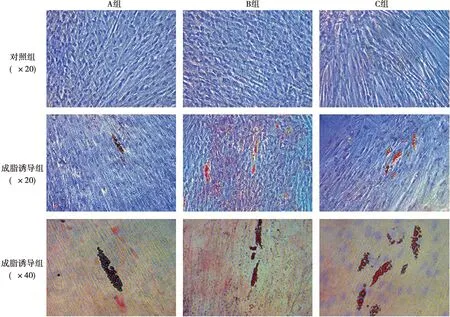
图4 油红O染色结果
2.5 细胞增殖实验
细胞生长的第1~5天,各组均具有较强的增殖能力,至第7天时生长基本进入平台期,甚至较第5天有所下降(图5)。第1天至第5天,各组间具有明显的差异(P<0.05)。第7天时,A、B两组增殖能力无明显差异,但C组增殖能力较其余两组明显下降(P<0.05)。
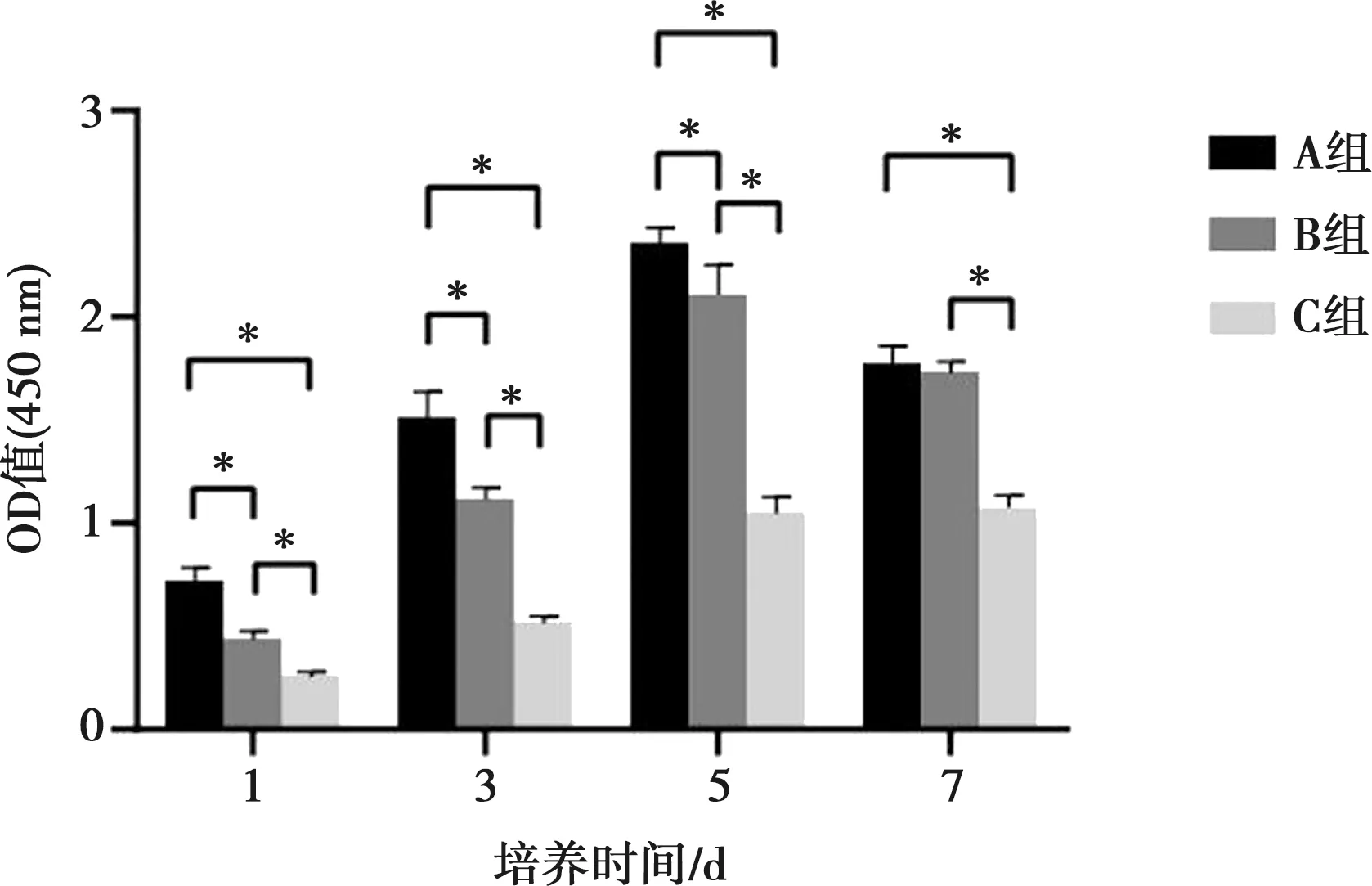
*:P<0.05
2.6 各组细胞成骨诱导下成牙/成骨基因表达情况
在成骨诱导液培养下,A、B组成骨诱导细胞DSPP、OCN、RUNX2、OPN mRNA的表达水平较对照组明显升高(P<0.05),COL-1 mRNA与对照组无明显差异(P>0.05);C组DSPP、OCN的表达水平较对照组明显上升(P<0.05),RUNX2的表达与对照组相比并无明显差异(P>0.05),OPN、COL-1的表达较对照组下降,差异有统计学意义(P<0.05)。见图6。
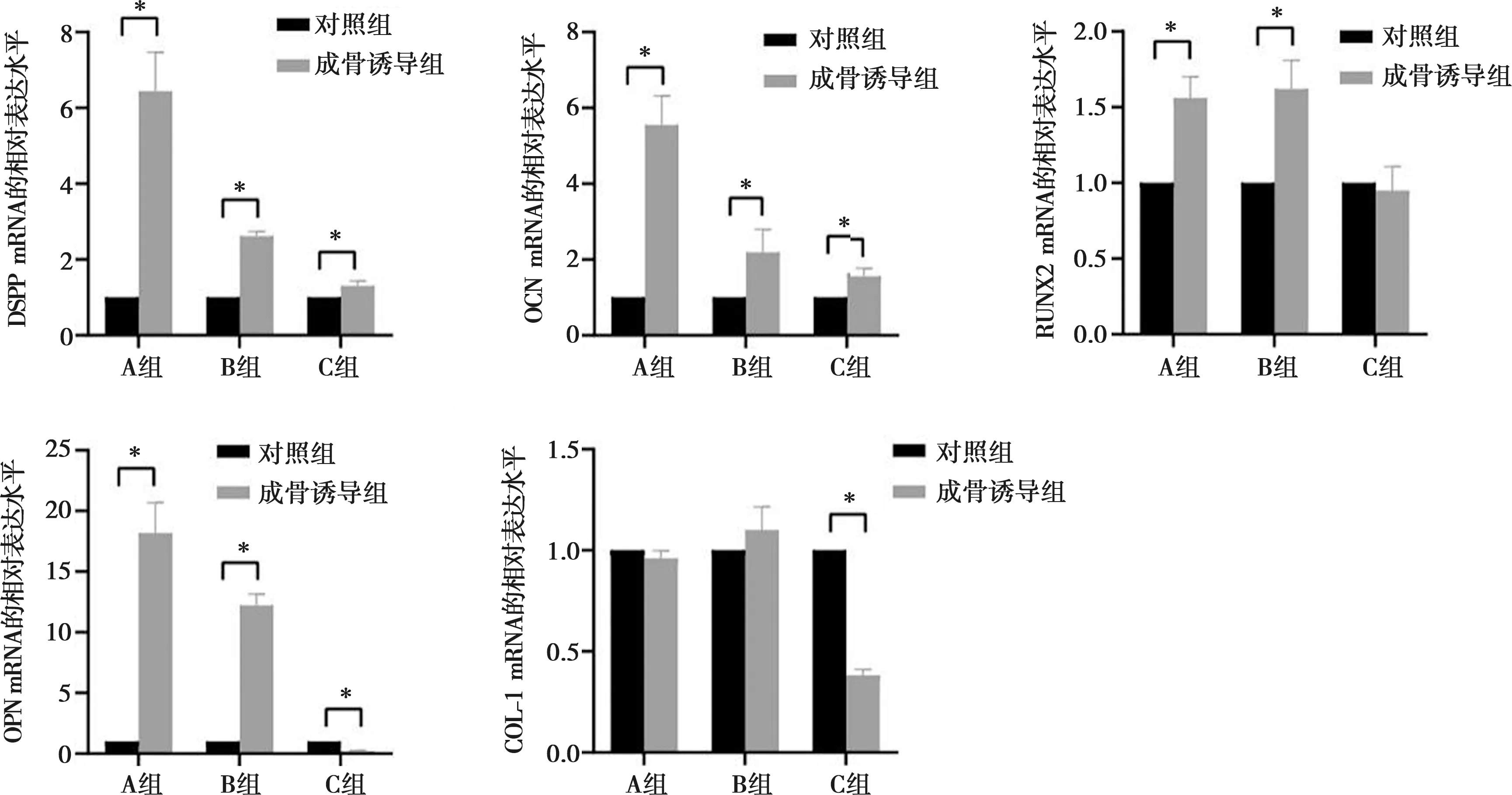
*:与对照组相比,P<0.05
3 讨 论
老年人群口腔保健意识较差,中重度牙周炎、根面龋发病率较高[10-11],牙齿拔除时牙髓大多已被炎症累及。另外,患者牙齿长期受到磨耗及生理或病理性刺激,大量反应性牙本质形成,髓腔缩窄甚至闭锁。这些均导致牙髓组织提取难度较大,使老年患者活髓保存治疗的相关研究受到一定限制。本研究中,60岁及以上患者4例,最高供体年龄76岁,均成功分离培养hDPSCs。
之前研究中将所有年龄的牙髓干细胞同等化,忽略了其增龄性的改变,具有局限性。因此,本实验将患牙按患者年龄阶段进行分组,以体现增龄性因素对hDPSCs生物学行为影响。
目前已有研究发现,乳、恒牙牙髓干细胞的免疫表型、周期分布等并无明显差异[12],提示乳、恒牙均可尝试活髓保存治疗。本研究中流式测定结果显示各组细胞高表达间充质干细胞(mesenchymal stem cell,MSC)表面标志物CD73、CD90(>90%),低表达血管内皮细胞标志物CD146(<20%),不表达造血干细胞标志物CD34(<1%),证实了各年龄组牙髓细胞确实为MSC,同时提示老年人hDPSCs也可以拥有良好的增殖和分化能力。
本研究中,各组hDPSCs均具有一定的增殖能力,并存在增龄性降低。老年人的牙髓组织中,细胞成分减少,纤维成分增加。并且随着年龄增加,成牙本质细胞发生退行性变,出现空泡、萎缩,细胞质内细胞器减少,严重时部分或全部细胞消失[13-14],最终导致细胞增殖减弱。Wu等[15]应用流式细胞术比较了不同年龄患者hDPSCs的分化能力,发现55~67岁组分化能力部分减弱。本研究发现年龄越大,成骨能力越低,60岁及以上患者hDPSCs虽然有一定的成牙/成骨向分化能力,但是明显较低年龄患者hDPSCs差,且形态欠佳。随着年龄增长,牙髓干细胞自我调节能力改变,最终导致丧失一部分生物学效能,机体抗氧化能力不断下降,体内氧自由基(reactive oxygen species,ROS)不断蓄积,使得细胞内氧化及抗氧化机制失调,从而导致细胞的生理生化和代谢功能障碍,诱发细胞衰老[16]。但是,牙髓干细胞衰老对其成牙/成骨向分化的具体影响机制尚缺乏研究。Bakopoulou等[17]证实Wnt/β-catenin信号通路的激活可提高牙髓干细胞RUNX2、COL-1等矿化基因的表达水平,促进其成骨向分化,而年龄增长引起的细胞应激增加导致叉头状转录因子O的激活,抑制Wnt/β-catenin信号通路的传导,最终抑制骨形成[18]。由此可以推测,Wnt/β-catenin信号通路的抑制可能是牙髓干细胞增龄性功能下降的重要原因之一。因此,临床上应用活髓保存治疗老年患者时需要更加谨慎。MTA、iRoot BP、Biodentine等改良生物活性盖髓材料的出现或将有助于增强老年人hDPSCs的增殖和分化能力,提高该人群活髓保存治疗的成功率,已有研究证实了它们对hDPSCs的增殖和成牙/成骨向分化能力具有明显的促进作用[19-21]。
虽然本研究中,60岁及以上患者hDPSCs成脂诱导后形成的脂滴明显较其余各组多,但这并不能说明其功能良好,可能是过多ROS引起脂肪代谢功能障碍,导致脂质过氧化,最终促成细胞损伤、衰老甚至死亡。p21、p53、pRb、p16是参与细胞衰老最重要的分子,已有大量实验证明,这些分子可直接或间接调控hDPSCs的衰老进程[22-26]。
本实验从细胞层面上为老年人牙髓的保存提供了参考,对于hDPSCs的衰老影响成牙/成骨向分化的具体机制以及机制的合理调控方法,仍有待于今后的进一步研究。
