宛氏拟青霉提取物诱导小白菜抗低温胁迫的作用机理
2022-03-11王庆彬刘治国彭春娥赵红玲王洪凤
王庆彬 刘治国 彭春娥 孟 慧 赵红玲 王洪凤 张 民
(1 山东农业大学资源与环境学院/土肥资源高效利用国家工程实验室,山东 泰安 271018;2 山东蓬勃生物科技有限公司,山东 泰安 271018;3 山东农业大学生命科学学院/作物生物学国家重点实验室,山东 泰安 271018;4 山东蓬创农业技术开发有限公司,山东 泰安 271018)
低温是限制植物生长发育的重要环境因素之一。近年来,极端气候频发,倒春寒和寒露风等低温灾害逐年增加[1]。低温胁迫导致植物膜脂过氧化、细胞结构变形、DNA损伤、蛋白质降解和生理代谢紊乱[2],最终导致植物生长缓慢和叶片边缘干燥,植株变色、枯萎、甚至死亡[3],严重影响蔬菜的产量和品质[4]。过氧化氢(H2O2)在低温胁迫中一方面作为一种信号因子,诱导作物体内抗氧化酶的活性[5],但另一方面过量积累的H2O2会导致丙二醛(malondialdehyde,MDA)含量增加,MDA积累越多,说明细胞膜受到的氧化损伤越重[6]。前人研究表明,冷害胁迫下,植物通过提高超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)和过氧化氢酶(catalase,CAT)等抗氧化酶活性进而加速活性氧自由基(reactive oxygen species,ROS)的清除,以减轻氧化损伤[7];通过提高低温响应途径[inducer of C-repeat-binding factor(CBF)expression(ICE)]诱导CBF启动冷响应基因(cold-responsive genes,COR)中相关基因的表达[8],来增加渗透调节物质的含量,保持细胞结构的稳定性[9];通过调控内源激素的含量[10],从而解除低温对植物生长的抑制作用,促进植物的生长。
小白菜(BrassicachinensisL.)又称不结球白菜、青菜,质地鲜嫩,富含矿物质和维生素,在我国、东南亚、日、美、欧洲等国家和地区广泛栽培和食用[11]。其中,春茬小白菜的经济效益最好,但品质和产量容易受到冬、春季低温的影响[12]。因此,提高冬、春季小白菜的耐寒性具有重要的研究意义。
前人研究发现外源施加100 μmol·L-1脱落酸[13]、1.25 mL·L-1壳寡糖[14]、1 mmol·L-1乙酰水杨酸[15]或4 mL·L-1多胺[16]等均可以增加低温胁迫下植物渗透调节物质的积累,提高抗氧化酶的活性,加速ROS的清除,在一定程度提高植物的抗寒性,但鲜见外源类物质在缓解小白菜低温胁迫方面的报道。前期研究表明,宛氏拟青霉提取物,又名“智能聪”(Zhi Neng Cong,ZNC)是一种活性极高的新型生物刺激素,提取自野生沙棘内生宛氏拟青霉菌菌丝体(菌种保藏号:CGMCCNO.10114),其主要成分包括小分子寡糖、氨基酸、嘧啶核苷、糖蛋白、多肽等促生物质[17],安全性高[18],在促进作物生长[19]、提高作物抗病[20]、抗逆性[21]、增加作物产量和品质[17]等方面具有显著作用。王晓琪等[22]研究发现,低温下使用0.1 μg·L-1ZNC就能有效提高水稻抗氧化酶活性,降低MDA含量,提高光合速率,缓解水稻受到的低温胁迫,使用浓度仅为腐殖酸、海藻提取物、聚谷氨酸等外源物质的1/40 000 000~1/260 000。本试验通过对小白菜叶片喷施不同浓度ZNC,探究ZNC对低温胁迫下小白菜生长的影响,以期为降低低温对蔬菜的危害提供有效的技术手段。
1 材料与方法
1.1 试验材料
供试ZNC由山东蓬勃生物科技有限公司提供;供试小白菜品种为黄秧小白菜,购自江西省玉丰种业有限公司。
1.2 试验方法
试验在山东蓬勃生物科技有限公司人工气候室内进行。小白菜种子用5%的次氯酸钠消毒5 min,充分震荡,再用无菌水冲洗干净,然后置于4℃冰箱中春化2 d。播种前先将蛭石灭菌,充分混匀装入花盆,表面平整,放入托盘,托盘底部缓慢加入1/2 Hoagland营养液至花盆内蛭石表面湿润。然后选取饱满的小白菜种子于2019年10月9日均匀播撒到花盆中,每盆4粒,埋深0.5 cm,每个处理5盆,于光照培养室(温度22℃,光照强度80 μmol·m-2·s-1,光照12 h,黑暗12 h)内培养至幼苗长至4片真叶。2019年11月29日进行5种不同处理,包括4个4℃低温处理:Z0(叶喷清水)、Z1(叶喷20 ng·mL-1ZNC)、Z2(叶喷30 ng·mL-1ZNC)、Z3(叶喷40 ng·mL-1ZNC),以及1个22℃常温处理(CK)。每个处理设置3次重复,使用50 mL喷壶对每个处理喷20 mL对应浓度的ZNC或清水,待叶片表面无水迹后进行低温处理,处理4 d后取样进行各指标的测定。
1.3 测定项目与方法
1.3.1 SPAD值、小白菜株高、地上部鲜重测定 低温处理4 d后,每个处理选取20株大小均匀的小白菜,用SPAD-502 PLUS植物叶绿素仪(日本KONICA MINOLTA公司)测量SPAD值,用游标卡尺(德国Meinaite公司)测量根茎基部到叶片最顶端的株高,切除根部,用万分之一天平(上海舜宇恒平科学仪器有限公司)称量地上部鲜重。
1.3.2 小白菜叶片H2O2含量和MDA含量测定 称取0.5 g不同处理小白菜新鲜叶片,参考Velikova等[23]的方法测定H2O2含量,使用硫代巴比妥酸法[24]测定MDA含量。
1.3.3 小白菜叶片抗氧化酶活性测定 称取0.5 g不同处理小白菜新鲜叶片,使用氮蓝四唑(NBT)法测定鲜样小白菜叶片SOD活性,采用愈创木酚法测定POD活性,采用紫外分光光度法测定CAT活性[25]。
1.3.4 小白菜叶片渗透调节物质含量测定 称取0.5 g不同处理小白菜新鲜叶片,采用茚三酮比色法测定鲜样小白菜叶片游离脯氨酸含量,采用考马斯亮蓝G-250法测定可溶性蛋白含量[26]。
1.3.5 抗寒相关基因表达量检测 取不同处理小白菜的第3片功能叶,液氮研磨,保存于-80℃环境。称取100 mg样品使用Biospin多糖多酚植物总RNA提取试剂盒(杭州博日科技股份有限公司)提取叶片总RNA,按照RNA反转录试剂盒(日本TaKaRa公司)说明书的试验步骤合成cDNA第一链。参考文献[27]获得小白菜内参基因及冷调控相关基因BrICE1、BrCBF、BrCOR14的实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)引物序列(表1),引物由上海生工生物科技有限公司合成。以cDNA第一链为模板,使用MonAmpTMFast SYBR©Green qPCR Mix试剂(苏州莫纳生物科技有限公司),在CFX96 Touch实时荧光定量PCR仪(美国Bio-Red公司)上进行目标基因表达水平的检测。qRT-PCR程序按照MonAmpTMFast SYBR©Green qPCR Mix使用说明设置。试验共进行3次生物学重复,每次生物学重复设置3次技术重复。采用2-ΔΔCt方法[28]计算相对表达水平。
1.3.6 小白菜叶片激素含量测定 使用高效液相色谱-20A(SHIMADZU公司,日本)测定吲哚乙酸(indoleacetic acid,IAA)、赤霉素(gibberellic acid,GA)、水杨酸(salicylic acid,SA)和脱落酸(abscisic acid,ABA)的含量。
1.4 数据分析
采用Excel 2016进行数据处理及作图,SPSS 22进行单因素方差分析(One-way ANOVA)。
2 结果与分析
2.1 不同浓度ZNC对低温胁迫下小白菜株高及地上部鲜重的影响
由表2可知,低温胁迫影响小白菜光合色素含量,抑制小白菜生长,与CK相比,低温处理(Z0)小白菜叶片SPAD值降低26.02%,株高降低17.26%,地上部鲜重降低29.48%。而喷施不同浓度ZNC处理的Z1、Z2、Z3,SPAD值较Z0分别显著上升17.50%、19.50%、22.31%;株高升高6.44%、10.47%、10.13%;地上部鲜重显著升高20.69%、27.59%、26.72%。说明不同浓度ZNC处理均能显著增加低温胁迫下光合色素含量,提高小白菜株高和地上部鲜重。

表2 低温胁迫下ZNC处理对小白菜SPAD值及生物量的影响Table 2 Effects of ZNC on the SPAD and biomass in pakchoi under cold stress
2.2 不同浓度ZNC对低温胁迫下小白菜抗氧化酶活性的影响
由图1可知,与CK相比,低温胁迫(Z0)下小白菜的SOD活性提高31.07%,POD和CAT活性分别降低16.34%和17.44%;而低温胁迫下喷施不同浓度ZNC均显著提高了小白菜SOD、POD和CAT的活性,其中SOD活性分别提高24.58%、29.41%、25.29%,POD活性分别提高66.89%、69.37%、80.52%,CAT活性分别提高140.83%、153.48%、162.34%。表明ZNC可通过提高低温下抗氧化酶活性加速小白菜活性氧的清除。
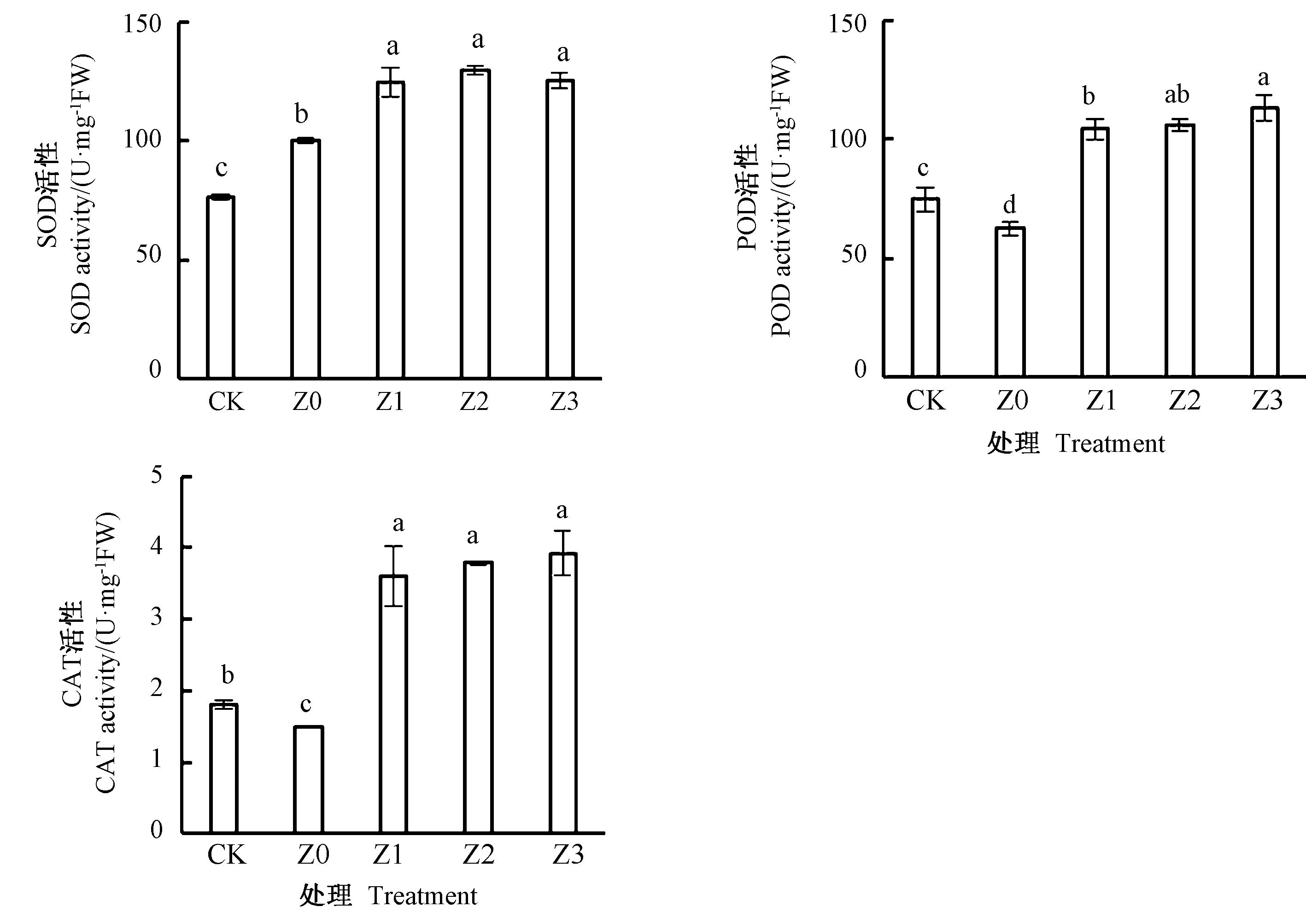
注:不同小写字母表示处理间差异显著(P<0.05)。下同。Note: Different lowercase letters indicate significant difference at 0.05 level among treatments. The same as following.图1 低温胁迫下ZNC处理对小白菜抗氧化酶活性的影响Fig.1 Effects of ZNC on the autioxidant enzyme activities in pakchoi under cold stress
2.3 不同浓度ZNC对低温胁迫下小白菜H2O2和MDA含量的影响
由图2可知,与CK相比,Z0小白菜的H2O2和MDA含量显著升高52.05%和68.43%,说明低温胁迫下小白菜细胞膜正在遭受氧化损伤。Z1、Z2和Z3的H2O2含量分别较Z0显著降低17.90%、23.69%、21.06%,MDA含量分别显著降低19.95%、28.07%、28.91%,说明叶喷ZNC能够通过降低H2O2和MDA的积累缓解低温导致的白菜细胞膜氧化损伤。
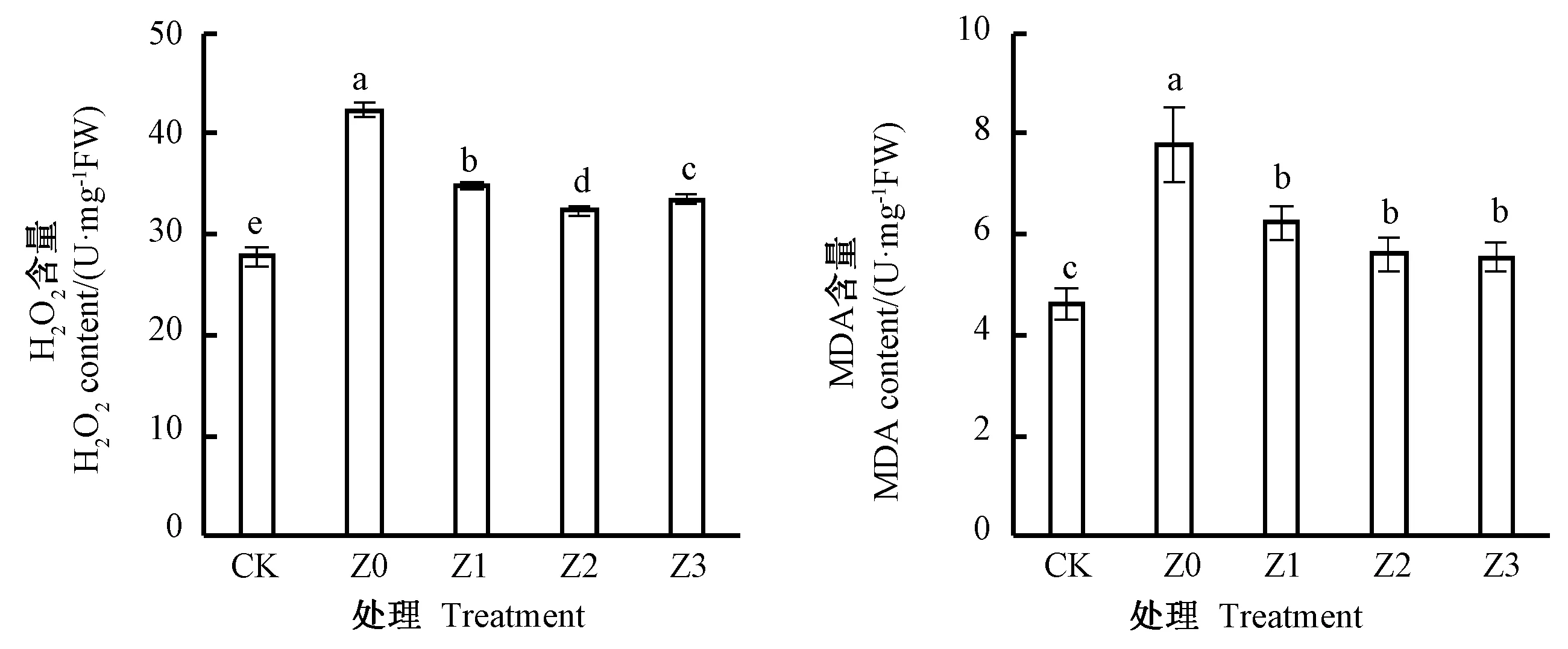
图2 低温胁迫下ZNC处理对小白菜H2O2和MDA含量的影响Fig.2 Effects of ZNC on the H2O2 and MDA content in pakchoi under cold stress
2.4 不同浓度ZNC对低温胁迫下小白菜冷调控相关基因表达的影响
由图3可知,低温胁迫(Z0)处理4 d后BrICE1基因无显著变化,但BrCOR14和BrCBF基因的相对表达量分别较CK显著上调114.43和22.13倍。喷施不同高浓度ZNC后,Z1、Z2和Z3小白菜BrICE1基因的相对表达量较Z0仍无显著变化,但BrCOR14和BrCBF基因的相对表达量进一步提高,BrCOR14的相对表达量分别提高42.56%、49.31%和56.81%,BrCBF的相对表达量分别提高21.98%、33.13%和28.09%。说明低温处理下ZNC通过提高冷调控相关基因BrCOR14和BrCBF的表达使小白菜抗寒性增强。

图3 低温胁迫下ZNC处理对小白菜冷调控相关基因的影响Fig.3 Effects of ZNC on the genes related to cold regulation in pakchoi under cold stress
2.5 不同浓度ZNC对低温胁迫下小白菜渗透调节物质的影响
由图4可知,低温胁迫下小白菜可溶性蛋白和脯氨酸等渗透调节物质含量升高,喷施ZNC后积累量进一步增加。与CK相比,Z0小白菜的可溶性蛋白含量和脯氨酸含量分别显著增加35.94%、7.32%,Z1、Z2和Z3的可溶性蛋白含量较Z0增加49.55%、61.38%和63.80%,脯氨酸含量增加15.91%、6.25%和5.11%。说明ZNC可通过增加小白菜渗透调节物质的积累缓解其受到的低温胁迫。

图4 低温胁迫下ZNC处理对小白菜渗透调节物质含量的影响Fig.4 Effects of ZNC on the osmotic regulating substance content in pakchoi under cold stress
2.6 不同浓度ZNC对低温胁迫下小白菜内源激素的影响
由图5可知,低温和ZNC处理显著影响小白菜叶片中内源激素含量。与CK相比,Z0小白菜叶片中的IAA含量降低88.72%,ABA含量升高329.90%,GA含量降低91.04%。与Z0相比,Z1、Z2和Z3叶片中促进小白菜生长相关的激素含量显著升高,其中IAA含量分别升高606.07%、453.57%、451.79%,GA含量分别显著升高620.96%、750.27%、682.12%;抑制小白菜生长的激素ABA含量显著降低56.83%、73.62%、70.02%。因此,低温胁迫下,喷施ZNC后小白菜叶片的(GA+IAA)/ABA比值显著增加。说明ZNC可通过调节小白菜内源激素含量促进小白菜低温下生长。

图5 低温胁迫下ZNC处理对小白菜内源激素含量的影响Fig.5 Effects of ZNC on the endogenous hormone content in pakchoi under cold stress
3 讨论
本研究发现喷施20 ng·mL-1的ZNC就能显著降低低温对小白菜造成的损伤,浓度仅为ABA的1/1 300[13], 壳寡糖的1/62 500[14],乙酰水杨酸的1/9 000[15], 多胺的1/200 000[16]。极低的使用浓度意味着更低的成本,便于ZNC在实际农业中推广应用。但本试验使用的ZNC浓度与王晓琪等[22]在水稻中应用的浓度不同,推测可能是由于作物本身差异和处理时期及处理方法不同导致的,ABA在缓解小麦[13]和百慕大草[6]低温胁迫时使用浓度也不同。
植物干物质积累量的90%来自于光合作用[29],低温会造成植物光抑制,导致叶绿素含量降低,光合作用减弱,进而抑制植物生长[30],降低产量和品质。本研究发现,低温处理后的小白菜叶片SPAD值显著降低26.02%,株高和地上部鲜重也显著降低,说明低温导致小白菜光合色素降解,进而影响其光合速率和生长,这与岳俊芹等[31]在小麦中的研究结果相似。而喷施ZNC后小白菜SPAD值、株高和地上部鲜重较低温处理总体显著升高,说明ZNC在低温条件下能有效保持小白菜中光合色素含量,一定程度上维持正常光合作用供应植物生长,与王晓琪等[21]的研究结果一致。
本研究发现,与CK相比,低温处理后小白菜SOD活性升高,POD和CAT活性降低,推测可能由于长期的低温胁迫导致蛋白结构的破坏,抑制了酶的活性[32],降低了H2O2的清除能力;且低温处理4 d时H2O2含量处于较高水平,说明小白菜正遭受氧化损伤[33]。喷施ZNC的小白菜叶片内SOD、POD、CAT活性较低温处理显著升高,H2O2含量显著降低,说明ZNC可通过提高低温胁迫下抗氧化酶的活性加速小白菜中多余H2O2的清除,缓解小白菜受到的氧化损伤。MDA含量通常被认为是膜结构完整性的指标[34]。本研究中,低温处理后MDA含量显著增加,说明此时植物细胞膜流动性降低。喷施ZNC后MDA积累量显著降低,说明ZNC有效缓解了脂膜过氧化程度,维护了膜结构的稳定性,这与马晓寒等[35]在低温下对烟草使用茉莉酸甲酯降低烟草内MDA含量的结果一致。
在前人对ZNC提高植物冷胁迫研究的基础上,本研究进一步揭示了ZNC可通过ICE-CBF-COR冷响应通路提高小白菜耐寒能力的分子机理。ICE-CBF-COR冷响应通路是提高植物抗寒性最重要的分子通路之一[8]。该通路中碱性螺旋-环-螺旋(basic helix-hoop-helix,bHLH)家族诱导表达因子(inducer of CBF expression,ICE)能够感受冷信号[36]。本研究发现,低温下喷施ZNC对白菜内BrICE1的表达量影响不显著,说明ZNC并未影响小白菜对冷信号的感应。但低温下喷施ZNC显著提高了受BrICE1诱导的C-重复区结合因子(CRT-binding factors,CBF)BrCBF基因的相对表达。BrCBF表达后,将促进冷调节基因(cold-regulated genes,COR)启动子区顺式作用元件被结合[37],以此激活BrCOR14基因的大量表达[38];而BrCOR14基因表达量的提高有利于渗透调节物质生物合成关键酶含量的增加,进而促进可溶性蛋白和脯氨酸等渗透调节物质的积累[39],低温下渗透调节物质的积累不仅能够提高细胞渗透势,防止细胞过度失水,还可以调节膜的运输能力,降低组织受到的低温损伤,稳定细胞器结构[40]。本研究结果表明,低温下喷施ZNC显著增加了小白菜中可溶性蛋白和脯氨酸的积累,提高了其抗寒性,这与项洪涛等[41]利用ABA提高水稻抗寒性的研究结果类似。
植物激素是植物抵抗逆境胁迫,调控植物生长的关键因素[42]。前人研究表明,低温胁迫下,植物可通过降低GA和IAA含量,提高ABA含量来提高抗寒性,但同时抑制了生长[43]。本研究结果表明,低温胁迫下,小白菜叶片中GA和IAA含量显著降低,ABA含量显著增加,显著降低了(GA+IAA)/ABA比值,说明低温胁迫通过改变小白菜内源激素含量抑制了小白菜生长,这与许耀照等[44]的研究结果一致。叶喷20~40 ng·mL-1ZNC显著增加了小白菜叶片中GA和IAA含量,降低了ABA含量,增加了(GA+IAA)/ABA比值,与前人使用亚精胺、精胺和5-氨基乙酰丙酸提高植物耐低温性的效果类似[45-46]。说明ZNC处理提高了小白菜抗低温能力,使小白菜的激素代谢趋于正常,缓解了低温对小白菜生长的抑制作用。
4 结论
研究结果表明,ZNC通过多路径来提高小白菜的抗冷害能力,通过提高抗氧化酶活性和加速清除ROS来降低低温对小白菜细胞膜造成的氧化损伤;通过增强低温响应通路ICE-CBF-COR响应来增加渗透调节物质积累以保持细胞结构稳定;最后通过提高(GA+IAA)/ABA比值来促进小白菜生长。综上可知,叶喷20~40 ng·mL-1ZNC可有效缓解小白菜受到的低温胁迫,促进其在低温下的生长。
