硝酸还原酶基因启动子NRE2元件缺失对烟草氮代谢的影响
2022-03-11叶歌斐汪海燕张玉宁杨铁钊武兆云杨惠娟
党 伟 李 茜 叶歌斐 汪海燕 张玉宁 杨铁钊 武兆云 杨惠娟,*
(1 河南农业大学国家烟草栽培生理生化研究基地,河南 郑州 450002;2 浙江中烟工业有限责任公司,浙江 杭州 310000; 3 浙江大学农业与生物技术学院,浙江 杭州 310000; 4洛阳市烟草公司宜阳县分公司,河南 宜阳 471000)
植物主要以无机氮(NO3--N、NH4+-N)为氮源,其中植物最易吸收的是硝态氮(NO3--N)。NO3-在叶片中通过无机氮的还原同化途径,合成植物生长发育所需的含氮化合物,如氨基酸、核苷酸、多肽等[1]。研究表明,NO3-不仅是植物氮同化的代谢底物,同时也是一种信号分子[2]。一方面,NO3-是植物感应外界氮营养变化的关键信号分子;另一方面,NO3-对植物体内部分生长发育相关的基因具有重要的调节作用,影响植物生长发育、根系形态建成等[3]。这类基因最显著的表达调控特征是可以迅速受到NO3-的诱导,不依赖于蛋白质的从头合成,因而被称为NO3-初级响应基因[4],其中包括硝酸还原酶基因(nitrate reductase,NIA)。硝酸还原酶(nitrate reductase,NR,EC 1.6.6.1)是氮代谢途径中的第一个关键酶和限速酶,可将NO3-还原成NO2-。刘丽等[5]研究发现硝酸还原酶的合成和降解受到一系列复杂调控机制的调节,其表达受到光、NO3-、蔗糖等外界因素的诱导以及氮代谢产物如谷氨酰胺(Gln)等的反馈抑制。
顺式作用元件是启动子中的一段特异序列,通过与相应的转录因子结合,特定地促进或抑制基因的转录[6]。对启动子及其顺式作用元件进行研究,既可以在分子层面探究功能基因的诱导表达机制,又可以利用启动子为作物遗传改良提供新的思路[7]。研究发现在拟南芥[8]、枳[9]、菠菜[10-11]等多种植物的亚硝酸还原酶基因(Nitrite reductase,NIR)启动子中都存在一个保守的长度为43 bp的NO3-响应顺式作用元件(nitrate-responsive cis-element,NRE),其核心序列为GACCCTT-N(9-10)-AAG,该序列参与调控NO3-介导的信号转导途径。研究发现NO3-信号可以激活根瘤感受基因类似蛋白(NIN-like proteins, NLPs),NLPs蛋白可以与NIA1基因下游3′端的NRE元件以及NIR1基因启动子序列中的NRE元件结合,调控NIA1和NIR1基因的表达[12]。Wang等[13]使用小球藻NIA基因启动子驱动β-葡萄糖苷酸酶(β-glucuronidase,GUS)基因表达,发现GUS基因表达水平在NO3-条件下显著增加,在NH4+条件下显著降低。同时,在杜氏盐藻[14]的研究中也有类似的结果。以上研究表明烟草NIA基因启动子中可能存在NO3-响应元件NRE。
本研究前期利用生物信息学技术在烟草NIA1和NIA2基因启动子序列中发现一个GACCCTA-N(10)-AAG的核心序列,暂命名为NRE2元件(表1),与菠菜和拟南芥相比,该元件在5′端第7个碱基处发生突变,碱基T被替换为碱基A,导致GUS报告基因表达量降低[15]。在此基础上,本研究采用CRISPR/Cas9基因编辑技术获得烟草NIA1基因和NIA2基因启动子中NRE2元件缺失的转基因阳性植株,对烟叶氮代谢相关指标进行测定,研究硝酸还原酶基因启动子NRE2元件在烟草植株生长发育中的功能,以期为选育低硝酸盐含量的烟草新品种提供理论依据。

表1 烟草及其他物种NIR基因启动子NRE元件与烟草NIA基因启动子NRE2元件序列对比Table 1 Sequence comparison of NRE element of NIR gene promoter and NRE2 element of gene promoter in tobacco and other species
1 材料与方法
1.1 试验材料与试剂
普通栽培烟草K326种子由河南农业大学烟草栽培生理实验室提供。农杆菌(Agrobacteriumtumefaciens)菌株LBA4404为河南农业大学烟草栽培生理实验室保存菌株;Murashig-Skoog营养液(Murashig and Skoog Medium,MS)配制参考《植物生理学实验指导》[16];DNA marker购自北京Biomed公司;限制性内切酶购自大连TaKaRa公司;植物基因组DNA提取试剂盒购自成都FOREGENE公司;质粒提取试剂盒购自德国Qiagen公司;特异性引物由郑州擎科生物公司合成;硝酸还原酶活性和亚硝酸还原酶活性检测试剂盒购自苏州科铭生物技术有限公司。
1.2 仪器与设备
AA3型连续流动化学分析仪,德国BRAN LUEBBE公司;ZHWY-200H型恒温培养振荡器,上海智城分析仪器制造有限公司;Mastercycler pro型常规梯度PCR仪,德国Eppendorf公司;DYY-6C型电泳仪,北京市六一仪器厂;SPARK 10M型酶标仪,瑞士TECAN公司。
1.3 试验方法
1.3.1 gRNA设计及载体构建 在NCBI数据库(https://www.ncbi.nlm.nih.gov/)中搜索和下载NIA1(GenBank ID:X14058.1)和NIA2(GenBank ID:X14059.1)基因的ATG上游启动子序列,使用在线分析工具CRISPR-P(http://crispr.hzau.edu.cn/CRISPR2/)在NRE2元件附近选择合适的靶点,并设计编辑位点(表2)。重组CRISPR/Cas9敲除载体由河南农业大学烟草栽培生理实验室构建。

表2 用于NIA1和NIA2基因启动子中NRE2元件敲除的gRNA寡聚核苷酸序列及附近序列Table 2 The gRNA oligonucleotide sequence and nearby sequences for knockout of the NRE2 element in the promoters of NIA1 and NIA2 genes
1.3.2 农杆菌转化 采用冻融法[17]将载体导入根癌农杆菌LBA4404感受态细胞中,在不含抗生素的农杆菌YEB培养基(yeast mannitol medium)中28℃、220 r·min-1振荡培养2~3 h,5 000 r·min-1离心1 min收集菌体。重悬后,将菌液均匀涂布在含有抗生素的YEB培养基(含50 mg·mL-1Kana,100 mg·mL-1Strep,50 mg·mL-1Rif)中,28℃恒温倒置培养48~72 h;挑取单菌落振荡培养并提取质粒,利用限制性内切酶Pml Ⅰ和Apa Ⅰ进行双酶切鉴定,获得可用于遗传转化的重组农杆菌。
1.3.3 转基因阳性植株的获得 采用农杆菌介导的叶盘法[18]转化烟草。侵染后,用滤纸吸去叶盘表面的残留菌液,在MS培养基中暗培养2~3 d。之后用头孢溶液清洗叶盘,并转移至选择培养基(MS+0.15 mg·mL-1NAA+1 mg·mL-16-BA+0.5 mg·mL-1Cef+8 μg·mL-1Hyg)上进行筛选,每7 d更换一次培养基。当愈伤组织分化成芽时,将芽移至生根培养基中(1/2MS+0.15 mg·mL-1NAA+0.5 mg·mL-1Cef+30 μg·mL-1Kana+8 μg·mL-1Hyg)。当烟苗长至五叶一心时进行缓苗处理,后移植到育苗盆中并置于光照培养架上培养。按烟草专用肥∶水=1∶3的比例对烟株施肥,每周施肥一次。获得的烟草NIA1、NIA2启动子NRE2元件缺失的单突变体品系命名为△NIA1、△NIA2,双突变体品系命名为△NIA1+2。
1.3.4 转基因植株的阳性鉴定 以T0代烟草叶片基因组DNA为模板,依次用潮霉素磷酸转移酶基因(hygriomycin phosphotransferase,HYG)和Cas9(CRISPR-associated nucle-ase9)基因的特异性引物进行PCR扩增和琼脂糖凝胶电泳检测。PCR扩增引物及扩增程序分别如下:
HYG正向引物:5′-G C T C C A T A C A A G C C A A C C A C G-3′
HYG反向引物:5′-C C T G C C T G A A A C C G A A C T G C-3′
扩增程序:94℃预变性3 min;94℃变性45 s,56℃退火45 s,30个循环;72℃延伸2 min,4℃保存。
Cas9正向引物:5′-G A G G T C G T G A A G A A G A T G A A G A A-3′
Cas9反向引物:5′-G G T C A G G G T A A A C A G G T G G A T-3′
扩增程序:94℃预变性3 min;94℃变性45 s,58℃退火45 s,30个循环;72℃延伸2 min,4℃保存。
1.4 测定项目与方法
在T0代烟株最大功能叶片长至18 cm左右时,摘取中部烟叶并分成两份,一份于液氮中速冻后保存于-80℃冰箱中,用于NR和NiR活性测定;另一份在杀青后将其磨碎过60目筛,用于叶中NO3-、NO2-和总氮含量测定。每种基因型分别选取5株长势一致的烟苗进行测定。
NR和NiR活性利用检测试剂盒在酶标仪上测定;总氮含量在连续流动分析仪[19]上测定。叶中硝酸盐含量采用浓硫酸-水杨酸比色法测定,亚硝酸盐含量采用磺胺—α-萘胺法测定[20]。
1.5 数据分析
试验数据用Excel 2016和SPSS Statistics 23软件分析,采用LSD法和Duncan法进行差异显著性检验,显著水平为0.05,结果用平均值±标准差表示。
2 结果与分析
2.1 NRE2元件敲除靶位点的gRNA设计及载体构建
利用NCBI数据库获得NIA1和NIA2基因的ATG上游序列和2个NIA基因启动子的同源序列,通过在线分析工具CRISPR-P在NRE2元件附近的PAM区设计了敲除载体的gRNA寡聚核苷酸序列。在CRISPR/Cas9载体的At U6 启动子和Pol Ⅲ终止子之间插入gRNA片段后,获得用于敲除NIA1和NIA2基因启动子中NRE2元件的单敲除载体与双敲除载体(NIA1-Cas9-gRNA、NIA2-Cas9-gRNA、NIA1/NIA2-Cas9-gRNA)。重组CRISPR/Cas9载体结构如图1所示。

图1 重组CRISPR/Cas9敲除载体结构示意图Fig.1 Schematic diagram of recombinant CRISPR/Cas9 knockout vector structure
2.2 转化农杆菌阳性鉴定与T0代转基因K326烟株检测
2.2.1 转化农杆菌阳性鉴定 利用琼脂糖凝胶电泳对PCR扩增产物进行鉴定,得到1 430 bp的序列片段,结果如图2所示。表明重组CRISPR/Cas9载体已经成功转入农杆菌LBA4404菌株内。
注:M:DL2000 DNA 标记。1~3、4~6、7~9分别为重组载体NIA1-Cas9-gRNA、NIA2-Cas9-gRNA、NIA1/NIA2-Cas9-gRNA的农杆菌菌落双酶切产物。Note: M: DL2000 DNA Marker. 1~3, 4~6 and 7~9 are the double digestion products of Agrobacterium colonies of recombinant vectors NIA1-Cas9-gRNA, NIA2-Cas9-gRNA, NIA1/NIA2-Cas9-gRNA, respectively.图2 重组CRISPR/Cas9载体双酶切电泳图Fig.2 Double enzyme digestion electrophoresis diagram of recombinant CRISPR/Cas9 vector
2.2.2 T0代转基因K326烟株检测 由图3和图4可知,从再生烟苗中扩增得到425 bp的HYG基因片段和1 329 bp的Cas9基因片段,表明构建的重组CRISPR/Cas9基因敲除质粒已成功转入K326 植株中。
注:M: DL 2000 DNA Maker;1~5:△NIA1突变体品系;6~10:△NIA2突变体品系;11~15:△NIA1+2突变体品系。Note: M: DL 2000 DNA Maker. 1~5: △NIA1 mutant strain. 6~10: △NIA2 mutant strain. 11~15: △NIA1+2 mutant strain.图3 转基因烟苗的HYG基因阳性鉴定电泳图Fig.3 Electrophoresis of HYG gene positive identification of transgenic tobacco seedlings
注:M: DL 2000 DNA Maker;1~5:△NIA1突变体品系;6~10:△NIA2突变体品系;11~15:△NIA1+2突变体品系。Note: M: DL 2000 DNA Maker. 1~5: △NIA1 mutant strain. 6~10: △NIA2 mutant strain. 11~15: △NIA1+2 mutant strain.图4 对HYG基因鉴定为阳性的转基因烟苗的Cas基因鉴定电泳图Fig.4 Cas gene identification electrophoresis of transgenic tobacco seedlings identified as positive for HYG gene
2.3 烟叶硝酸还原酶活性和亚硝酸还原酶活性
由表3可知,NIA1和NIA2基因启动子序列中的NRE2元件被敲除后,与野生型K326相比,突变体△NIA1、△NIA2和△NIA1+2的NR活性分别下降了18.8、25.6和18.1个百分点。△NIA1和△NIA1+2的NiR活性与野生型相比分别升高了2.2和0.2个百分点,△NIA2的NiR活性相比野生型下降了16.6个百分点。
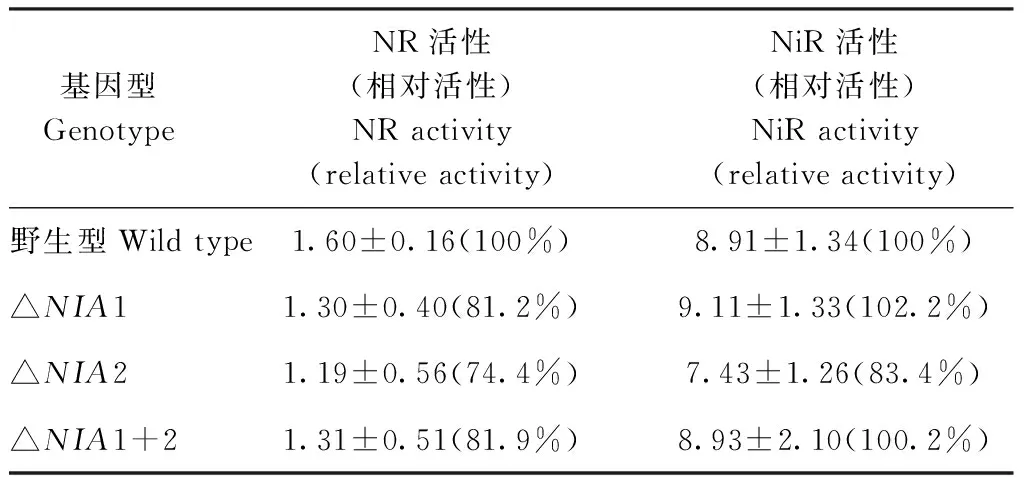
表3 不同基因型烟苗的叶中硝酸还原酶活性和亚硝酸还原酶活性Table 3 Nitrate reductase activity and nitrite reductase activities in leaves of different genotypes of tobacco seedlings /(μmol·h-1·g-1)
2.4 烟叶中硝酸盐、亚硝酸盐和总氮含量

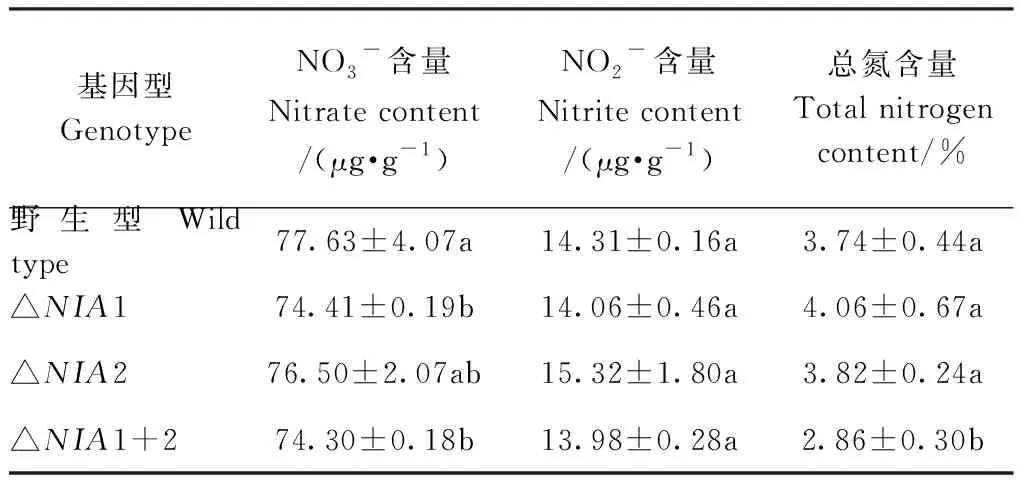
表4 不同基因型烟苗的叶中硝酸盐(NO3-)、亚硝酸盐(NO2-)和总氮含量Table 4 Nitrate (NO3-), Nitrite (NO2-) and Total nitrogen contents in leaves of different genotypes tobacco seedlings
3 讨论
本研究采用CRISPR/Cas9技术敲除烟草NIA基因启动子中的NRE2元件后,与野生型相比,突变体叶片的NR活性与NO3-含量出现不同程度的降低(表3、表4),表明NRE2元件与烟叶NR活性有关,该结果与Gao等[21]发现水稻OsNR2基因表达水平降低会引起叶片NR活性与NO3-积累量降低的结果相一致,说明NRE2元件可能参与调控烟草NIA基因的转录。
亚硝酸还原酶(NiR)是硝酸盐同化途径中的第二个关键酶,可将NO2-进一步还原成NH4+,以供给植物进行氮素同化[1]。在本试验中,转基因烟草植株叶片的NR活性与野生型相比下降了18.1~25.6个百分点,但NiR活性和NO2-含量与野生型相比仍保持在较高水平,这种现象与拟南芥[22]、豌豆[23]、烟草[24]、大麦[25-26]等植物的研究结果一致,表明NRE2元件的缺失对NO2-还原过程无明显影响。
植株全氮含量相对稳定,可以很好地反映作物氮素营养状况[27]。本研究中,单敲除突变体的叶中总氮含量与野生型相比无显著差异,双敲除突变体的总氮含量与野生型相比显著降低,表明单敲除突变体的氮素营养状况正常,植株能够正常生长,双敲除突变体则与之相反。该结果与Warner等[25]和Wilkinson等[28]发现硝酸还原酶单突变体能够在以NO3-为唯一氮源的培养条件下正常生长,而硝酸还原酶双突变体却不能正常生长的结果相一致。推测敲除掉一个NIA基因启动子的NRE2元件,不影响突变体对氮素的同化利用;当完全敲除掉NRE2元件后,将降低烟株对硝酸盐的吸收同化能力,导致氮素营养不足。
与野生型相比,单敲除突变体的NR活性低、NO3-积累量少,但总氮含量之间差异不明显,表明单敲除突变体烟草植株可能会通过其他途径补偿因氮素吸收同化能力下降而导致的氮素营养不足。已有研究表明,使用钨酸盐处理烟草植株,导致植株体内NR活性降低,但NR-mRNA持续高表达,NR蛋白水平大幅提高[29]。结合Scheible等[30]和Signore等[31]的研究结果认为,造成本试验中单敲除突变体的总氮含量与野生型一致的原因可能是:其一,突变体根系NR活性被诱导增加,即NR活性降低的突变体可以通过改变根部NR的调节来补偿,而且在黑暗中的硝酸盐还原同化能力比野生型更强,同化产物(谷氨酰胺、氨基酸等)能被更快地输出,减弱了产物的反馈抑制。其二,NIA基因表达数量减少的突变体可以通过增加剩余NIA基因的表达,在转录和翻译水平上改变NR的更新和翻译后调控以获得氮素同化能力补偿。
Wilkinson等[28]研究发现拟南芥中NR活性主要与NIA2基因表达量有关。本研究中△NIA1的NR活性高于△NIA2,NO3-含量低于△NIA2,推测NIA2是烟草NIA基因中的主效基因。另外还发现,△NIA1+2突变体仍具有较高的NR活性,这可能与NLPs蛋白可作用于硝酸还原酶NIA1基因下游3′端的NRE元件有关[12],认为NIA1基因下游的NRE元件在NRE2缺失时起替补作用,但NRE元件和NRE2元件在调控NIA1基因表达过程中的主次作用尚不可知,有待进一步验证。
4 结论
本试验通过CRISPR/Cas9技术构建了硝酸还原酶基因启动子的NRE2元件缺失突变载体,并转化烟草获得了转基因阳性植株。突变植株的氮代谢相关生理指标测定结果表明,敲除硝酸还原酶基因启动子的NRE2元件后,烟草植株的叶中NR活性与NO3-含量降低,NiR活性与NO2-含量仍保持在较高水平。仅敲除NIA1和NIA2基因启动子中的一个NRE2元件,不会对烟株整体的氮素营养状况产生负面影响;双敲除后,则明显降低烟草植株的总氮含量。表明NRE2元件对硝酸盐的还原同化过程起着重要作用。
