葡萄新品种组织培养快繁技术研究
2022-03-11陈玉霞邱建辉谷峰
陈玉霞 邱建辉 谷峰



摘要 [目的]探索葡萄新品種快繁技术。[方法]以葡萄1年生枝条腋芽为外植体,研究葡萄无菌植株的建立,筛选丛生芽分化、幼苗生根培养基配方及试管苗移栽的适宜基质。[结果]腋芽可作为外植体并以0.1% HgCl2消毒9 min为宜,黑奥林、先锋、红富士3个供试品种的无菌植株获得率为45.10%~60.00%;筛选出的丛生芽分化培养基配方为B5+ 6-BA 0.5 mg/L+ NAA 0.10 mg/L + 蔗糖20 g/L+琼脂6.5 g/L,3个葡萄品种的平均丛生芽分化数为4.14 芽/茎段;幼苗生根培养基配方为改良B5+IAA 0.10 mg/L+蔗糖20 g/L+琼脂 6.5 g/L+活性炭0.3%,试管苗生根率达100%,幼苗根多且粗壮,茎叶生长旺盛;以不同基质移栽试管苗,细河砂的移栽成活率最高,3个品种的幼苗成活率达86.67%~100%,其次为蛭石,幼苗成活率为71.67%~85.00%,而腐殖质土的试管苗成活率只有33.33%~43.33%,幼苗很少发新根。试管苗不经炼苗,可直接从培养瓶移栽到基质中。[结论]建立了一整套葡萄组织培养快速繁殖技术体系,可为葡萄新品种的快速繁殖、老品种的培养复壮提供依据。
关键词 葡萄;腋芽;丛生芽分化;生根培养;移栽;细河砂
中图分类号 S 663.1文献标识码 A文章编号 0517-6611(2022)04-0106-04
doi:10.3969/j.issn.0517-6611.2022.04.028
开放科学(资源服务)标识码(OSID):
Study on Tissue Culture Rapid Propagation Technology of New Grape Varieties
CHEN Yu-xia, QIU Jian-hui, GU Feng
(Institute of Agricultural Products Processing and Nuclear Agriculture Technology, Hubei Academy of Agricultural Sciences, Wuhan, Hubei430064)
Abstract [Objective]To explore the rapid propagation technology of new grape varieties.[Method]By using axillary bud of the annual branch of grape as explants, the establishment of grape sterile plantless, the medium formula of the differentiation of cluster buds and seedling root, the suitable substrate for transplanting test-tube seedlings were studied. [Result]The results showed that axillary bud could be used as explants and disinfected with 0.1% HgCl2 for 9 minutes. The sterile plant acquisition rates of three tested varieties were 45.10%-60.00%. The medium formula of cluster bud differentiation was B5 +6-BA 0.5 mg/L + NAA 0.10 mg/L + sucrose 20 g/L + agar 6.5 g/L, and the number of cluster bud differentiation of the three grape varieties was the above 4.14 bud per stem segment. The formula of seedling root medium was modified B5+IAA 0.10 mg/L+sucrose 20 g/L +agar 6.5 g/L+activated carbon 0.3%. On this medium, the rooting rate of test-tube plantlets reached 100%, the roots of seedlings were many and strong, and the stems and leaves grew vigorously. Transplanting the test tube seedlings with different substrates, and the transplanting survival rate of the fine river sand was the highest,and the survival rate of three varieties seedlings was 86.67%-100%, followed by vermiculite, the survival rate of the seedlings was 71.67%-85.00%,and the survival rate of test-tube plantlets in humus soil was only 33.33%-43.33%. Test-tube plantlets can be directly transferred from the culture bottle to the substrate without refining them. [Conclusion]In this study, a set of tissue culture rapid propagation technology system of grape was established, which provided the basis for the rapid propagation of new grape varieties and the culture and rejuvenation of old varieties.
Key words Grape;Axillary bud;Cluster bud differentiation;Root culture;Transplanting;Fine river sand
葡萄(Vitis vinifera L.),葡萄科藤本植物,世界各地均有栽培,面积达1 000万 hm2,占世界水果产量的30%以上[1]。葡萄既可鲜食,又可制葡萄干、葡萄汁或酿酒,还可作为美化庭园楼阁、绿化荒山碱滩的观赏和绿化树种。葡萄是世界最古老的果树树种之一。生产上通常采用扦插繁殖的方法繁殖葡萄苗木,易扦插成活,常规繁殖方法经济有效[2]。但长期采用扦插繁殖,易导致品种退化、品质变劣,尤其在南方多雨地区,扦插苗易受病虫感染,严重影响苗木质量[3]。植物组织培养技术就是将植物体的细胞、组织、器官采用无菌操作的方法,使其在人工条件及外源激素的作用下继续生长,并分化发育成完整的小植株。该技术可用于新品種的快速繁殖,老品种的培养复壮,不受季节、地区、气候、病虫等因素影响,可周年进行生产[4-6]。葡萄组织培养最早始于1944年,morel.G 进行葡萄的离体培养,我国曹孜义等[7-9]先后开展了葡萄组织培养研究,其目的在于加快优良品种繁殖;之后国内普遍开展了葡萄茎尖(或茎段)组织培养的研究工作,
甘肃农业大学葡萄试管繁殖研究组经过一系列研究,实现了葡萄小型化育苗;黄贞光等[2]通过对葡萄离体培养接种、继代繁殖、生根等研究,筛选出适合多个品种生长的广谱培养基—— B5培养基;李国树等[3]研究表明,外植体以茎尖为最佳,并对茎尖愈伤组织诱导、茎叶分化以及生根培养进行了研究。笔者选取当前推广的优良葡萄品种1年生枝条腋芽为试材,对无菌植体的建立、丛生芽的分化、不定根的诱导以及试管苗的移栽等关键技术进行研究,以期形成一整套葡萄组织培养快速繁殖技术体系,为葡萄组培快速繁殖及大规模工厂化育苗提供参考。
1 材料与方法
1.1 材料
1.1.1 供试品种。黑奥林、红富士、先锋,由湖北省农业科学院农产品加工与核农技术研究所葡萄盆栽试验基地提供。
1.1.2 主要设备。立式自动电热压力蒸气灭菌器,合肥华泰医疗设备有限公司;超净工作台(单人单面垂直送风),苏州江东精密仪器有限公司;光照培养箱,苏州长留净化科技有限公司;三角瓶、移液管等玻璃仪器,北京博美玻璃仪器厂;组织培养室。
1.1.3 化学试剂。B5培养基、蔗糖、琼脂、吲哚乙酸(IAA)、萘乙酸(NAA)、6-苄基氨基嘌呤(6-BA)、氯化汞或次氯酸钠、乙醇等。
1.2 方法
1.2.1 取材和消毒。取盆栽葡萄1年生枝条,去除叶片,放入冰箱(4 ℃左右)保存7 h后取出,切成带1个节的茎段,再对茎段进行消毒。首先用0.1%洗衣粉溶液漂洗10~15 min,洗净材料表面的污染物。用纱布将茎段包好,悬于水龙头下,小水流冲洗20 min,用滤纸吸干茎段的水分。将茎段转入无菌三角瓶中,用0.1% HgCl2(加吐温)消毒8~10 min。消毒时,不断振动容器,使HgCl2与茎段充分接触。最后用无菌水冲洗3~4次,每次洗涤1~2 min,备用。
1.2.2 腋芽的接种。在超净工作台上,将已消毒的茎段放在无菌滤纸上吸干水分,用解剖刀小心切取带少部分茎组织的腋芽,接种到装有芽生长培养基的3瓶中,每瓶接种3个腋芽,以腋芽刚好接触培养基为宜。在培养过程中,观察记录腋芽的生长情况,及时剔除带菌材料。
1.2.3 丛生芽分化培养基配方。以B5为基础培养基,分别添加不同浓度的NAA和6-BA配制成不同的培养基,接种3个供试品种的无菌苗,置于光照培养室中培养,保持温度25~28 ℃,光照时间12~16 h/d,光照强度2 000 lx。在培养过程中,每天观察记录丛生芽分化及生长情况,30 d后统计各品种丛生芽数等各项指标。
1.2.4 生根培养基配方。以改良B5为基础培养基,分别添加一定浓度的IAA、蔗糖和活性炭配制成生根培养基,接种有2~3片真叶,生长基本一致的丛生芽,每品种接种7瓶,每瓶接种5株,30 d后对生根情况进行调查分析。
1.2.5 试管苗移栽。将葡萄试管苗从培养室移至室外,不需经过炼苗,直接将试管苗从三角瓶中取出,洗去根部附着的培养基,栽于基质中。移栽基质为细河砂、腐殖质土和蛭石。栽后适量浇水,覆以塑料薄膜,并做成拱棚形式。移栽后30 d调查试管苗的成活率等各项指标。
2 结果与分析
2.1 无菌植株的建立
取盆栽的红富士、先锋、黑奥林1年生枝条腋芽进行培养。由于腋芽带菌量大,虽然用0.1%HgCl2消毒9 min,但难以彻底解决腋芽带菌问题。接种3 d以后,陆续可见带菌的腋芽,有的腋芽周围有细菌菌落生长,有的腋芽周围有真菌菌落生长,因此应及时将未染菌的腋芽转移到无菌培养基上。有的腋芽虽未染菌,但已被组织内的氧化物氧化而褐化。接种后7 d,未被污染的腋芽均开始生长,表现为芽体膨大,少数可见叶片逐渐转绿,叶片平展,即获得无菌植株。3个品种腋芽生长情况的调查结果见表1。由表1可知,3个供试品种中,以黑奥林褐化率最低,仅28.33%,成苗率最高,为60.00%。培养30 d后,将无菌植株切成带一个节的小段,在芽生长培养基中继续培养,以扩大无菌苗数量。
2.2 丛生芽分化培养基的筛选
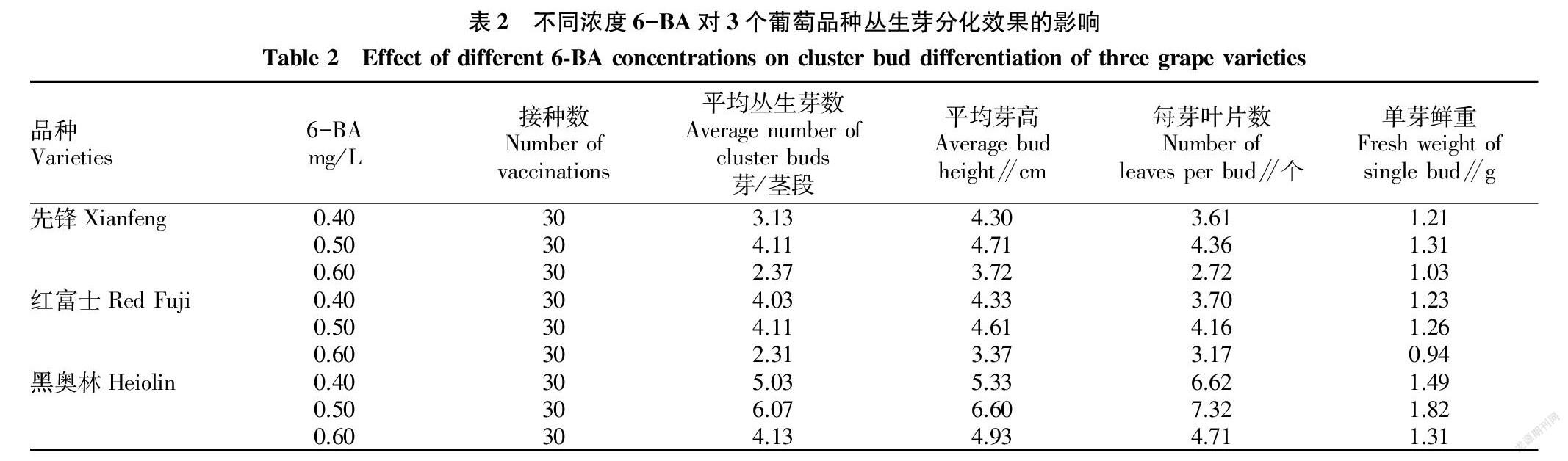
2.2.1 不同6-BA浓度对丛生芽分化效果的影响。在B5+NAA 0.10 mg/L+蔗糖20 g/L+琼脂6.5 g/L培养基上,添加0.40、0.50、0.60 mg/L 6-BA,配制成3种培养基,接种3个供试品种无菌苗的带节茎段,每处理接种6瓶,每瓶接种5个茎段。培养30 d后,对3个品种丛生芽的分化情况进行调查,结果见表2。由表2可知,当6-BA浓度为0.50 mg/L时,3个品种的平均丛芽数、平均芽高、每芽叶片数、单芽鲜重均高于其他2个浓度处理,浓度为0.60 mg/L时4项指标均为最低值。另外,3个品种间丛生芽分化效果存在差异,黑奥林的4项指标均高于先锋和红富士,而先锋和红富士间差异不明显。
2.2.2 不同NAA浓度对丛生芽分化效果的影响。在B5+6-BA 050 mg/L+蔗糖20 g/L+琼脂6.5 g/L基础培养上添加010、0.15、0.20 mg/L NAA,配制成3种培养基,接种3个供试品种无菌苗,每处理接种6瓶,每瓶接种5苗。培养30 d后,对3个品种丛生芽的分化情况进行调查,结果见表3。由表3可知,当NAA浓度为0.10 mg/L时,先锋的平均丛生芽数、平均芽高、每芽叶片数均优于其他2个浓度处理,丛芽生长快,叶片嫩绿,同时,在培养15 d后,有30%~40%小植株长出2~3条短而粗的白根。当NAA浓度为0.20 mg/L时,丛生芽发生少,且矮小皱缩,3个供试品种表现一致。
2.3 葡萄无菌苗生根培养基配方
以改良B5(微量元素和肌醇减半)为基础培养基,分别添加蔗糖20 g/L、琼脂6.5 g/L、活性炭0.3%和0.05、0.10、0.15 mg/L IAA,配制成3种不同培养基,接种3~4片真叶、生长基本一致的黑奥林无菌苗。接种后6 d幼苗基部膨大且有白色根尖突起,13 d后在3种生根培养基上的幼苗全部长出嫩根。由表4可知,当IAA浓度为0.10 mg/L时,幼苗生长良好,表现为苗高适度,平均每株根数达6.53条,根多而粗壮。因此,B5+IAA 0.10 mg/L+蔗糖20 g/L+琼脂6.5 g/L+活性炭0.3%可作为葡萄试管苗生根培养基。
2.4 葡萄试管苗移栽
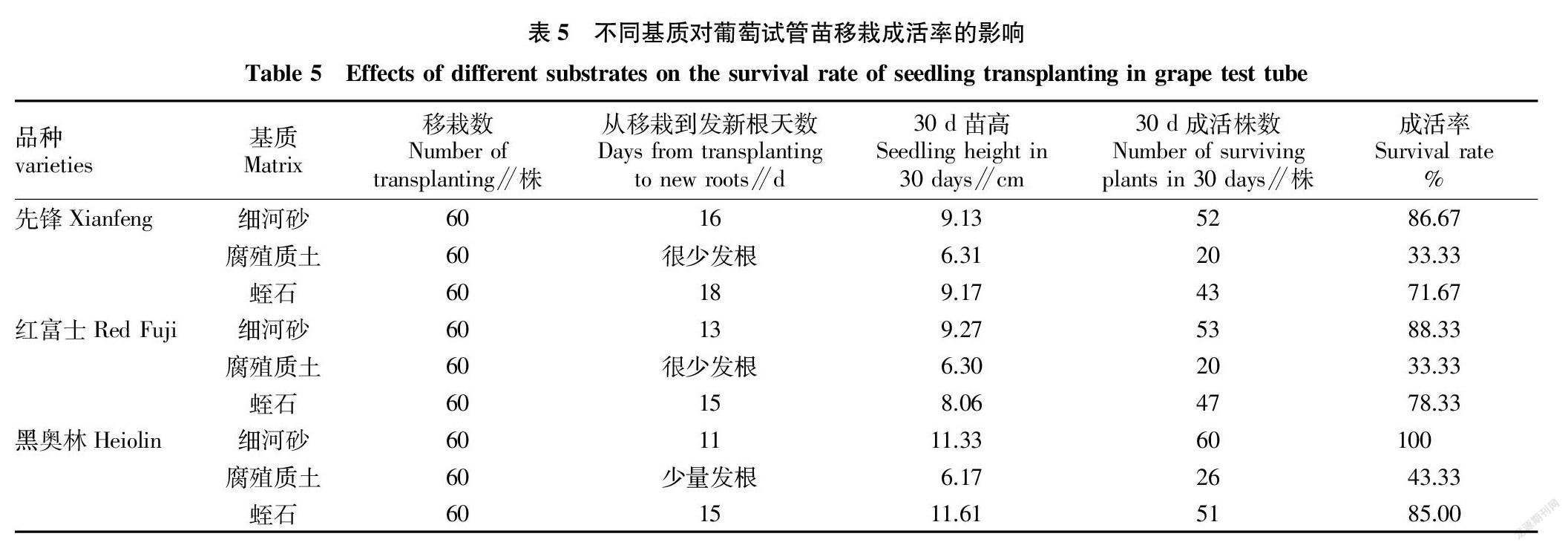
3个供试品种的无菌苗在生根培养基上培养30 d,不需炼苗,可直接将试管苗从培养瓶中取出,用自来水洗去根部附着的培养基,移栽到细河砂、腐殖质土和蛭石中,用洒水壶适量浇水,再覆盖塑料薄膜,做成拱棚形式。移栽后每天记录试管苗植株生长情况,结果见表5。从移栽到长出新根天数看,以细河砂为基质发新根天数最短,3个品种的发根天数为11~16 d,其次为蛭石,发根天数为15~18 d,而在腐殖质土中的小植株很少发新根;第30天统计试管苗株高,3个品种生长在细河砂和蛭石中的苗高为9.13~11.33 cm和8.06~11.61 cm,而生长在腐殖质土中的苗高与移栽时的高度变化不大,为6.17~6.31 cm;第30天统计试管苗成活率,以细河砂和蛭石为基质的成活率较高,尤其是黑奥林在细河砂中移栽成活率达100%,植株根系发达,茎叶生长健壮。试管苗最适移栽气温为10~22 ℃,在试管苗移栽后,若塑料棚内温度达到30 ℃以上,须开棚通风,以降低棚内温度,避免高温灼伤植株,傍晚温度下降时,再将薄膜盖严。待试管苗完全成活,可揭去塑料薄膜,让试管苗在自然条件下生长。
3 结论与讨论
以葡萄1年生枝条腋芽为外植体,以0.1%HgCl2消毒9 min为宜,3个供试品种的无菌苗获得率为45.10%~6000%。以B5为基础培养基,进行NAA、6-BA的单因素茎段培养试验,筛选出了较优的丛生芽分化培养基配方,即 B5+6-BA 0.50 mg/L+NAA 0.10 mg/L+蔗糖20 g/L+琼脂6.5 g/L,在该培养基上培养的3个葡萄品种的丛生芽分化率较高,平均丛生芽数在4.14芽/茎段。经试验,试管苗生根培养基配方为改良B5+IAA 0.10 mg/L+蔗糖20 g/L+琼脂6.5 g/L+活性炭0.3%,在该培养基上培养的无菌苗13 d后全部长出嫩根,试管苗生根率达100%,幼苗根多且粗壮,茎叶生长旺盛。
以细河砂、腐殖质土、蛭石为基质移栽试管苗,并覆以塑料薄膜,以细河砂的移栽成活率最高,3個品种的幼苗成活率达86.67%~100%,其次为蛭石,试管苗成活率为71.67%~85.00%,而以腐殖质土为基质的试管苗成活率只有33.33%~43.33%,幼苗很少发新根。试管苗不需炼苗,可直接从培养瓶移栽到基质中,这与曾斌等[10]将已生根的瓶苗移出培养室,放置散射光较强处炼苗,使瓶苗在出瓶前充分进行光、湿、温锻炼的研究结果一致。移出3 d后拧松瓶盖,5 d后将瓶盖揭开,7 d后小心倒出瓶苗,用自来水冲洗,洗净培养基,并直接移植到塑料小拱棚或温室内的苗床上,这与潘春云等[11]先将葡萄试管苗炼苗7~11 d,再移栽到营养钵中有所不同。
参考文献
[1] 冯发文,田群芳.巨峰葡萄组织培养快繁技术研究[J].落叶果树,2011,43(2):6-8.
[2] 黄贞光,谭素英,李四俊,等.葡萄组织培养快速繁殖及微茎尖培养研究[J].果树科学,1990,7(1):13-18.
[3] 李国树,邱璐,徐成东,等.葡萄组织培养快速繁殖体系研究[J].北方园艺,2011(9):134-136.
[4] 张志良,瞿伟菁,李小方.植物生理学实验指导[M].北京:高等教育出版社,2013:248.
[5] 富桂荣,李勤贤,胡宗双.植物组织培养技术在农业生产中的应用[J].农业科技与信息,2007(5):22-23.
[6] 马远,张振文,杨玉洁,等.葡萄组织培养应用研究进展[J].中外葡萄与葡萄酒,2002(4):23-26.
[7] 曹孜义,齐与枢,郭采月.葡萄试管繁殖[J].葡萄科技,1979(4):7-10.
[8] 毛明珍,田海山,吕昌文.葡萄试管苗繁殖技术研究[J].新疆农业科学,1984,21(4):22-23,50.
[9] 徐庆玉,张秀清,王春英,等.葡萄的组织培养及其应用[J].山东农业科学,1987,19(4):23-24.
[10] 曾斌,罗淑萍,任盈盈,等.木纳格葡萄组织培养快繁技术的研究简报[J].新疆农业科学,2007,44(3):340-343.
[11] 潘春云,卢丙之,赵新节.葡萄试管苗移栽技术[J].落叶果树,1988,20(1):13-14.
3323500338247
