超声辅助提取紫苏叶花色苷及其抗氧化活性研究
2022-03-10王月赵彦巧李建颖天津商业大学生物技术与食品科学学院天津市食品生物技术重点实验室天津300134
王月,赵彦巧,李建颖(天津商业大学生物技术与食品科学学院天津市食品生物技术重点实验室,天津 300134)
紫苏(Perilla frutescent(L.)Britt),是一种具有特殊香气的药食同源植物[1],又名苏子[2],其紫苏叶、紫苏子、紫苏梗均被《中国药典》所收录[3]。紫苏叶含有许多营养物质,如酚类、氨基酸、花色苷、维生素和矿物质[4],其茎、叶、根和种子等均可直接或加工后食用。研究表明,紫苏具有良好的抗氧化性[5]、抗菌性[6]、抗过敏性[7]、止呕[8]等多种生物学功能。花色苷作为一种天然色素,广泛存在于叶片、花、果实等器官中并赋予其红、橙、紫等不同颜色。目前已知的花色苷有二十多种,大量的研究结果表明,花色苷类化合物有一定的营养和药理作用,具有良好的抗氧化[9]、抗癌[10]、抗肿瘤、抗炎杀菌、降血糖[11]等活性。目前,食品安全问题备受关注,花色苷作为一种安全性高、色泽鲜艳的天然可食用色素,广泛应用于食品、药品以及化妆品等行业。
目前,国内外对紫苏叶花色苷提取及抗氧化活性的研究已有报道。Meng等[12]测定了从广州、辽宁等地采集到的不同品种花色苷的含量为6 mg/g干重~7 mg/g干重。崔丽霞[13]采用超声波辅助提取法提取紫苏叶中的花色苷和多酚类化合物,提取量分别为6.44mg CGE/g和63.11mgGAE/g。此外 Gülçin 等[14]对紫苏叶花色苷的活性研究发现,紫苏叶花色苷对DPPH自由基、超氧阴离子自由基、羟基自由基等有很强的清除能力。超声辅助作为提取天然物质的辅助手段,比传统方法更节约时间,对遇热不稳定的成分有保护作用,有利于节约能源[15-16]。本研究以紫苏叶为原料,以酸化乙醇为溶剂采用超声辅助提取紫苏叶花色苷,分析多个因素对紫苏叶花色苷提取量的影响,通过响应面试验优化得到最佳提取工艺,并对紫苏叶花色苷的体外抗氧化活性进行分析,为紫苏叶花色苷的理论研究及其工业化运用提供理论参考。
1 材料与方法
1.1 材料与试剂
紫苏叶:河北祁州中药材种植园。
无水乙醇、浓盐酸、无水乙酸钠、氯化钾(均为分析纯):天津市风船化学试剂科技有限公司;1,1-二苯基-2-三硝基苯肼 (1,1-diphenyl-2-picrylhydrazyl,DPPH)(纯度>97.0%):东京化成工业株式会社;Trolox(纯度>97.0%):源叶生物科技有限公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2-azinobis-(3-ethylbenzthiazoline-6-sulphonate,ABTS](纯度>98.0%):上海易恩化学技术有限公司;过氧化氢(30%):天津市北联精细化学品开发有限公司。
1.2 仪器与设备
分析天平(AX224ZH)、pH 计(ST3100):奥豪斯仪器有限公司;真空冷冻干燥机(LGJ-1A-50):科仪创智(北京)科技发展有限公司;紫外可见分光光度计(UV-2600):岛津仪器有限公司;多功能粉碎机(YB-2500A):永康市速锋工贸有限公司;高速冷冻离心机(CL5R):湘仪离心机仪器有限公司;旋转蒸发仪(RV10DIGITAL):艾卡(广州)仪器设备有限公司。
1.3 试验方法
1.3.1 紫苏叶前处理
取新鲜干紫苏叶放入烘箱40℃烘6 h。取出干燥后的紫苏叶,用多功能粉碎机打碎后过60目筛,4℃保存备用。
1.3.2 紫苏花色苷提取工艺
紫苏叶前处理→超声辅助提取→离心取上清液→pH示差法测定上清液吸光度→计算提取量。
1.3.3 紫苏叶花色苷提取量的测定
pH示差法[17]测定花色苷含量。

式中:ΔA=(A520nm(pH1.0)-A700nm(pH1.0))-(A520nm(pH4.5)-A700nm(pH4.5));V为体积,mL;F为稀释倍数;M为矢车菊素葡萄糖苷(cyanidin-3-glucoside)的分子量,449.2g/mol;ε 为摩尔消光系数26 900 L/(mol·cm);l为比色皿厚度,cm;W为样品质量,g。
1.3.4 单因素试验设计
准确称量1 g的紫苏叶粉,加入不同浓度不同体积的酸化乙醇(pH2)进行超声提取。以紫苏叶花色苷的提取量为衡量指标,分别考察4个因素对花色苷提取量的影响:提取温度(30、40、50、60、70 ℃)、超声时间(10、20、30、40、50 min)、乙醇体积分数(25%、30%、35%、40%、45%)和液料比[5∶1、10∶1、15∶1、20∶1、25∶1(mL/g)]。每个处理做 3 个平行。
1.3.5 响应面优化试验
在单因素试验基础上,采用Box-Behnken响应面分析法(BBD模型)筛选出花色苷提取的最佳提取工艺条件,因素水平见表1。

表1 响应面试验因素与水平Table 1 Factors and levels for response surface design
1.3.6 DPPH自由基清除能力的测定
参考石雪萍等[18]的方法并稍作改动。取1 mL 0.1 mmol/L DPPH+1.5 mL无水乙醇+0.5mL不同浓度花色苷溶液于比色皿中混合均匀,置于25℃避光的环境中 30 min,测 A(517nm),计算公式如下。
DPPH 自由基清除率/%=[1-(A1-A2)/A0]×100
式中:A1为样品溶液的吸光度;A2为用等量无水乙醇代替DPPH溶液的样品的吸光度;A0为用等量无水乙醇代替花色苷溶液即空白对照溶液的吸光度。样品的对照组为与其浓度相同的Trolox,每份处理做3个平行。
1.3.7 ABTS+自由基清除能力的测定
参考宋思圆等[19]的方法并稍作改动。配制ABTS母液:将245 μL(100 mmol/L)过硫酸钾溶液置于10 mL容量瓶中,加入9.5 mL的7 mmol/L ABTS溶液,用超纯水补齐至刻度,混合均匀,用锡纸包裹容量瓶在黑暗中静置16 h。向pH7.4的磷酸缓冲盐溶液(phosphate buffer saline,PBS)中滴加 ABTS 母液,测得 A(734nm)=0.7±0.02,即得ABTS工作液。取3mLABTS工作液和0.03mL不同浓度花色苷溶液于比色皿中,混合均匀在黑暗环境中反应 6 min,测 A(734nm),计算公式如下。
ABTS+自由基清除率/%=[1-(A1-A2)/A0]×100
式中:A1为样品溶液的吸光度;A2为用等量无水乙醇代替ABTS工作液的样品的吸光度;A1为用等量无水乙醇代替花色苷溶液即空白对照溶液的吸光度。样品的对照组为与其浓度相同的Trolox,每份处理做3个平行。
1.3.8 羟基自由基清除能力的测定
参考张玲等[20]的方法并稍作改动。分别配制4.5 mmol/L水杨酸、4 mmol/L FeSO4和8.8 mmol/L H2O2备用。反应体系为1 mL FeSO4+1 mL水杨酸+1 mL H2O2+1 mL不同浓度花色苷溶液,将溶液添加至比色皿中,混合均匀置于黑暗环境中 30 min,测 A(510nm),计算公式如下。
羟基自由基清除率/%=[1-(A1-A2)/A0]×100
式中:A1为样品溶液的吸光度;A2为用等量蒸馏水代替H2O2溶液的样品的吸光度;A0为用等量蒸馏水代替花色苷溶液即空白对照溶液的吸光度。样品的对照组为与其相同浓度的Trolox,每份处理做3个平行。
1.4 数据分析
试验结果表示成平均值±标准差;用Origin 2019b作图;用SPSS 25进行数据分析;响应面试验用Design Expert 10.0分析。
2 结果与分析
2.1 单因素结果
2.1.1 提取温度对花色苷提取量的影响
提取温度对花色苷提取量的影响见图1。

图1 提取温度对花色苷提取量的影响Fig.1 Effect of extraction temperature on the yield of anthocyanin
由图1可知,在30℃~50℃内随着提取温度的升高,紫苏叶花色苷的提取量从626.54 mg/100 g增加到725.62 mg/100 g;再继续升温至70℃,花色苷的提取量又下降至655.71 mg/100 g,表明温度对花色苷的溶解有一定的影响。升温能加快分子运动[21],提高溶液扩散速度,有助于提高乙醇对花色苷的溶解度;但花色苷耐热性较差,提取温度过高,花色苷结构受到破坏,降低花色苷得率。因此提取温度选择45、50、55℃进一步优化。
2.1.2 超声时间对花色苷提取量的影响
超声时间对花色苷提取量的影响见图2。

图2 超声时间对花色苷提取量的影响Fig.2 Effects of ultrasonic time on the yield of anthocyanin
由图2可知,10 min~40 min随着超声时间的延长,紫苏叶花色苷的提取量从511.65 mg/100 g增加到714.04 mg/100 g,并在40 min时达到最大。表明一定范围内延长超声时间对紫苏叶中花色苷成分的溶出有一定的促进作用。但是时间延长到40min~50min,提取量不升反降,这可能是由于超声波作用时间过长花色苷结构遭到破坏,花色苷被氧化降解使提取量呈下降趋势。因此超声时间选择35、40、45 min进一步优化。
2.1.3 乙醇体积分数对花色苷提取量的影响
乙醇体积分数对花色苷提取量的影响见图3。

图3 乙醇体积分数对花色苷提取量的影响Fig.3 Effects of ethanol volume fraction on the yield of anthocyanin
由图3可知,在25%~40%范围内,紫苏叶花色苷的提取量随着乙醇体积分数增大呈逐步上升的趋势,在乙醇体积分数40%时花色苷提取量达到最大,为712.93 mg/100 g。这种情况可能是因为水分含量过多,乙醇含量过少,水溶性杂质在此体系中的溶解性较好,使花色苷溶出比例降低。随着乙醇体积分数的增加,溶剂对细胞的渗透作用也会增大,有利于将花色苷从细胞中溶解释放出来,但乙醇体积分数过大,提取液极性过低,花色苷溶出度和得率就会大幅下降[22],导致花色苷含量不升反降。所以选择35%、40%、45%的乙醇溶液进一步优化。
2.1.4 液料比对花色苷提取量的影响
液料比对花色苷提取量的影响见图4。
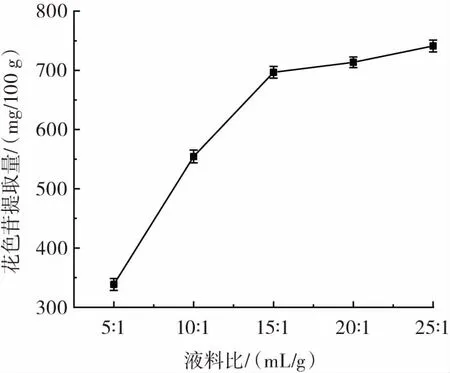
图4 液料比对花色苷提取量的影响Fig.4 Effects of liquid to material ratio on the yield of anthocyanin
由图4可知,溶剂用量从5 mL增加到15 mL,紫苏叶花色苷提取量增加了一倍,表明一定范围内溶剂用量增加有利于原料中花色苷的传质与扩散,提高花色苷溶出率,提升提取率。当液料比为15∶1(mL/g)时,提取量为 696.68 mg/100 g,液料比继续增加到 25∶1(mL/g)时,提取量增幅不大。考虑到增加液料比会增加溶剂消耗,使提取液的体积太大,不利于后续浓缩步骤的进行。因此在优化试验中选择 10∶1、15∶1、20∶1(mL/g)进一步优化。
2.2 响应面试验结果
2.2.1 响应面试验方案及结果
依据2.1的试验结果,利用响应面软件Design Expert 10.0设计四因素三水平的试验,考察提取温度(A)、超声时间(B)、乙醇体积分数(C)和液料比(D)对结果的影响。试验方案和结果见表2。
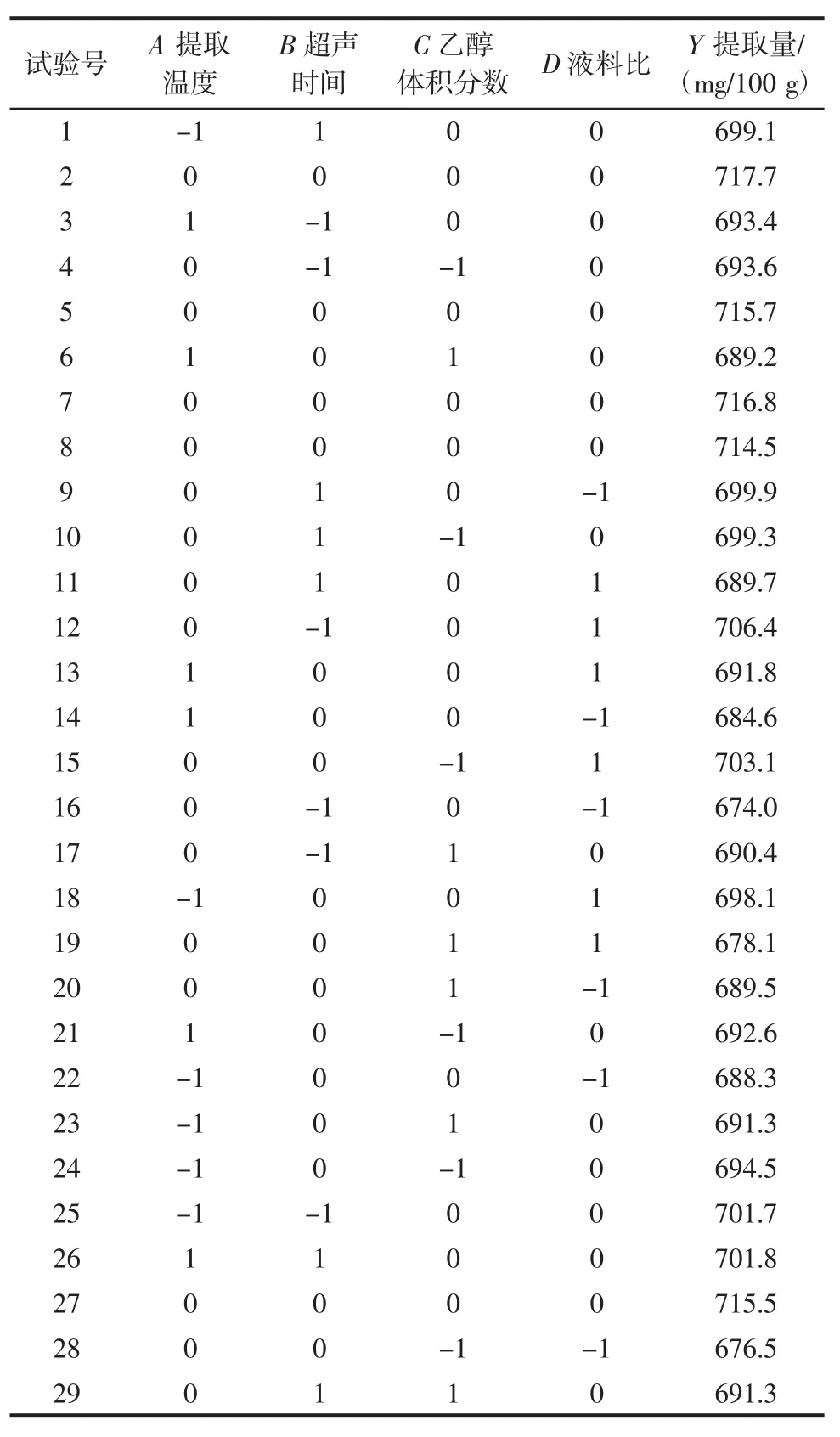
表2 响应面试验结果Table 2 Results of response surface test
2.2.2 模型方程的建立与显著性试验
采用Design-Expert 10.0软件对响应面试验结果进行拟合回归分析,得出花色苷提取量为目标函数的二次回归方程Y=716.04-1.63A+1.80B-2.48C+4.53D+2.75AB-0.05AC-0.65AD-1.2BC-10.65BD-9.5CD-9.65A2-7.87B2-14.27C2-15.44D2。回归模型方差分析见表3。

表3 回归模型方差分析Table 3 Analysis of variance in regression model
由表3可知,模型F=148.27,表明该模型具有很高的精准度。模型P<0.000 1,表明该模型达到高度显著水平。在此情况下,一次项C、D是影响模型的重要参数,A、B是影响模型的参数;二次项BD、CD对模型影响很大,AB对模型有一定的影响,AC、AD、BC对模型的影响不显著。各因素对花色苷提取量影响顺序为D>C>B>A。失拟项P>0.05不显著,说明该响应面模型存在的误差较小,因此二次模型较合理。综上表明,该模型设计的参数可以进行花色苷提取。
2.2.3 因素间交互作用的响应面分析结果
各因素交互作用对花色苷提取量影响的响应面图见图5。
等高线和3D响应曲面图能比较直观地反映4个因素对花色苷提取量的影响。等高线的形状可以反映出交互作用的强弱,椭圆形表示两因素交互作用显著,而圆形则与之相反;从3D曲面图来看,曲面越陡峭表明试验因素对花色苷提取量影响越大,交互作用越显著。由图 5(b)、(c)、(d)可知 3D 响应曲面图坡度平缓,等高线接近圆形,表明温度和乙醇浓度、温度和液料比、时间和乙醇浓度间的交互作用不显著。图5(a)、(e)、(f)等高线接近椭圆,3D 响应曲面图陡峭,表明温度和时间、时间和液料比、乙醇浓度和液料比间交互作用显著。
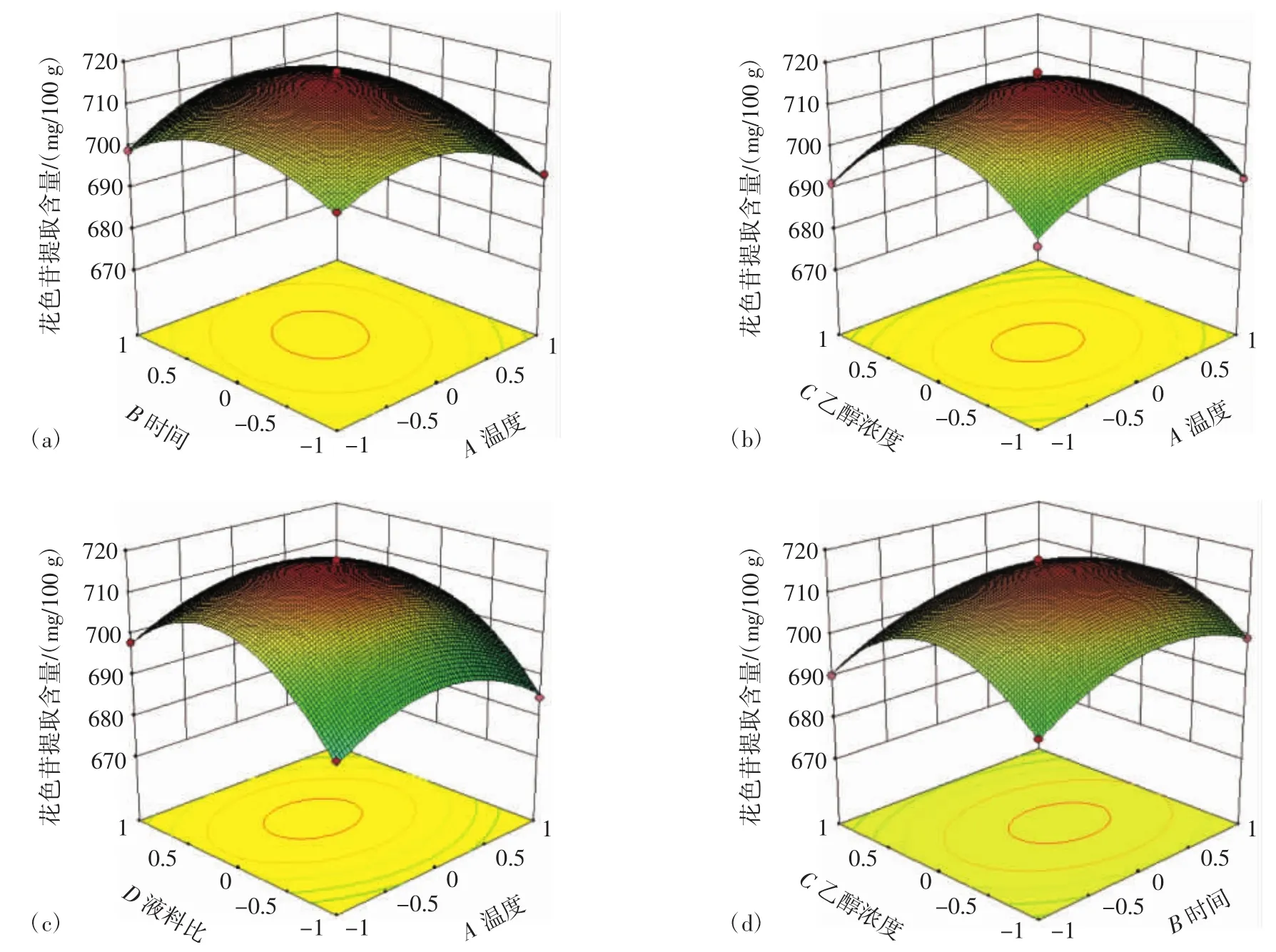

图5 各因素交互作用对花色苷提取量的影响Fig.5 The influence of the interaction of various factors on the extraction amount of anthocyanins
2.2.4 验证试验结果
经过Design-Expert 10.0软件分析得到了紫苏叶花色苷最佳提取工艺为提取温度49.52℃,超声时间37.42min,乙醇体积分数 39.23%,液料比 16.03∶1(mL/g),紫苏叶花色苷提取量的理论值为716.75 mg/100 g。考虑实际操作修订为提取温度50℃,超声时间37 min,乙醇体积分数40%,液料比16∶1(mL/g)。此条件下做验证试验,得到提取量为715.56 mg/100 g,与理论值716.75 mg/100 g相近,表明该模型有较好的预测作用,合理可行。
2.3 紫苏叶花色苷对DPPH自由基清除能力的分析
紫苏叶花色苷对DPPH自由基的清除能力见图6。

图6 紫苏叶花色苷对DPPH自由基的清除能力Fig.6 DPPH radical scavenging activity of Perilla leaves anthocyanins
DPPH自由基具有单一电子,可以与抗氧化剂提供的电子或氢原子结合,发生反应使醇溶液从原来的紫色逐渐变浅,且与清除剂浓度呈一定的量效关系[23]。由图6可知,随着质量浓度从0.04 mg/mL增加到0.09 mg/mL,紫苏叶花色苷清除DPPH自由基的能力从33.42%上升到84.42%,且上升趋势大于Trolox。两者在0.09 mg/mL时清除率均达到最大,分别为84.42%和97.22%,表明紫苏叶花色苷能较好地清除DPPH自由基。
2.4 紫苏叶花色苷对ABTS+自由基清除能力的分析
紫苏叶花色苷对ABTS+自由基的清除能力见图7。

图7 紫苏叶花色苷对ABTS+自由基的清除能力Fig.7 ABTS+radical scavenging activity of Perilla leaves anthocyanins
从图7可知,随着质量浓度增加,Trolox和紫苏叶花色苷的清除率均上升,对照组的上升趋势大于试验组,且同一浓度下Trolox的清除率大于紫苏叶花色苷。当质量浓度为0.7 mg/mL时紫苏叶花色苷和Trolox对ABTS+自由基的清除效率均达到最大,分别为47.85%和99.74%,表明紫苏叶花色苷有一定的ABTS+自由基清除能力,可作为抗氧化成分可与ABTS+反应,使原本蓝绿色的反应体系褪色,终止自由基的连锁反应,从而清除或抑制ABTS+自由基生成。
2.5 紫苏叶花色苷对羟基自由基清除能力的分析
紫苏叶花色苷对羟基自由基的清除能力见图8。
羟基自由基对人体危害较大,当羟基自由基产生与清除不平衡时,会影响机体正常生理功能[24]。由图8可知,紫苏叶花色苷和Trolox对羟基自由基的清除率与质量浓度成正比,但紫苏叶花色苷的清除能力低于Trolox。当质量浓度为1.1 mg/mL时紫苏叶花色苷和Trolox对羟基自由基的清除效率均达到最大,分别为51.27%和96.68%。表明紫苏叶花色苷有一定的羟基自由基清除能力,紫苏叶花色苷作为供氢体与氧化还原反应产生的羟基自由基结合,从而保护机体免受羟基自由基的损坏。
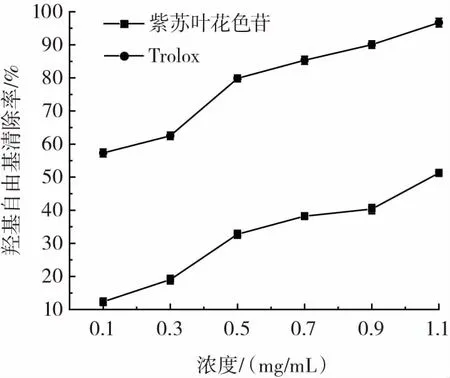
图8 紫苏叶花色苷对羟基自由基的清除能力Fig.8 Hydroxyl radical scavenging activity of Perilla leaves anthocyanins
3 结论
采用超声辅助提取紫苏叶花色苷,用酸化乙醇作为提取溶剂,在单因素试验的基础上,通过响应面试验确定了最佳提取工艺条件。试验结果表明,各因素对花色苷提取量的影响顺序为料液比>乙醇体积分数>超声时间>提取温度。最佳工艺条件为乙醇体积分数 40%、液料比 16∶1(mL/g)、超声时间 37 min、提取温度50℃,此时紫苏叶花色苷提取率最高,达到了715.56 mg/100 g。体外抗氧化活性试验表明,紫苏叶花色苷对3种自由基都具有良好的清除能力,且其抗氧化能力与紫苏叶花色苷浓度总体呈正比,紫苏叶花色苷对DPPH自由基、ABTS+自由基和羟基自由基的清除率分别达到84.42%,47.85%和51.27%。
综上所述,超声辅助提取对紫苏叶花色苷的优化工艺可行,试验结果稳定可靠,具有较强的体外抗氧化能力,试验结果为紫苏叶花色苷在食用药用方面的开发提供了一定技术支持和理论数据参考。
