不同酶解方式对豆粕大豆蛋白组分和抗原活性的影响
2022-03-10王章存贺志铮章银良安广杰张培旗卫梦雅李秀芳
王章存,贺志铮,章银良,安广杰,张培旗,卫梦雅,李秀芳
(郑州轻工业大学食品与生物工程学院,河南 郑州 450001)
大豆蛋白资源丰富,具有良好的乳化性、凝胶性、起泡性等功能特性,且其氨基酸营养全面[1-2],在食品工业中广泛应用[3-6]。然而大豆也是联合国粮农组织认定的世界八大类易致敏食物之一[7],已从大豆蛋白中检测出38种含有抗原活性的蛋白组分,影响人体的健康,其食用安全问题受到了广泛关注。
目前,降解抗原蛋白的方法主要有物理法、化学法和生物酶解法[8]。其中,酶解法可使大豆蛋白分子水解为小肽和氨基酸分子,使得蛋白质发生变性,从而降低或消除其抗原活性[9]。目前关于大豆蛋白酶解的研究较多,而且多是对于酶解过程中大豆蛋白亚基与抗原活性变化关系的研究[10-12],如通过风味蛋白酶、碱性蛋白酶水解大豆分离蛋白,既可部分降低其抗原活性,也可改善其功能特性[13-14];也有研究表明大豆蛋白先经分离,再经胃蛋白酶水解,可完全消除7S组分中的α-亚基,但最终仍有组分无法进一步水解[15]。Zhao等[16]比较了胃蛋白酶和胰蛋白酶水解大豆蛋白的差异,发现胃蛋白酶无法水解大豆蛋白7S组分的β-亚基。目前的研究大多采用的是单一酶水解,往往都未能完全消除大豆蛋白抗原活性,如碱性蛋白酶水解大豆蛋白会新生成两条抗酶解肽链,其中一条来自β-伴大豆球蛋白中的α-亚基,且残留较高的抗原活性[14]。据报道,先采用风味酶水解,再用中性蛋白酶水解β-伴大豆球蛋白时,其抗原活性去除效果比两种酶单一水解时更好[17]。但多酶联合酶解的文献报道较少,其规律性有待深入探索。鉴于此,本文分别选用碱性蛋白酶、木瓜蛋白酶以及双酶联合酶解大豆蛋白,通过十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE) 分析酶解过程中大豆蛋白分子组成变化,用竞争法酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)分析酶解物的抗原活性变化,比较不同酶解方式降解大豆蛋白抗原活性的效果。
1 材料与方法
1.1 材料
低温脱脂豆粕:河南阳光油脂公司;大豆蛋白(纯度为90.2%):郑州轻工业大学蛋白质深加工实验室自提取[18];碱性蛋白酶(200 000 U/g)、木瓜蛋白酶(800 000 U/g)、考马斯亮蓝R-250、低分子量标准蛋白质(分子量范围11 kDa~180 kDa):北京索莱宝科技有限公司;N,N,N',N'-四甲基乙二胺(N,N,N',N'-tetramethy lethylenediamine,TEMED)、 二 硫 代 苏 糖 醇(dithiothreitol,DTT)、过硫酸铵(ammonium persulphate,APS):麦克劳林公司;甘氨酸、十二烷基硫酸钠、三羟甲基氨基甲烷[tris(hydroxymethyl)methyl aminomethane,THAM]、丙烯酰胺(acrylamide,Acr)、N,N'-亚甲基双丙烯酰胺(N,N'-methylenebisacrylamide,MBA)、溴酚蓝:生工生物工程(上海)公司;大豆7S β-伴球蛋白酶联免疫分析试剂盒、大豆11S球蛋白酶联免疫分析试剂盒:上海雅吉生物科技公司。
1.2 仪器
DYY-7C型电泳仪、DYCZ-24DN型电泳槽:北京六一仪器厂;TDZ5-WS型低速离心机、TECAN Genios酶标仪:东胜创新生物科技公司;PB-10酸度计:赛多利斯(上海)贸易公司。
1.3 方法
1.3.1 大豆蛋白的酶解
单酶水解方法:取10 g大豆蛋白溶于100 mL去离子水中,调节水浴温度55℃,pH8.0,按照酶与蛋白质量比为1∶100加入碱性蛋白酶,设置酶反应时间点(0、10、30、60、90、120 min)进行取样后沸水浴灭活。木瓜蛋白酶的酶解温度设为40℃,pH6.0,其他试验步骤相同。
双酶联合水解方法:取10 g大豆蛋白溶于100 mL水中,调节温度55℃,pH8.0,按照酶与蛋白质量比为0.5∶100的比例加入碱性蛋白酶,按设定的反应时间点(0、10、30、60 min)取样并灭酶;反应至 60 min 时,调整水浴温度为40℃,pH6.0,再按照酶与蛋白质量比为0.5∶100的比例加入木瓜蛋白酶,再按设定的反应时间点(70、90、120 min)取样并沸水浴灭酶 5 min,冷却至室温(25℃)。
1.3.2 SDS-PAGE分析
SDS-PAGE分析采用Laemmli系统[19-20]。设置分离胶浓度为12%,浓缩胶浓度为5%;酶解物与还原性样品缓冲液按照体积比1∶1混合均匀后上样15 μL,Marker上样5 μL。电泳条件:浓缩胶80 V电泳15 min,分离胶110 V电泳90 min。取出电泳胶片后采用考马斯亮蓝R-250溶液染色后脱色拍照分析。
1.3.3 抗原活性的分析
分别采用7S和11S试剂盒检测酶解物的抗原活性。样品用0.2 mol/L pH7.4的磷酸盐缓冲液溶解并作梯度稀释,按照试剂盒说明书的步骤操作。在酶标仪上分别测定两种蛋白质的标准品和待测样品的OD值,每组样品平行测定3次,分别建立不同蛋白质的标准曲线,再将样品的OD值代入方程式,计算出样品浓度,数据采用Origin 8.0软件处理。以抗原活性剩余率表示酶解效果,计算公式如下。

式中:A1为酶解样品的OD值;A0为原蛋白样品的OD值。
2 结果与分析
2.1 单酶水解大豆蛋白的组分和抗原活性变化
2.1.1 大豆蛋白亚基的变化
大豆蛋白经碱性蛋白酶水解不同时间后,通过SDS-PAGE法分析蛋白组分变化,结果如图1所示。
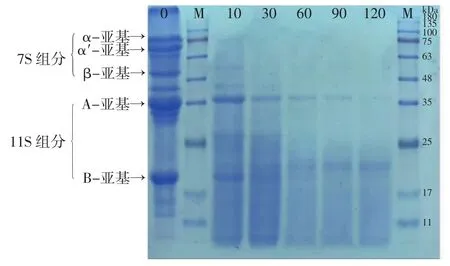
图1 大豆蛋白在碱性蛋白酶水解时分子量变化Fig.1 Changes in molecular weight of soybean protein during alkali protease hydrolysis
从图1可以看出,水解10 min时,大豆蛋白7S组分中的α′-亚基、α-亚基和β-亚基基本消失;11S组分中的38 kDa的A-亚基含量在10 min时明显减少,水解90 min时其含量大幅减少,但到反应终点时,仍有少部分残留;21 kDa的B-亚基含量也明显减少。与此同时,产生了分子量为23 kDa组分及大量分子量小于11 kDa组分,直至反应结束未发生明显变化。这表明碱性蛋白酶可以有效消除7S组分的α-亚基和α′-亚基,但是β-亚基和11S组分不能完全被消除。
大豆蛋白经木瓜蛋白酶水解不同时间后组分变化结果如图2所示。
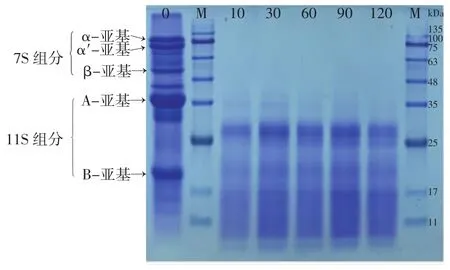
图2 大豆蛋白在木瓜蛋白酶水解时分子量变化Fig.2 Changes in molecular weight of soybean protein during papain hydrolysis
由图2可见,酶解10 min时,大豆蛋白7S组分和11S组分中的A-亚基已基本消失,但新产生多条分子量小于30 kDa的谱带,且随酶解时间延长这些谱带基本不再变化,表现出较强的抗酶解特性[21]。
2.1.2 抗原活性的变化
采用竞争ELISA法分别测定两种蛋白酶水解过程中大豆蛋白7S组分和11S组分抗原活性变化,结果如图3和图4所示。

图3 酶解过程中大豆蛋白7S组分抗原活性变化Fig.3 Changes in antigenicity of 7S components of soybean protein during hydrolysis
由图3和图4可知,两种蛋白酶均可降低大豆蛋白抗原活性,而且在开始酶解的前10 min抗原活性降低速率最快,但延长酶解时间后,两种蛋白质组分的抗原活性变化不明显。同一种蛋白酶水解时,两种蛋白质组分(7S和11S)的抗原活性降低幅度也不一样。从两种酶的作用效果可以看出,木瓜蛋白酶去除抗原活性能力强于碱性蛋白酶。但两种蛋白酶水解过程中,蛋白质组分与酶解物抗原活性之间的变化规律并不完全相同,如酶解30 min时,木瓜蛋白酶酶解物中7S和11S抗原活性剩余率分别降低为48.72%和62.33%,碱性蛋白酶酶解物中7S和11S抗原活性剩余率分别为64.25%和78.41%。之后两种酶的酶解物抗原活性变化趋于稳定。

图4 酶解过程中大豆蛋白11S组分抗原活性变化Fig.4 Changes in antigenicity of 11S components of soybean protein during hydrolysis
2.2 双酶联合水解大豆蛋白组分和抗原活性变化
由图1至图4结果可知,碱性蛋白酶和木瓜蛋白酶单独水解时,大豆蛋白分子组分和抗原活性变化并没有达到理想效果,这可能是由于每一种酶水解位点局限性所致。为此,本文研究了先碱性蛋白酶、后木瓜蛋白酶的双酶联合水解效果。
2.2.1 双酶联合水解过程中大豆蛋白组分变化
双酶联合水解过程不同时间节点大豆蛋白组分变化结果如图5所示。
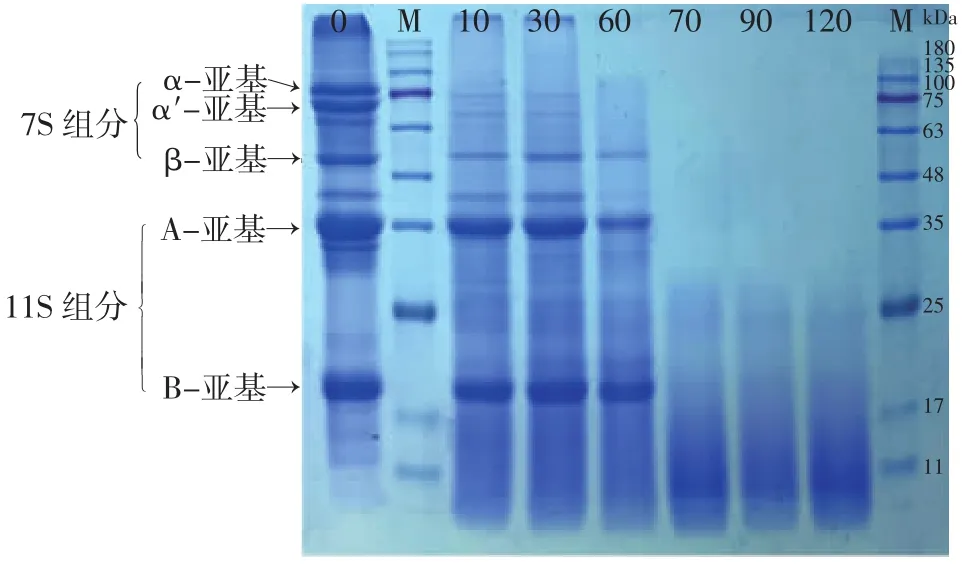
图5 碱性蛋白酶和木瓜蛋白酶联合酶解时大豆蛋白组分变化Fig.5 Changes in the composition of soybean protein during sequential enzymolysis with alkali protease and papain
从图5可以看出,前60 min碱性蛋白酶水解时,大豆蛋白7S的几个组分α-亚基和α'-亚基明显减少至消失,而β-亚基和11S组分的A-亚基和B-亚基几乎没有变化。与图1相比,这些谱带消失较慢,主要原因可能是图5中碱性蛋白酶添加量较少(是图1中用量的一半)。
但在60 min加入木瓜蛋白酶后,残存的7S和11S组分很快消失,而且酶解物中也没有新产生的抗酶解肽链。与单独用木瓜蛋白酶水解的结果(图2)相比,此时酶解效率更高(而且此时木瓜蛋白酶的添加量只有图2中的一半)。这些结果表明,碱性蛋白酶的水解产物更有利于木瓜蛋白酶的水解。
2.2.2 双酶联合水解抗原活性的变化
双酶联合水解过程中的抗原活性变化如图6所示。
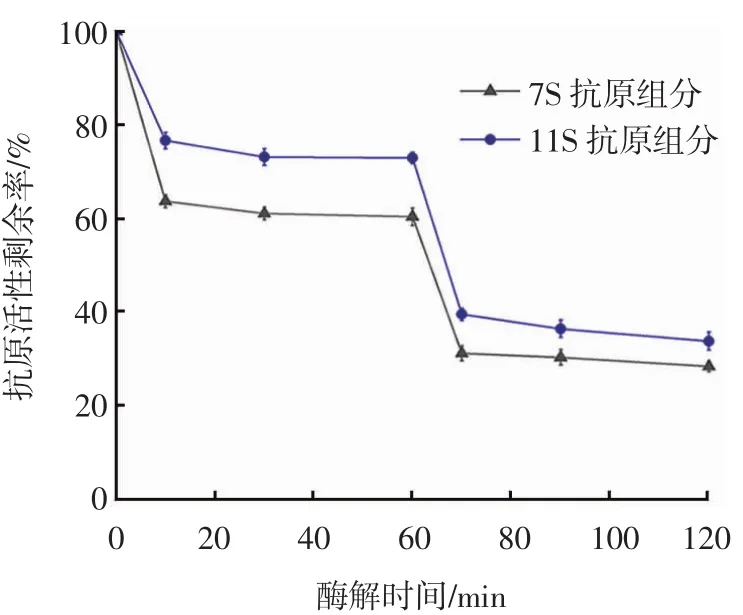
图6 双酶酶解过程中大豆蛋白抗原活性剩余率变化Fig.6 Changes in antigenicity residual rate of soybean protein during double enzymatic hydrolysis
从图6可以看出,酶解60 min时,碱性蛋白酶酶解物中7S和11S抗原活性剩余率分别为60.53%和72.44%;加入木瓜蛋白酶10 min后,抗原活性快速降低,7S和11S抗原活性剩余率分别为31.43%和39.69%,之后随着酶解时间的延长逐渐趋于稳定。与两种酶单独水解、总酶量相同情况下比较,双酶联合酶解效果更好。这可能是由于两种蛋白酶水解位点的差异所引起的协同作用效果,即原大豆蛋白分子中含有木瓜蛋白酶难以水解的位点或者存在蛋白质分子的空间位阻效应,经碱性蛋白酶水解后产生的肽链中这些障碍消失,从而更容易被木瓜蛋白酶水解为更小的分子,其序列型抗原表位也被破坏,从而进一步降低其抗原活性。这种现象在风味蛋白酶和中性蛋白酶的联合酶解中也曾出现[17]。当采用3种酶解方式(碱性蛋白酶、木瓜蛋白酶、双酶联合)酶解120 min时,酶解物中7S组分的抗原活性剩余率分别为64.25%、48.79%、28.57%,11S组分的抗原活性剩余率分别为78.43%、62.35%、33.93%。
3 结论
本文分别采用碱性蛋白酶、木瓜蛋白酶及双酶联合方式水解豆粕大豆蛋白,结果表明:在单一酶水解过程中,碱性蛋白酶无论在降解大豆蛋白,还是降低抗原活性的能力都较木瓜蛋白酶稍弱,且两者的水解效果均不理想;而相比于单一酶水解,采用先碱性蛋白酶后木瓜蛋白酶的联合方式水解时,大豆蛋白分子的降解和抗原活性降低效果更好,这体现了两种蛋白酶的协同效应。该研究为探讨大豆蛋白加工过程中的抗原活性变化规律、改善其食用安全性提供新的途径。
