羽毛降解菌的筛选及其降解特性研究
2022-03-10杨可心刘国华郭宝珠郑爱娟陈志敏常文环王泽栋蔡辉益
杨可心 刘国华 郭宝珠 郑爱娟 陈志敏 常文环 王泽栋 蔡辉益
(中国农业科学院饲料研究所,农业部生物饲料重点实验室,北京100081)
羽毛是养殖业屠宰固废的重要组成部分,我国每年肉鸡和蛋鸡总出栏量可超100亿羽,以羽毛占体重比5%~7%计算,可产生数百万吨羽毛。其中,水禽羽毛可加工为附加值较高的羽绒制品,而鸡羽毛常因附加值较低被废弃。鸡羽毛具有75%以上的粗蛋白质含量,主要由一种“硬蛋白”——羽毛角蛋白构成,这种蛋白由氢键、二硫键和其他交联作用共聚形成复杂稳定的蛋白结构[1],从而具有强大的抗张性[2]、柔韧性和机械强度,难以被常见蛋白酶(如胃蛋白酶、胰蛋白酶等)消化[3],因此也很难被动物直接利用。羽毛的氨基酸、矿物质微量元素和维生素种类丰富,将其抗性物质破坏,则能发挥极高的饲用价值。20世纪末,以高温高压水解法、膨化法、酸解碱解法等传统方法进行羽毛资源饲料化加工,有效解决了羽毛处理问题。但高温高压法导致羽毛中热敏氨基酸的损失[4],酸解碱解法导致氨基酸的破坏[5],使产物品质下降。同时,能耗高、废弃产物多等的特点是传统加工方式引起环境问题的最主要原因,导致羽毛饲料化面临新的挑战和机遇。微生物发酵技术兼具改善饲料原料营养价值结构和环境友好的特点。本研究拟筛选可高效降解羽毛的微生物,对羽毛进行微生物发酵技术处理,改善羽毛营养价值。目前已有研究表明,可分离出不同种属微生物对羽毛具有降解效果,如尖孢镰刀菌[6]、丝状真菌[7]、地衣芽孢杆菌[8-10]、枯草芽孢杆菌[11]、蜡样芽孢杆菌[12-13]、弗氏链霉菌[14]等。本研究通过分离得到的羽毛降解菌进行羽毛微生物发酵,可有效改善羽毛的营养价值结构,提升羽毛利用率和可溶性蛋白及氨基酸含量,为开发动物废弃物资源提供生物材料。
1 材料与方法
1.1 试验材料
1.1.1 菌种
牛、羊瘤胃富集菌种,保藏于实验室。
1.1.2 羽毛采集及处理
羽毛采集于北京昌平南口试验基地;新鲜废弃的42日龄白羽肉鸡羽毛。羽毛处理:剔除羽毛中鸡肉残渣、血块、脚皮等杂质,用水反复冲洗至洁净状态,暴晒晾干。为保证羽毛底物均匀性和稳定性,剔除粗大成羽,粉碎后过18目筛,取筛上物作为羽毛培养基底物。
1.1.3 培养基
1)LB液体培养基:蛋白胨10 g/L、酵母膏5 g/L、NaCl 10 g/L,自然pH,121 ℃灭菌20 min。
2)LB固体培养基:蛋白胨10 g/L、酵母膏5 g/L、NaCl 10 g/L、琼脂15 g/L,自然pH,121 ℃灭菌20 min。
3)酪蛋白培养基:干酪素(酪蛋白)10 g/L、牛肉浸粉 3 g/L、NaCl 5 g/L、KH2PO42 g/L、琼脂15 g/L,pH 7.0,115 ℃灭菌30 min。
4)羽毛培养基1:完整羽毛1根、营养盐溶液10 mL(NaCl 0.5 g/L、K2HPO41.4 g/L、KH2PO40.7 g/L、MgSO40.1 g/L),pH 7.0,121 ℃灭菌20 min。
5)羽毛培养基2:羽毛粉1%(m/v)、营养盐溶液100 mL(NaCl 0.5 g/L、K2HPO41.4 g/L、KH2PO40.7 g/L、MgSO40.1 g/L),pH 7.0,121 ℃灭菌20 min。
1.2 试验方法
1.2.1 菌种初筛
将活化的菌液点图于酪蛋白培养基,设置5个重复,37 ℃培养24 h,观察并测量降解圈直径和菌落直径,计算降解圈直径/菌落直径的比值。选择比值大、透明度高的菌株作为复筛菌株。
1.2.2 菌种复筛
将活化的菌液以2%(v/v)的接种量分别接种于羽毛培养基1和2中,37 ℃、180 r/min振荡培养3 d。分别设置无菌空白对照组。观察记录羽毛培养基1中完整羽毛降解情况。试验结束后测定羽毛培养基2的降解液可溶性蛋白含量。
1.2.3 菌种鉴定
1.2.3.1 菌落和细菌形态观察
用平板画线法将菌株NLG1接种在LB固体培养基上,37 ℃培养24 h,肉眼观察菌落形状、颜色、表面质地和菌落边缘等形态,并进行革兰氏染色制片观察。
1.2.3.2 细菌生物学鉴定
菌株NLG1经多次纯化传代后,送至生工生物工程(上海)股份有限公司进行细菌16S rDNA基因测序。将测得序列结果在NCBI的BLAST软件与GenBank数据库已测标准菌株进行比对。采用MEGA 4构建Neighbor-joining系统发育树。
1.2.4 细菌生长曲线测定
将菌株NLG1接种在LB液体培养基中连续培养24 h,每小时取样1次,在600 nm下测定菌液吸光度(OD )并绘制细菌生长曲线。
1.2.5 培养条件优化
活化菌液于无菌离心管中4 000 r/min离心10 min,弃上清液,留沉淀,无菌生理盐水反复洗涤重悬2次,制成体积为1 mL、活菌数为107CFU/mL的菌种重悬液。将菌种重悬液转接于羽毛培养基2中,摇床180 r/min、37 ℃培养3 d。改变温度(25、27、29、31、33、35、37、41、43 ℃)、初始pH(5、6、7、8、9、10、11、12)、活菌数(106、107、108、109CFU/mL)、底物浓度(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%)、外加2%碳源(葡萄糖、蔗糖、麦芽糖、可溶性淀粉)和发酵时间(0、1、2、3、4、5、6、7、8 d),研究发酵条件对菌株NLG1羽毛降解的影响,测定发酵液可溶性蛋白含量。
1.2.6 可溶性蛋白含量测定
采用考马斯亮蓝G250法[15]测定羽毛发酵液中可溶性蛋白含量。
1.2.7 上清液氨基酸成分分析
以优化后条件进行羽毛发酵,取培养0(当天)和3 d的发酵液,4 ℃、5 000 r/min离心10 min,弃沉淀,取上清液并过滤膜过滤。参照QB/T 18246—2000,采用全自动氨基酸分析仪(日立L-8900,日本)测定氨基酸总量。取一定量样品上清液与磺基水杨酸均匀混合,于4 ℃静置60 min后采用低温离心机12 000 r/min离心20 min,除去样液中多肽或小肽后采用全自动氨基酸分析仪测定游离氨基酸含量。
1.3 数据统计与分析
试验数据采用统计软件SPSS 25.0中one-way ANOVA进行单因素方差分析,采用Duncan氏法进行多重比较。以P<0.05为显著性判断标准。
2 结果与分析
2.1 菌株初筛结果
通过酪蛋白培养基进行初筛,共得到16株降解酪蛋白、产生透明圈的菌株。根据透明圈直径/菌落直径的比值大小进行比较,留取50%株菌作为后续试验用菌。初筛结果如表1和图1所示。

表1 不同菌株酪蛋白平板培养基产圈情况

图1 初筛菌株产圈能力
2.2 菌株复筛结果
分别接种8株初筛菌株的羽毛培养基1、2的降解情况、降解液可溶性蛋白含量测定结果分别见图2、图3。为保证结果可靠性,选择羽毛发育程度、形态、质量相同的单根完整羽毛制作羽毛培养基1。图2所示,以空白(无菌)培养基为对照,经3 d培养后,除接种NLG2和NLG6的羽毛降解不明显外,其余菌株均能将培养基羽毛不同程度降解,其中NLG1和S2-2可将其降解为细碎粉状,S1-1、LY、S1-2和S2-1则将其降解为羽毛段或仅剩羽干。研究发现在羽毛降解中,菌株NLG1和S2-2降解羽毛速度快、降解完整性更高。
羽毛培养基2的降解液可溶性蛋白含量测定结果如图3所示。所有接种菌液的培养基,其降解液可溶性蛋白含量均较空白对照组显著增加(P<0.05)。其中接种NLG1的羽毛降解液可溶性蛋白含量最高,为(9.21±0.06) μg/mL。
结合羽毛培养基1、2的结果,菌株NLG1可快速降解羽毛、可溶性蛋白含量高,确定其为目标菌株。

图中对应各菌株接种顺序从左到右依次为:空白(无菌)、NLG1、NLG2、NLG6、S1-1、S1-2、S2-1、S2-2、LY。

数据柱标注不同小写字母表示差异显著(P<0.05)。下图同。
2.3 菌株鉴定结果
2.3.1 菌落形态和染色结果
将菌株NLG1接种于LB固体培养基37 ℃恒温培养24 h,肉眼观察结果,如图4所示,培养初期,菌落形态接近圆形、颜色浅黄且不透明,表面光滑边缘整齐;培养后期,菌落颜色呈白色或乳白色,表面粗糙不规则、有皱褶,中间有突起或凹陷,边缘不整齐,四周云雾状扩散。将该菌进行革兰氏染色,结果如图4所示,染色后颜色呈紫色,形态为杆状,有芽孢,故该菌株为革兰氏阳性(G+)芽孢杆菌。

A:菌株NLG1在LB固体培养基的菌落形态;B:菌株NLG1细菌革兰氏染色结果(100×)。
2.3.2 菌株16S rDNA鉴定结果
经总DNA的提取、扩增,送至生工基因测序后得到的结果在NCBI的BLAST软件与GenBank数据库已测标准菌株基因序列进行比对分析。结果如图5所示,菌株NLG1的16S rDNA基因序列与贝莱斯芽孢杆菌NR 075005.2 (BacillusvelezensisNR 075005.2)具有同源性,长度约1 484 bp,GenBank保守序列登录号为MZ 959415。综合形态学和分子鉴定的结果,初步判定并命名为贝莱斯芽孢杆菌NLG1(BacillusvelezensisNLG1)。
2.4 菌株NLG1生长曲线
由图6可知,菌株NLG1在0~3 h进入发育迟缓期;在3~5 h迅速繁殖进入生长对数期;随后生长速度变缓,在13~15 h进入稳定期;培养时长超过15 h后进入衰亡期。

Bacillus subtilis:枯草芽孢杆菌;Bacillus velezensis:贝莱斯芽孢杆菌;Bacillus vietnamensis:越南芽孢杆菌;Bacillus sporothermodurans:耐热芽孢杆菌。
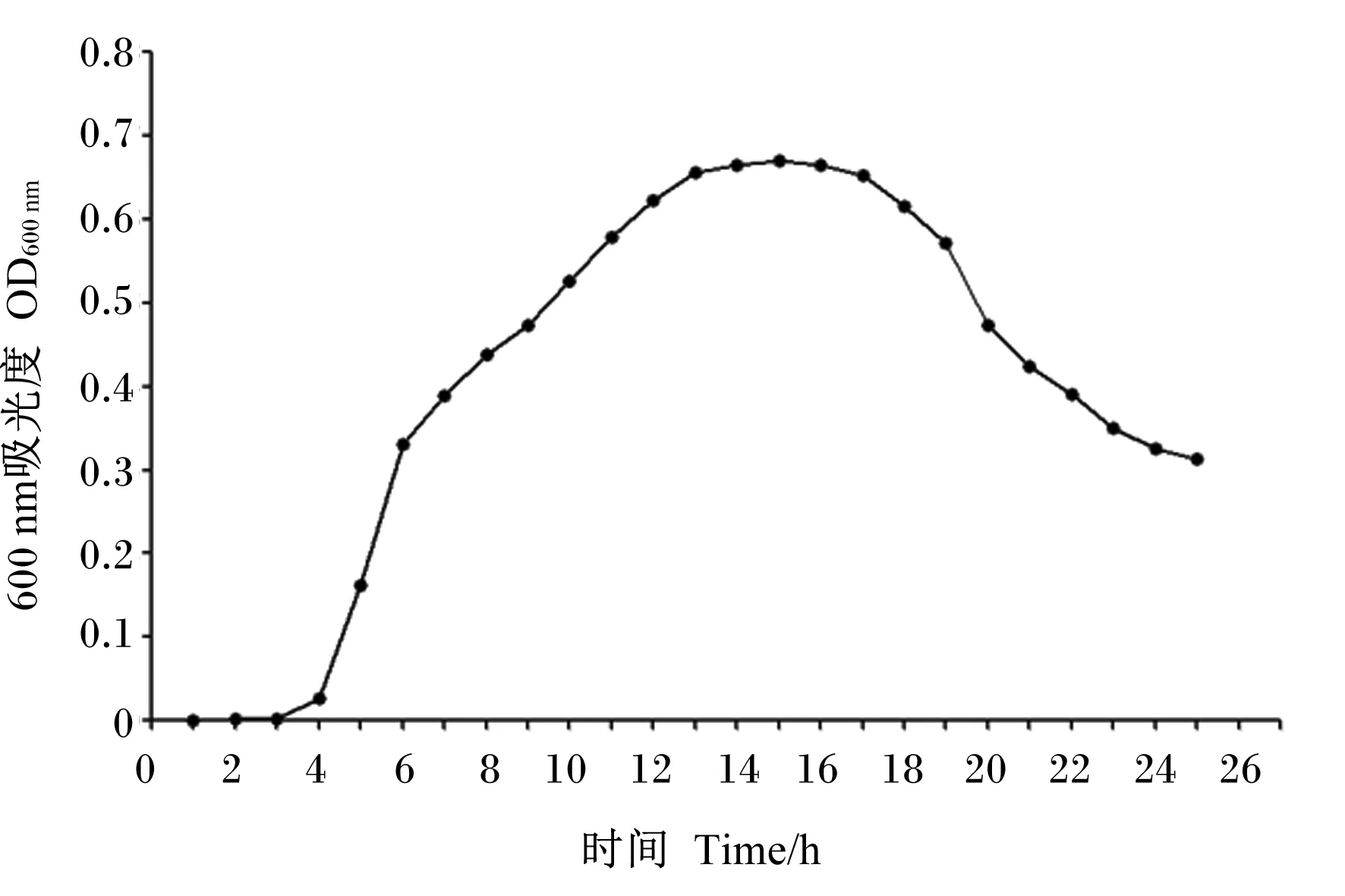
图6 菌株NLG1的生长曲线
2.5 培养条件优化结果
2.5.1 温度对菌株NLG1羽毛发酵产可溶性蛋白含量的影响
由图7可知,27 ℃为其降解羽毛的最适温度,测得可溶性蛋白含量最高,为(23.73±0.07) μg/mL,较其他温度条件均差异显著(P<0.05)。
2.5.2 初始pH对菌株NLG1羽毛发酵产可溶性蛋白含量的影响
由图8可知,发酵初始pH由5增加至10时,羽毛降解液中可溶性蛋白含量线性增加,并达到最高值(34.20±0.57) μg/mL;当初始pH增加至11、12时,降解液中可溶性蛋白含量迅速降低后再次增加,且与初始pH为10时可溶性蛋白含量差异不显著(P>0.05)。

图7 温度对菌株NLG1降解羽毛产

图8 初始pH对菌株NLG1降解羽毛产
2.5.3 底物浓度对菌株NLG1羽毛发酵产可溶性蛋白含量的影响
由图9可知,底物浓度由0.5%增加至3.0%,降解液中可溶性蛋白含量呈先增加后降低,并在底物浓度为2.5%,可溶性蛋白含量抵达峰值为(38.56±2.21) μg/mL,且相对其他底物浓度可溶性蛋白含量均差异显著(P<0.05)。因此,2.5%的底物浓度更利于菌株NLG1降解羽毛。

图9 底物浓度对菌株NLG1降解羽毛产
2.5.4 活菌数对菌株NLG1羽毛发酵产可溶性蛋白含量的影响
由图10可知,接种活菌数由106CFU/mL增加至109CFU/mL时,降解液中可溶性蛋白含量随接种活菌数浓度增加呈线性增加趋势。以此说明,在时间及其他各条件不变的情况下,接入活菌数越多对羽毛降解和可溶性蛋白产生越有利。
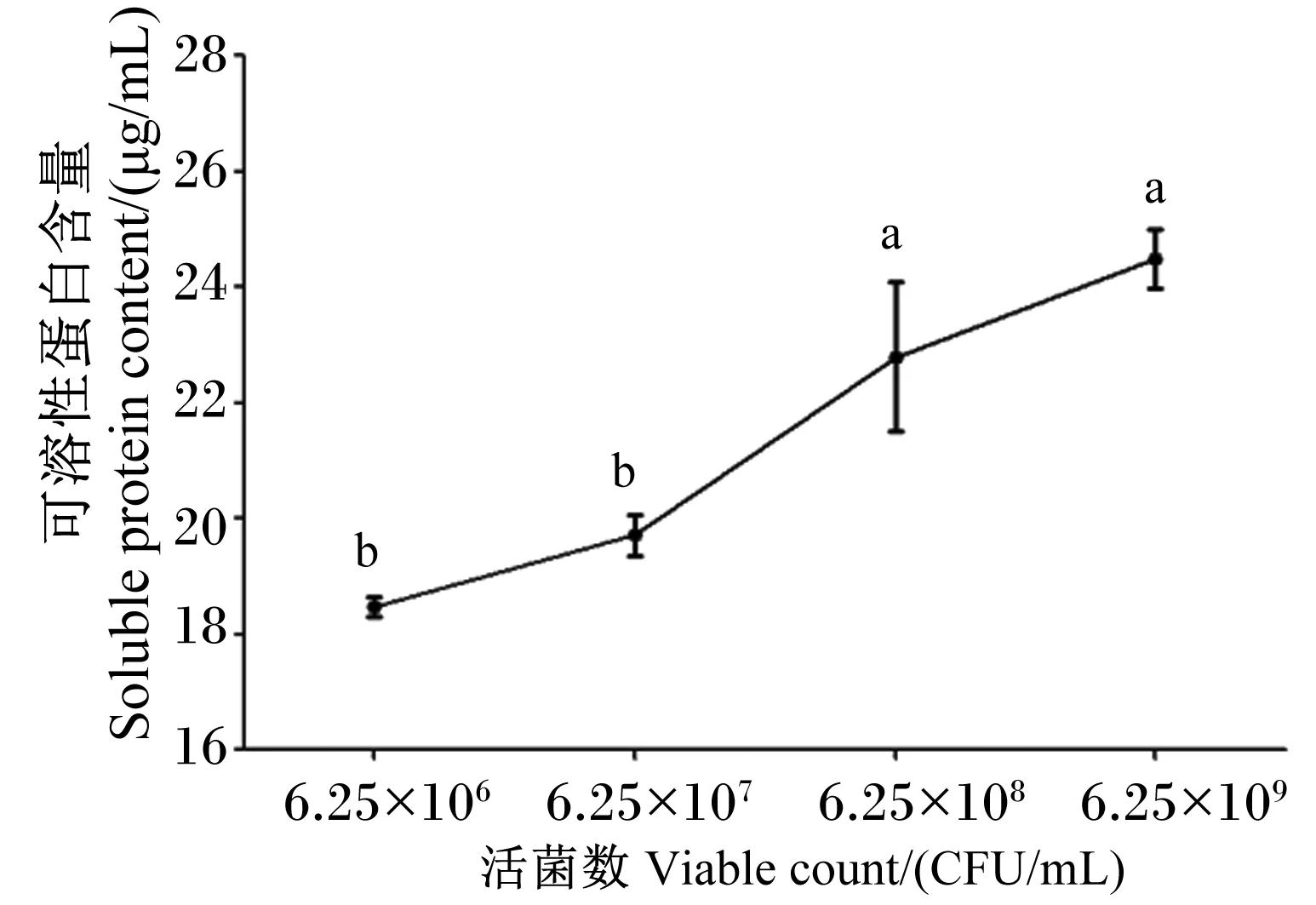
图10 活菌数对菌株NLG1降解羽毛产
2.5.5 外加碳源对菌株NLG1羽毛发酵产可溶性蛋白含量的影响
由图11可知,不添加任何外加碳源的对照组降解液中可溶性蛋白含量较添加任意外加碳源组均差异显著(P<0.05);可溶性淀粉组与麦芽糖组降解液可溶性蛋白含量之间差异不显著(P>0.05),与其他外加碳源组均差异显著(P<0.05)。因此,其他条件稳定不变的条件下,在菌株NLG1降解羽毛过程中额外补充可溶性淀粉更利于羽毛快速降解、释放可溶性蛋白。

图11 外加碳源对菌株NLG1降解羽毛
2.5.6 发酵时间对菌株NLG1羽毛发酵产可溶性蛋白含量的影响
由图12可知,降解液中可溶性蛋白含量呈增加、平稳、降低、再平稳的趋势。在发酵的第3天,可溶性蛋白含量迅速增加到(32.76±0.07) μg/mL;在发酵的第3~5天维持不变,自第6天起可溶性蛋白含量降低且平稳。
图13为菌株NLG1在0~8 d内羽毛降解变化图。瓶中羽毛随时间推移,羽干、羽枝逐渐被降解,降解液颜色变深、液体变浑浊。
2.6 上清液氨基酸成分分析结果
2.6.1 羽毛降解液中氨基酸总量测定结果
由表2可知,在第0天的羽毛发酵液中虽然能检测出17种氨基酸,但各个氨基酸的检出量极低,氨基酸总量也仅为27.41 mg/g;在第3天的羽毛发酵液中检测出的氨基酸种类保持不变,但各个氨基酸的检出量和总氨基酸含量均有所增加。除组氨酸、蛋氨酸含量增加较少外,其余各个氨基酸含量都有较大幅度提高,尤其半胱氨酸含量增加了14.24 mg/g。
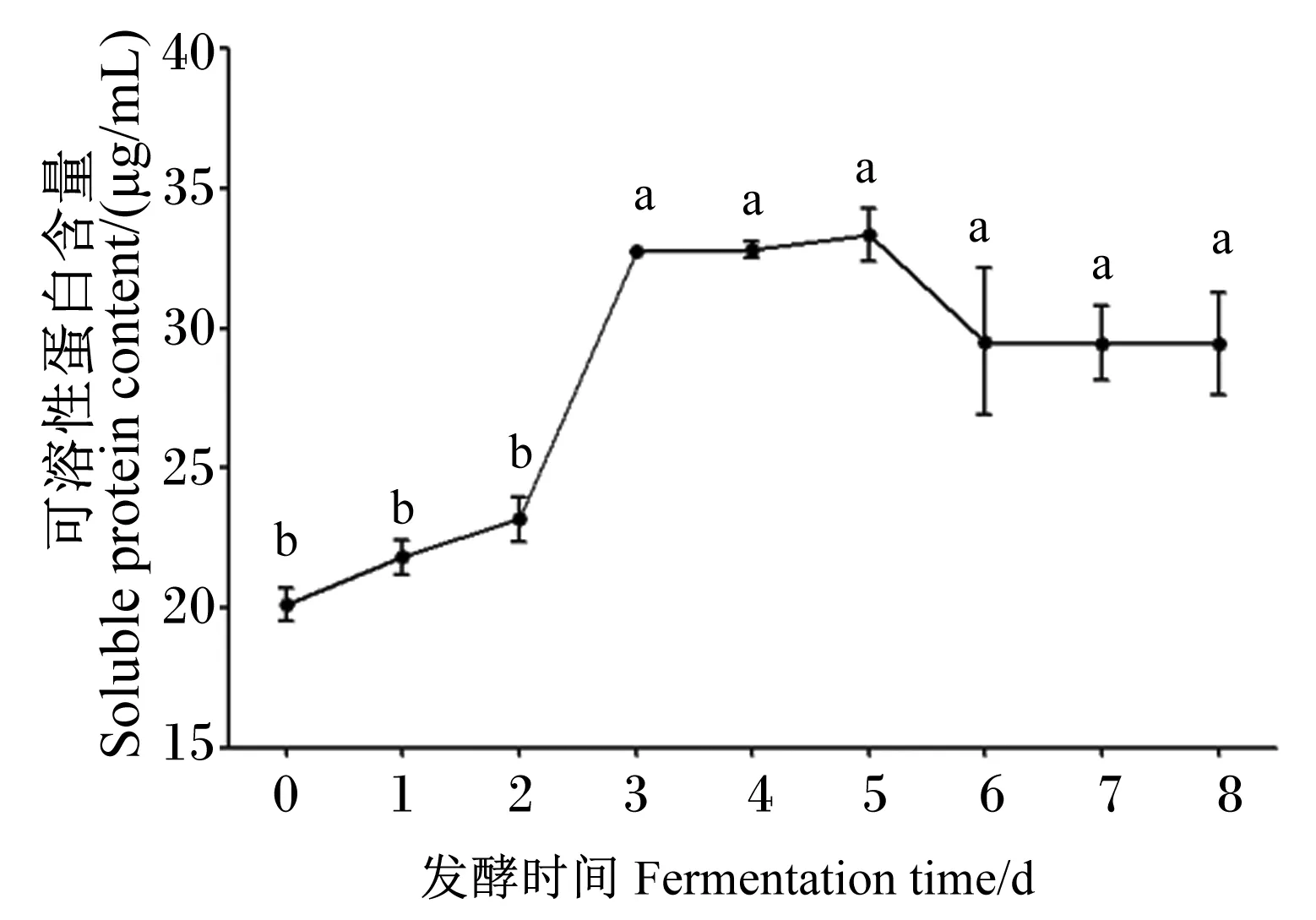
图12 发酵时间对菌株NLG1降解羽毛

图13 菌株NLG1羽毛降解过程
2.6.2 羽毛降解液中游离氨基酸含量测定结果
在NLG1降解的第0天,从上清液中检测到包括基础游离氨基酸及其他游离氨基酸在内的游离氨基酸共计23种。除此之外检测出尿素、牛磺酸和肌肽,但未检测出胱氨酸和苯丙氨酸这2种基础游离氨基酸。降解第3天在羽毛降解上清液中可检测出18种基础氨基酸及其另外10种游离氨基酸衍生物、尿素、牛磺酸和肌肽。经3 d降解后的上清液中除甘氨酸、鸟氨酸和羟脯氨酸含量分别降低了0.012 2、0.000 5和0.561 0 mg/g外,其余游离氨基酸、衍生物等均有较大程度的增加。基础氨基酸中缬氨酸、苯丙氨酸、亮氨酸、酪氨酸、异亮氨酸谷氨酸和丙氨酸含量增加明显。而其他氨基酸中β-丙氨酸含量有大幅增加,羟脯氨酸和鸟氨酸含量降低;通过检测发现尿素、牛磺酸和肌肽含量也有增加。
3 讨 论
3.1 不同培养条件对羽毛降解的影响
温度、初始pH、底物浓度、活菌数和发酵时间以及适合的碳源是影响羽毛降解的必要条件,更是影响微生物生长及代谢的重要因素。尹静等[16]从腐烂蓝藻中分离的粘质沙雷氏菌SYBC YH(SerratiamarcescensSYBC YH)降解羽毛产可溶性蛋白最适温度为40 ℃,最适pH为7。本研究所采用的菌株产可溶性蛋白的发酵温度、初始pH作用范围更广,温度可为25.0~43.0 ℃,最适温度为27.0 ℃;初始pH可为5~12,最适pH为10。通过调节温度以及初始pH发现,该菌的羽毛降解能力在接近室温、初始pH为碱性时更强。傅伟[9]在研究中证明,用0.1% Ca(OH)2处理3 h对微生物降解羽毛具有促进作用。本试验研究发现,初始pH 10~12出现折线趋势可能也是这一原因引起。羽毛作为唯一碳、氮源底物,浓度低时微生物最大限度利用羽毛、释放可溶性蛋白,底物消耗殆尽后,可溶性蛋白可充当二次底物导致消耗现象;底物过剩,导致培养基密集度和黏度增加,致使通氧量不足,引发微生物的底物消耗能力受限,影响可溶性蛋白含量[17]。当微生物降解羽毛的作用时间以及底物浓度一定时,添加的活菌越多羽毛降解速度越快、可溶性蛋白产量越多。额外添加的碳源及时缓解了羽毛底物碳源匮乏问题,同时也能诱导微生物产生诱导型羽毛降解酶[18]。本试验研究发现,添加可溶性淀粉与添加麦芽糖的可溶性蛋白含量差异不显著,而结果优于添加麦芽糖组,可能是可溶性淀粉水解过程中产生多种类碳源均能进一步促进菌株生长、作用,且可溶性淀粉取材廉价,更适作为试验研究的优选外加碳源。发酵是微生物降解羽毛保持动态平衡的过程。郭刚等[19]所采用的地衣芽孢杆菌在发酵第3天时可溶性蛋白含量增长至最高后迅速降低。本研究所采用菌株发酵3~5 d亦使可溶性蛋白含量维持稳定状态,羽毛分解更彻底。

表2 羽毛上清液中总氨基酸组成及含量变化

表3 羽毛上清液中游离氨基酸组成及含量变化
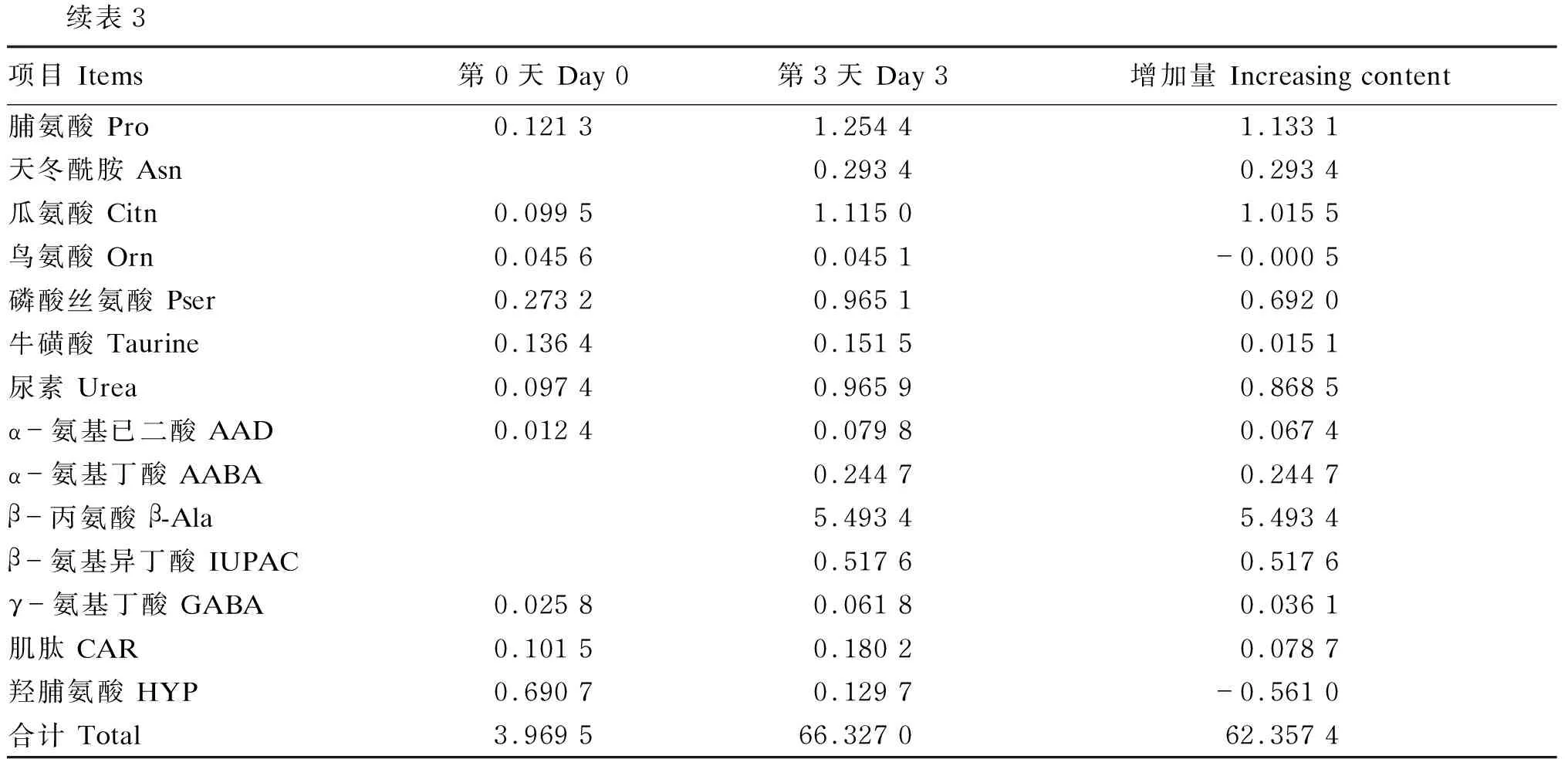
续表3项目 Items第0天 Day 0 第3天 Day 3 增加量 Increasing content脯氨酸 Pro0.121 31.254 41.133 1天冬酰胺 Asn0.293 40.293 4瓜氨酸 Citn0.099 51.115 01.015 5鸟氨酸 Orn0.045 60.045 1-0.000 5磷酸丝氨酸 Pser0.273 20.965 10.692 0牛磺酸 Taurine0.136 40.151 50.015 1尿素 Urea0.097 40.965 90.868 5α-氨基已二酸 AAD0.012 40.079 80.067 4α-氨基丁酸 AABA0.244 70.244 7β-丙氨酸 β-Ala5.493 45.493 4β-氨基异丁酸 IUPAC0.517 60.517 6γ-氨基丁酸 GABA0.025 80.061 80.036 1肌肽 CAR0.101 50.180 20.078 7羟脯氨酸 HYP0.690 70.129 7-0.561 0合计 Total3.969 566.327 062.357 4
3.2 羽毛上清液氨基酸成分及含量变化的分析
羽毛是由多种氨基酸组成的复杂蛋白质,羽毛降解菌将其分解成小分子质量蛋白质、多肽类、游离氨基酸及其他物质。本试验测定发酵前后的氨基酸组分,发现不同发酵条件和微生物可影响羽毛降解液的氨基酸种类[13,20-21]。发酵后上清液中氨基酸含量增加,其中半胱氨酸含量最多;除色氨酸未检出外,其余7种必需氨基酸占氨基酸总含量的34.83%。半胱氨酸的产生意味着存在大量二硫键的羽毛结构被打开,通过微生物降解将其还原成胱氨酸,推测本研究采用的菌株NLG1具有二硫键还原作用,同样在涂国全等[7]的研究中发现羽毛降解液中存在大量二硫键还原酶。色氨酸在羽毛降解过程中可能被微生物作为二次底物消耗转化为其他物质。在游离氨基酸检测中,除检测出了大量的尿素外还检测出β-丙氨酸等氨基酸衍生物,因此说明,氨基酸总量降低、游离氨基酸含量增加,是由于微生物降解羽毛过程中发生了大量的转氨基、脱氨基作用。发酵后羽毛上清液中检测出必需游离氨基酸总量占总检出量的85.07%,如缬氨酸、苯丙氨酸、赖氨酸、异亮氨酸、亮氨酸、苏氨酸等。缬氨酸是一种支链氨基酸,也是动物必需氨基酸之一,是动物体蛋白质的重要组成成分[22],也是蛋白质合成代谢中的重要参与者[23],能促进机体生长[24]、能量供给[25]、增强免疫[26]及改善畜产品品质[27]。苯丙氨酸既属于芳香族氨基酸又属于必需氨基酸,是药物的中间体和原料,同时也应用于化工和食品领域生产护肤品和添加剂阿斯巴甜的原料[28]。可见,羽毛降解液是一种氨基酸来源,也是必需氨酸的非常重要来源,为后期应用奠定基础。
4 结 论
① 本试验筛选出1株可降解羽毛的天然微生物菌株,鉴定并命名为贝莱斯芽孢杆菌NLG1。
② 基于羽毛培养基,贝莱斯芽孢杆菌降解羽毛培养条件优化为:温度27 ℃,初始pH 10,接种活菌数109CFU/mL,底物浓度2.5%,外加碳源为可溶性淀粉,培养时间3 d。
③ 贝莱斯芽孢杆菌可降解羽毛,羽毛发酵液上清液中可溶性蛋白含量为(32.76±0.07) μg/mL,水解氨基酸总量提高了87.67 mg/g,游离氨基酸及衍生物总量提高了62.36 mg/g,改善了羽毛的营养价值和氨基酸组成结构。
