发酵金针菇多糖通过核转录因子-κB-NOD样受体家族含pyrin结构域蛋白3信号通路抑制巨噬细胞炎症反应
2022-03-10高青莹徐建雄
马 升 高青莹 徐建雄
(上海交通大学农业与生物学院,上海市兽医生物技术重点实验室,上海200240)
炎症反应是机体受到损伤或有害刺激后产生的一种适应性反应[1],其与许多疾病如肝硬化、癌症和糖尿病等慢性疾病的发展联系密切[2]。巨噬细胞是一种位于组织内的白血球,可以对细胞残片及病原体进行吞噬和消化,当受到脂多糖(LPS)等刺激后会出现炎症反应,表现为一氧化氮(NO)分泌增加,诱导型一氧化氮合酶(iNOS)和肿瘤坏死因子-α(TNF-α)的表达升高[3]。核转录因子-κB(NF-κB)是参与细胞对外界刺激响应的蛋白,在调控机体炎症中发挥了重要作用,同时也是NOD样受体家族含pyrin结构域蛋白3(NLRP3)信号通路激活的启动信号[4]。NF-κB p65通常与核转录因子-κB抑制蛋白α(IκBα)以非活性形式结合在细胞质上。当细胞被细菌或病毒刺激时,IκBα和NF-κB p65被降解,从而进入细胞核执行其功能[5]。研究发现,NLRP3信号通路可识别外来微生物感染和细胞内危险信号[6],通过NLRP3炎性小体的聚集介导宿主对微生物感染和细胞损伤的免疫反应,导致半胱天冬蛋白酶-1(Caspase-1)蛋白转化为活化的Caspase-1以及细胞因子前体白细胞介素-1β(Pro-IL-1β)和前体白细胞介素-18(Pro-IL-18)转化为成熟的白细胞介素-1β(IL-1β)和白细胞介素-18(IL-18)[7]。
金针菇(Flammulinavelutipes)学名毛柄金钱菇,因其营养丰富和口感鲜美而备受消费者喜爱[8]。金针菇富含多糖、甾醇、蛋白质和膳食纤维等多种活性物质[9]。金针菇多糖(FVP)是从金针菇中提取的水溶性多糖[10],具有多种生物活性,体现在抗氧化[11]、促进肠道健康[12]、免疫调节[13]等方面。FVP能增强巨噬细胞的吞噬活性,调控巨噬细胞分泌炎性介质、干扰素和细胞因子等,进而增强机体的抗炎能力[14]。Zhao等[15]发现FVP可以减轻溃疡性结肠炎症状,降低炎症基因的表达水平,并增强机体的代谢和免疫能力。
发酵具有周期短、成本低、产量大、有工业化生产前景等优势,金针菇在发酵过程中除产生菌丝体外,还会在发酵液中产生多糖、多肽、生物碱、酶、氨基酸、维生素和植物激素等活性物质[16]。研究表明,很多食用菌液体发酵的菌丝体多糖含量远高于子实体[17]。曾璇竹等[18]研究了香菇多糖发酵工艺的优化及其抗氧化活性,结果表明香菇发酵后多糖提取量和抗氧化活性显著升高。刘自尧等[19]研究发现,槐耳-板蓝根发酵后发酵体系中具有抗炎、抗肿瘤作用的多糖含量逐渐升高,且发酵后的多糖提取物能更明显抑制LPS诱导的RAW 264.7巨噬细胞NO和TNF-α的分泌。
本课题组前期对金针菇进行发酵处理并从发酵金针菇中提取多糖,通过研究发现,相比FVP,发酵金针菇多糖(FFVP)分子聚集作用增强,单糖组成中甘露糖比例显著升高,同浓度下FFVP的抗氧化活性高于FVP[20]。然而,FVP和FFVP调节巨噬细胞炎症反应的作用及可能的机制还未知。本研究采用LPS诱导构建巨噬细胞炎症反应模型,探讨FVP和FFVP抑制巨噬细胞炎症反应的作用及机制,以期为合理利用金针菇提供理论基础,并为抑制炎症反应提供新思路。
1 材料与方法
1.1 材料与试剂
FVP和FFVP,由本实验室提取纯化[20];小鼠单核巨噬细胞RAW264.7,购自中国科学院细胞库;LPS,购自Sigma公司;杜氏磷酸缓冲液(DPBS)、胎牛血清、双抗、DMEM培养基、中性红溶液、脱脂奶粉、RIPA裂解液、BAY11-7082(NF-κB抑制剂)、苯甲基磺酰氟(PMSF)、NO试剂盒、活性氧(ROS)试剂盒和CCK-8试剂盒,购自上海碧云天生物有限公司;一抗IκBα、NLRP3、Caspase-1、IL-1β、β-肌动蛋白(β-actin)和二抗山羊抗兔免疫球蛋白G (goat anti-rabbit IgG),购自上海优宁维生物科技股份有限公司;酶联免疫吸附测定(ELISA)试剂盒、总RNA提取试剂盒、逆转录试剂盒和定量PCR(q-PCR)试剂盒,购自南京建成生物工程研究所。
1.2 仪器与设备
细胞培养箱(Heracell-240i),购自赛默飞世尔科技公司;荧光显微镜(ECLIPSE NI),购自尼康仪器有限公司;酶标仪(Synergy-2),购自泽泉国际集团有限公司。
1.3 试验方法
1.3.1 细胞培养与处理
RAW264.7培养于含10%胎牛血清、1%双抗(100 IU/mL青霉素和100 IU/mL链霉素)和90% DMEM培养基的工作液,置于37 ℃、5% CO2的培养箱中。
1.3.1.1 LPS诱导RAW264.7炎症反应模型的建立
将处于对数生长期的RAW264.7按照1×105个/孔的密度接种于96孔板,每孔100 μL。将细胞培养板置于培养箱培养12 h,使细胞贴壁生长。取出细胞培养板,吸去培养基。每孔添加100 μL含LPS的工作液,设置LPS浓度分别为0、0.1、0.5、1.0、1.5和2.0 μg/mL,培养箱中孵育24 h。
1.3.1.2 FVP/FFVP作用浓度的选择
细胞接种方式同1.3.1.1,每孔添加100 μL含FVP或FFVP的工作液,设置FVP或FFVP浓度分别为0、25、50、75、100、125和150 μg/mL,培养箱中孵育24 h。
1.3.1.3 FVP/FFVP处理LPS诱导的RAW264.7炎症反应模型
细胞接种方式同1.3.1.1,将细胞分为CON组(正常培养基)、LPS组(正常培养基+1 μg/mL LPS)、FVP组(正常培养基+1 μg/mL LPS+25、50或100 μg/mL FVP)和FFVP组(正常培养基+1 μg/mL LPS+25、50或100 μg/mL FFVP),培养箱中孵育24 h。
1.3.1.4 FVP/FFVP及BAY11-7082处理LPS诱导RAW264.7炎症反应模型
细胞接种方式同1.3.1.1,将细胞分为CON组(正常培养基)、LPS组(正常培养基+1 μg/mL LPS)、LPS抑制组(正常培养基+1 μg/mL LPS+10 μmol/L BAY11-7082)(BAY11-7082的浓度参考Ghashghaeinia等[21]的研究)、FVP组(正常培养基+1 μg/mL LPS+100 μg/mL FVP)、FVP抑制组(正常培养基+1 μg/mL LPS+100 μg/mL FVP+10 μmol/L BAY11-7082)、FFVP组(正常培养基+1 μg/mL LPS+100 μg/mL FFVP)和FFVP抑制组(正常培养基+1 μg/mL LPS+100 μg/mL FFVP+10 μmol/L BAY11-7082),培养箱中孵育24 h。
1.3.2 测定指标与方法
1.3.2.1 细胞活力
按1.3.1.1、1.3.1.2和1.3.1.3处理细胞,弃去上清液,用DPBS洗涤2次,将CCK-8与工作液按照1∶10的体积比配制CCK-8工作液,每孔加100 μL CCK-8工作液置于培养箱中继续培养1 h,在波长450 nm处测定吸光度(OD)值[22],按下式计算细胞活力:
R1(%)=100×(ODT-ODB)/(ODC-ODB)。
式中:R1为细胞活力;ODT为试验组OD值;ODB为空白组OD值;ODC为对照组OD值。
1.3.2.2 ROS与NO含量
按1.3.1.3处理细胞,处理完成后,离心取上清,按试剂盒说明书测定各组上清液中的NO含量[23]。细胞用DPBS洗涤2次,将荧光探针2’,7’-二氯荧光乙酰乙酸盐(DCFH-DA)试剂与工作液按照1∶1 000的体积比配制DCFH-DA工作液,然后每孔加2 mL(6孔板)和100 μL(96孔板)DCFH-DA工作液,培养箱中孵育20 min。用荧光显微镜观察6孔板各孔的荧光并拍照,用酶标仪测定96孔板各孔的荧光强度[24],根据下式计算ROS含量:
R2(%)=100×(FIT-FIB)/(FIC-FIB)。
式中:R2为ROS含量;FIT为试验组荧光强度;FIB为空白组荧光强度;FIC为对照组荧光强度。
1.3.2.3 吞噬能力
按1.3.1.3处理细胞,培养24 h后弃培养基,每孔加入50 μL的0.05%中性红溶液,培养4 h后弃去中性红,DPBS洗3次,加入100 μL细胞裂解液,室温放置2 h,用酶标仪测定540 nm处OD值,根据下式计算吞噬指数:
R3(%)=100×ODE/ODC。
式中:R3为吞噬指数;ODE为试验组OD值;ODC为对照组OD值。
1.3.2.4 炎症因子含量
按1.3.1.3处理细胞,培养结束后收集上清液离心,按照ELISA试剂盒说明书测定IL-1β、IL-6、IL-18和TNF-α含量[25]。
1.3.2.5 炎症因子mRNA相对表达量
按1.3.1.3处理细胞,培养结束后收集细胞,使用TRIzol法提取总RNA,加入RNAase-Free水,应用紫外法测定RNA的纯度和浓度。按试剂盒说明书进行反转录、扩增,以β-actin为内参基因,采用2-ΔΔCt法计算目的基因IL-1β、IL-6、IL-18和TNF-α的mRNA相对表达量。引物由生工生物工程(上海)股份有限公司合成,引物信息见表1。
1.3.2.6 Western blot
BAY11-7082是一种NF-κB抑制剂,抑制TNF-α诱导的IκBα磷酸化(p-IκBα),可以完全且特异性地废除NF-κB的DNA结合,下调细胞因子IL-1β、IL-6和TNF-α的表达[26]。为研究FVP和FFVP通过NF-κB-NLRP3信号通路抑制巨噬细胞炎症反应的机制,选用BAY11-7082作为NF-κB抑制剂开展Western blot。
按1.3.1.4处理细胞,培养结束后每孔加入200 μL的RIPA裂解液(含1 mmol/L的PMSF),4 ℃裂解30 min,离心取上清液。使用BCA法测定蛋白浓度,将上清液与5×十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白上样缓冲液按照体积比4∶1混合后置于沸水中煮3~5 min。上样完成后在80(20 min)、120 V(60 min)恒定电压条件下电泳。电泳结束后,将目标蛋白转移至聚偏二氟乙烯(PVDF)膜上。室温下,5%的脱脂奶粉封闭4 h,一抗(IκBα,1∶1 000稀释;NLRP3,1∶1 500稀释;Caspase-1,1∶800稀释;IL-1β,1∶400稀释;β-actin,1∶5 000稀释)孵育,4 ℃振荡过夜。次日于室温下二抗(goat anti-rabbit IgG,1∶5 000稀释)孵育1 h,TBST液洗膜(3次,每次10 min)。加入ECL化学发光液,在凝胶成像系统中显影,利用Image-Pro Plus 6.0软件进行量化。

表1 引物信息
1.4 数据处理与统计分析
每组数据重复3次,取平均值。采用SPSS 18.0软件的单因素方差分析程序进行数据分析,并用LSD法进行多重比较,结果以平均值±标准误(mean±SE)的形式表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 细胞活力
LPS对RAW264.7细胞活力的影响如图1-A所示。相比LPS浓度为0时,LPS浓度等于或超过0.5 μg/mL时细胞活力显著降低(P<0.05);LPS浓度为1.0 μg/mL时细胞活力为LPS浓度为0时的38.52%,再继续升高LPS浓度,细胞活力没有显著变化(P>0.05)。
FVP/FFVP对RAW264.7细胞活力的影响如图1-B所示。在FVP/FFVP浓度低于100 μg/mL时细胞活力呈升高趋势,并呈剂量依赖性;当FVP/FFVP浓度高于100 μg/mL时细胞活力出现下降趋势,表明FVP和FFVP浓度在100 μg/mL以上时对细胞存在一定毒性作用。浓度为100和150 μg/mL时,FFVP组的细胞活力显著高于FVP组(P<0.05)。因此本研究选取1 μg/mL的LPS和25、50、100 μg/mL的FVP/FFVP进行后续试验。
FVP/FFVP对LPS诱导RAW264.7细胞活力的影响如图1-C所示。LPS组的细胞活力为CON组的39.41%(P<0.05);与LPS组相比,25 μg/mL FVP/FFVP处理后,细胞活力均无显著变化(P>0.05),50和100 μg/mL FVP/FFVP处理后,细胞活力显著升高(P<0.05);浓度为100 μg/mL时,FFVP组细胞活力显著高于FVP组(P<0.05)。
2.2 ROS和NO含量
FVP/FFVP对LPS诱导RAW264.7 ROS和NO含量的影响如图2所示。相比CON组,LPS组的ROS和NO含量极显著升高(P<0.01);FVP/FFVP处理后,ROS和NO含量出现降低趋势,并呈剂量依赖性。相同浓度下,FFVP组的NO含量均低于FVP组(P>0.05)。浓度为100 μg/mL时,FFVP组的ROS含量显著低于FVP组(P<0.05);其他浓度下,FFVP组的ROS含量均低于FVP组(P>0.05)。
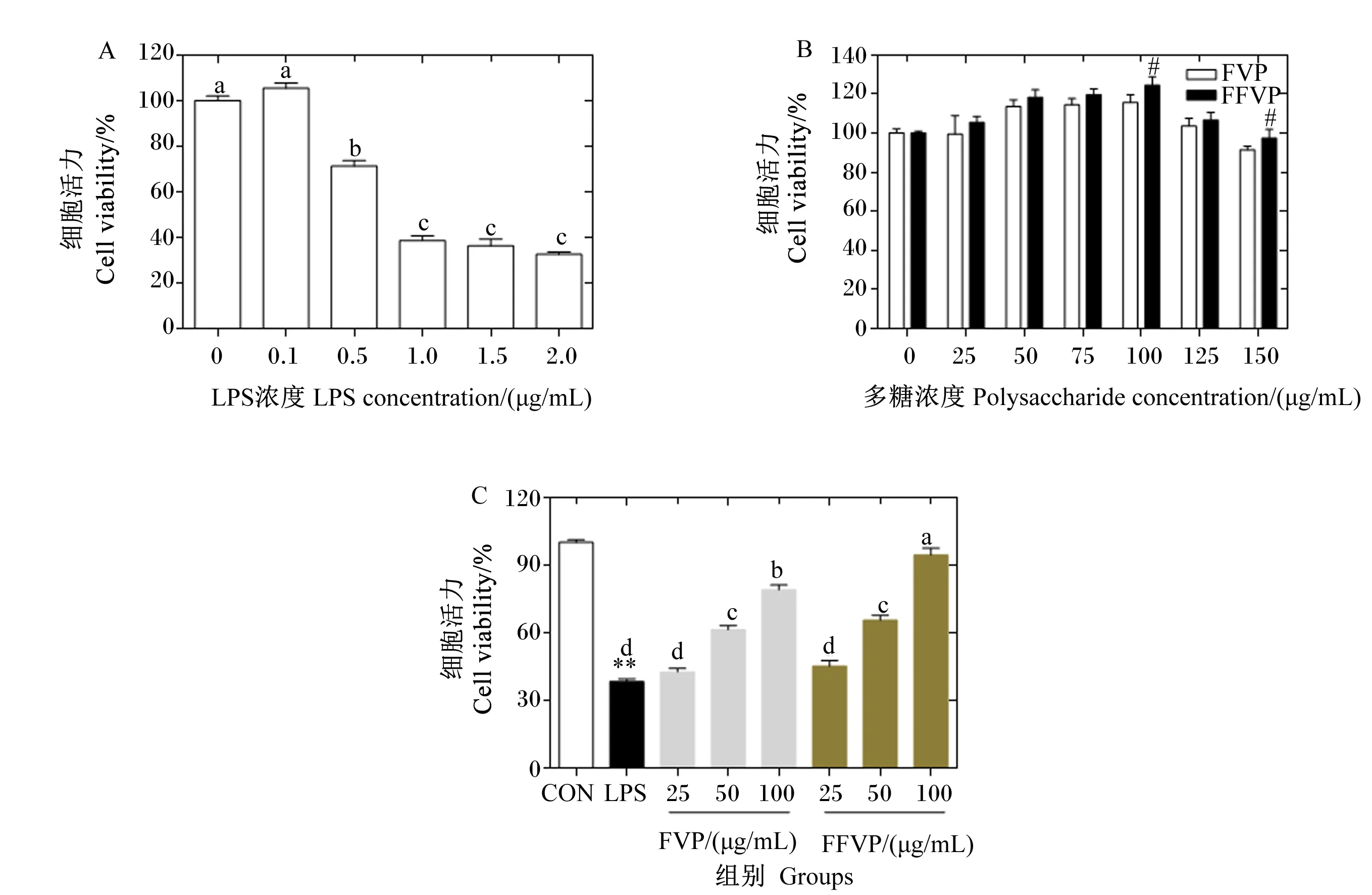
图A:LPS对RAW264.7细胞活力的影响。数据柱标注不同字母表示差异显著(P<0.05)。图B:FVP/FFVP对RAW264.7细胞活力的影响。FFVP组数据柱标注“#”表示与同浓度的FVP组相比差异显著(P<0.05)。图C:FVP/FFVP对LPS诱导RAW264.7细胞活力的影响。LPS组数据柱标注“**”表示与CON组相比差异极显著(P<0.01)。除CON组外,数据柱标注不同字母表示差异显著(P<0.05)。
2.3 吞噬能力
FVP/FFVP对LPS诱导RAW264.7吞噬能力(以吞噬指数表示)的影响如图3所示。相比CON组,LPS组的吞噬能力显著下降(P<0.01),添加FVP和FFVP后,吞噬能力呈升高趋势,存在剂量依赖性,100 μg/mL的FFVP处理细胞后吞噬能力最高。在浓度为50和100 μg/mL时,FFVP组的吞噬能力显著高于FVP组(P<0.05)。
2.4 炎症因子分泌及其基因表达
RAW264.7培养上清液中炎症因子IL-1β、IL-6、IL-18和TNF-α的含量见表2。与CON组相比,LPS组上清液中上述4种炎症因子的含量均极显著增加(P<0.01),而添加FVP/FFVP后上清液中这4种炎症因子的含量均出现下降趋势,并呈剂量依赖性。在浓度为50 μg/mL时,FFVP组的IL-18含量显著低于FVP组(P<0.05);在浓度为100 μg/mL时,FFVP组的IL-6和TNF-α含量显著低于FVP组(P<0.05)。
FVP/FFVP对LPS诱导RAW264.7炎症因子基因表达的影响见图4。与CON组相比,LPS组IL-1β、IL-6、IL-18和TNF-α的mRNA相对表达量极显著升高(P<0.01),添加FVP/FFVP后上述炎症因子的mRNA相对表达量存在下降趋势。FVP和FFVP对IL-1βmRNA相对表达量的影响差异最大,3个浓度下2组间均存在显著差异(P<0.05)。FVP组和FFVP组的IL-18 mRNA相对表达量在浓度为100 μg/mL时差异显著(P<0.05)。
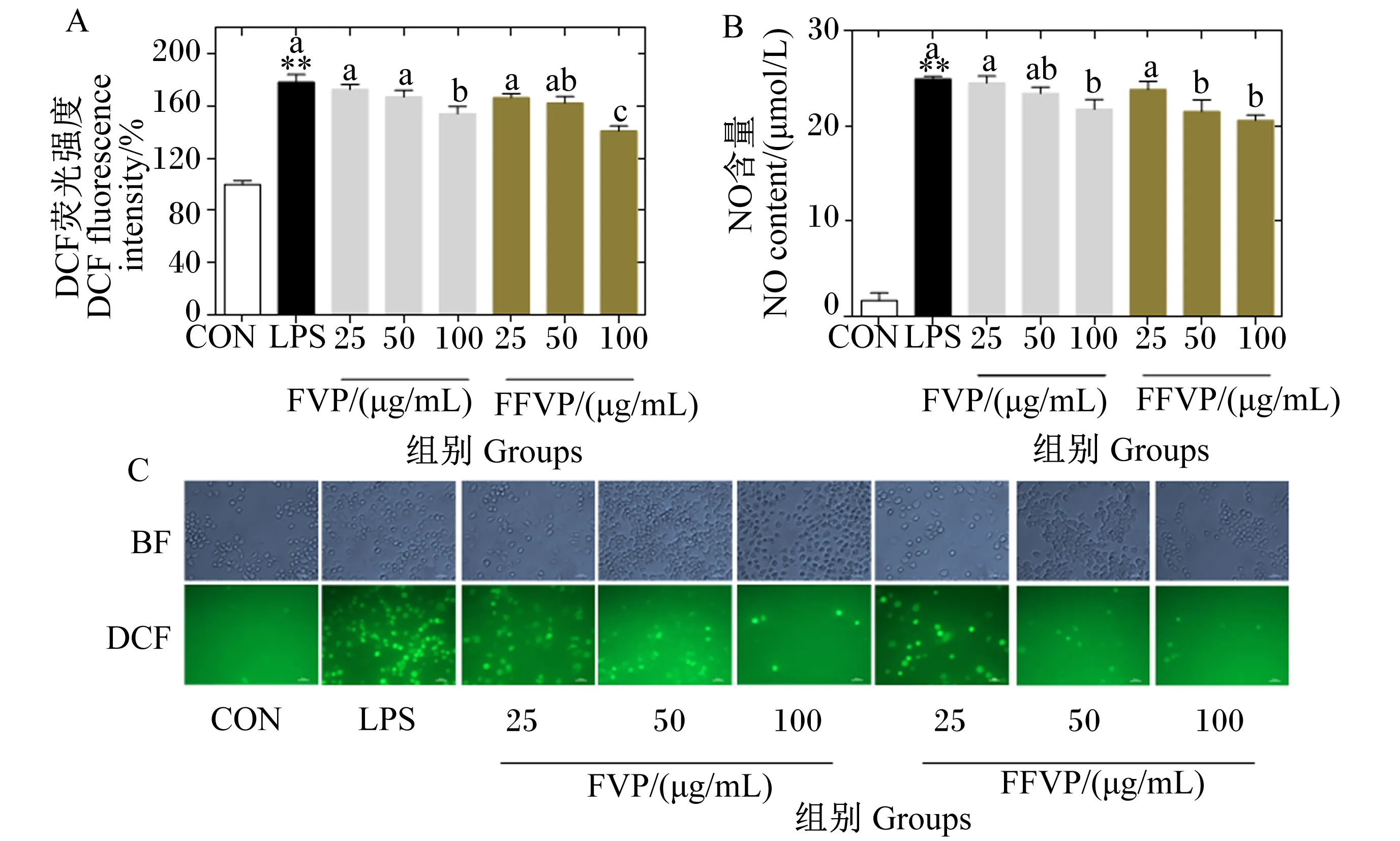
图A和图C:FVP/FFVP对LPS诱导RAW264.7 ROS含量的影响;图B:FVP/FFVP对LPS诱导RAW264.7 NO含量的影响。
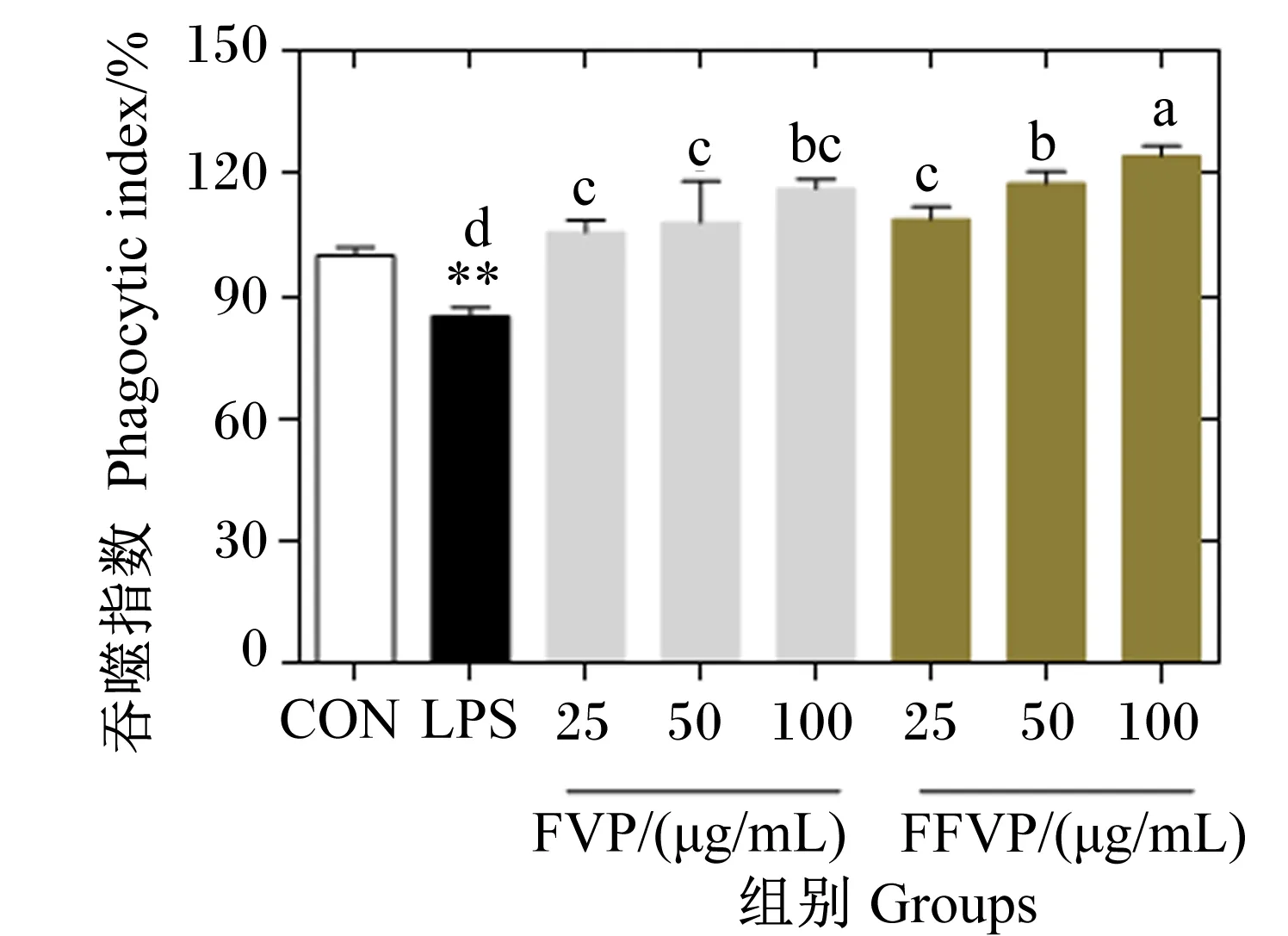
图3 FVP/FFVP对LPS诱导RAW264.7
2.5 p-IκBα、NLRP3、Caspase-1和IL-1β蛋白表达
p-IκBα、NLRP3、Caspase-1和IL-1β蛋白表达如图5所示。相比CON组,LPS组的p-IκBα、NLRP3、Caspase-1和IL-1β的蛋白相对表达量极显著升高(P<0.01)。相比LPS组,单独以BAY11-7082、FVP或FFVP处理后,p-IκBα、NLRP3、Caspase-1和IL-1β的蛋白相对表达量均显著降低(P<0.05)。相比单独以FVP或FFVP处理,同时以BAY11-7082和FVP或FFVP处理后,p-IκBα、NLRP3、Caspase-1和IL-1β的蛋白相对表达量显著降低(P<0.05)。其中,FFVP抑制组与FFVP组p-IκBα、NLRP3、Caspase-1和IL-1β的蛋白相对表达量的比例分别为0.12∶0.48、0.12∶0.61、0.08∶0.47和0.07∶0.43。相比FVP组,FFVP组的p-IκBα、Caspase-1和IL-1β的蛋白相对表达量均显著降低(P<0.05)。
3 讨 论
本研究结果表明,LPS处理RAW264.7后ROS和NO含量极显著升高,吞噬能力极显著降低,IL-1β、IL-6、IL-18和TNF-α含量及其mRNA相对表达量极显著升高;FVP/FFVP处理后,ROS和NO含量以及上述炎症因子的含量和mRNA相对表达量出现降低趋势,吞噬能力呈升高趋势,并呈剂量依赖性。Zhao等[27]研究FVP免疫激活的体内外功能时发现FVP作为一种激活剂可诱导RAW264.7巨噬细胞的M1极化。在动物试验中发现,FVP可以提高小鼠结肠组织免疫调节功能和抗炎活性。苗月[28]研究了FVP对RAW264.7的免疫应答作用,结果表明FVP能显著促进RAW264.7的增殖,提高其吞噬能力,倒置显微镜下观察到FVP处理后RAW264.7的形态由静息变为激活状态,上述研究结果与试验结果一致。

表2 FVP/FFVP对LPS诱导RAW264.7炎症因子分泌的影响
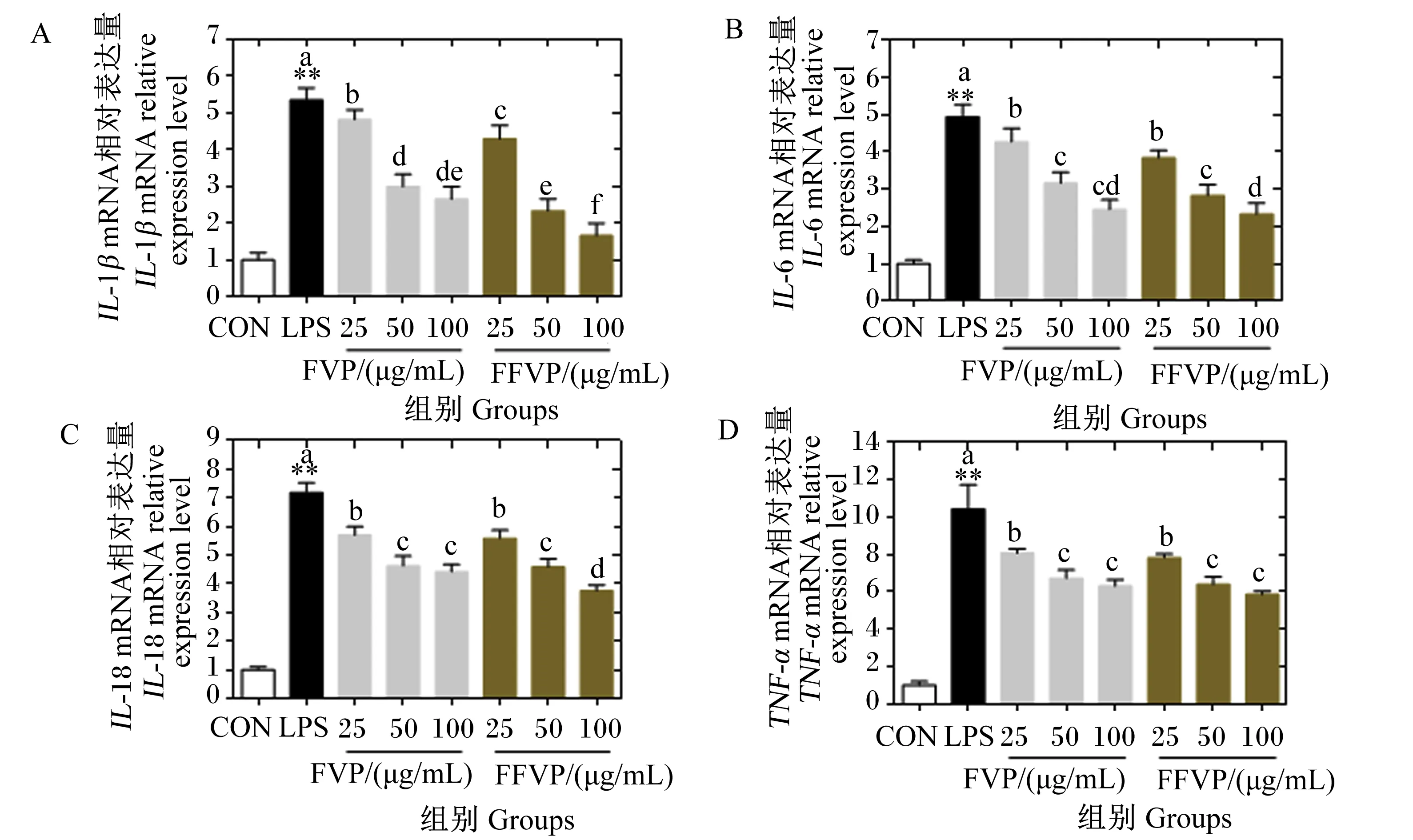
图4 FVP/FFVP对LPS诱导RAW264.7炎症因子基因表达的影响
Western blot结果表明,LPS处理RAW264.7后p-IκBα、NLRP3、Caspase-1和IL-1β的蛋白相对表达量极显著升高;相比LPS组,单独以BAY11-7082、FVP或FFVP处理后,p-IκBα、NLRP3、Caspase-1和IL-1β的蛋白相对表达量显著降低;相比单独以FVP或FFVP处理,同时以BAY11-7082和FVP或FFVP处理后,p-IκBα、NLRP3、Caspase-1和IL-1β的蛋白相对表达量显著降低。研究表明,多糖可以通过NF-κB信号通路调控炎症[29]。Shen等[30]研究发现,木槿多糖可以抑制NF-κB信号通路中IκBα和p65的蛋白表达,进而增强RAW264.7的免疫活性。Gan等[31]的研究表明,枸杞多糖通过上调Toll样受体4(TLR4)的蛋白表达来减轻四氯化碳(CCl4)诱导的氧化损伤、炎症反应和NF-κB信号通路的表达。NF-κB信号通路在转录水平上可以启动NLRP3炎症小体[6,32],其蛋白表达的升高可增强NLRP3蛋白的表达[33]。Li等[34]在小鼠肠道和肠上皮细胞中均检测到NF-κB与NLRP3存在正相关关系。除此之外,多种抗氧化剂都有抑制NF-κB-NLRP3信号通路的作用[35]。ROS的过量产生是导致NF-κB-NLRP3信号通路激活的一个重要原因[36-37]。根据Harijith等[38]的报道,ROS是在线粒体氧化磷酸化过程中由氧还原产生的高活性分子,被认为是NLRP3炎症小体激活的常见触发因素。韩晨阳等[39]研究了樟芝多糖抑制6-羟基多巴胺(6-OHDA)诱导的多巴胺能神经元细胞炎症反应的作用机制,发现樟芝多糖可以通过抑制ROS的分泌降低NF-κB-NLRP3信号通路的活化,进而调节6-OHDA诱导多巴胺能神经元的炎症反应。本研究中,100 μg/mL的FVP/FFVP处理巨噬细胞炎症模型后,ROS含量显著降低,NF-κB-NLRP3信号通路中p-IκBα、NLRP3、Caspase-1和IL-1β的蛋白相对表达量显著降低,与前人研究结果一致。

p-IκBα:磷酸化核转录因子-κB抑制蛋白α phosphorylated nuclear factor-κB inhibitor α;IκBα:核转录因子-κB抑制蛋白α nuclear factor-κB inhibitor α;NLRP3:NOD样受体家族含pyrin结构域蛋白3 NOD-like receptor family pyrin domain-containing protein 3;Caspase-1:半胱天冬蛋白酶-1 cysteinyl aspartate specific proteinase-1;IL-1β:白细胞介素-1β interleukin-1β;β-actin:β-肌动蛋白;LPS:脂多糖 lipopolysaccharide;FVP:金针菇多糖 Flammulina velutipes polysaccharide;FFVP:发酵金针菇多糖 fermented Flammulina velutipes polysaccharide。
FVP和FFVP的浓度为25 μg/mL时,FFVP组细胞上清液中IL-6含量显著低于FVP组;浓度为50 μg/mL时,FFVP组的吞噬能力显著高于FVP组,IL-18含量显著低于FVP组;浓度为100 μg/mL时,FFVP组的ROS、TNF-α含量,IL-18 mRNA相对表达量以及IκBα、Caspase-1和IL-1β的蛋白相对表达量显著低于FVP组。本课题组前期研究发现,相比FVP,FFVP呈板状,分子聚集作用增强,单糖组成比例改变,其中甘露糖比例显著升高;同浓度下FFVP的抗氧化活性高于FVP,且浓度越高差异越大[20]。一方面,发酵通过改变FVP的结构增强其抗炎活性。研究报道多糖的抗炎作用与多糖链构象和分子结构等都有关[40]。扫描电镜下FFVP呈板状,说明其分支较多,且聚集键很强[41]。原子力显微镜下FFVP的分子聚合度高于FVP,这是由于羟基的强烈相互作用而产生的[42]。另一方面,发酵通过改变FVP的单糖组成增强其抗炎活性。FFVP中甘露糖比例升高,甘露糖属于功能性糖,具有较高的抗炎活性。吴惠娟等[43]研究了甘露糖对RAW264.7炎症反应的调控及其机制,发现甘露糖可显著抑制LPS诱导的IL-1β、IL-12、TNF-α和IL-6的mRNA及蛋白表达,并抑制丝氨酸/苏氨酸蛋白激酶(AKT)、p65和细胞外信号调节激酶(ERK)磷酸化水平的增加,甘露糖单独处理可抑制AKT、信号转导和转录激活因子3(STAT3)和p65的磷酸化。因此,本研究中FFVP抗炎效果优于FVP的可能原因包括FFVP中多糖链间的强交互作用、多糖分子的高度聚集以及甘露糖比例的升高。
4 结 论
FVP/FFVP能增强RAW264.7的细胞活力和吞噬能力,降低ROS和NO含量,抑制炎症因子IL-1β、IL-6、IL-18和TNF-α的分泌与基因表达;相同浓度下,FFVP的抗炎效果优于FVP,其可能的机制为通过抑制NF-κB-NLRP3信号通路的激活降低NLRP3炎症小体的活化。
