黄菖蒲-枯草芽孢杆菌净化体系根际细菌多样性分析
2022-03-10崔文文刘梦仪陈海霞王雪莲崔金腾
崔文文,刘梦仪,陈海霞,王雪莲,朱 华,张 蓉,崔金腾*
(1.北京农学院园林学院,北京102206;2.北京市农林科学院水产科学研究所,北京100068)
河流污染是目前中国面临最常见的环境问题之一,河道底泥富集大量的有害物质,会导致水质急剧恶化,鱼类及其他生物大量死亡。传统的水污染治理方法主要有控制外源性和内源性营养物质[1]等,但是这些方法耗资大,且无法针对不同水体的整体特性进行综合治理,而以水生植物、细菌为主的生物治理方法能有效降低污染程度,适用范围广,经济成本低,不会对水体造成二次污染。特别是以植物与细菌为基础的联合修复技术不但可以降低污染水体中的污染负荷,而且能够有效降低河道底泥的污染,在应用过程中还可以获得一定的经济效益,因此,水生植物-细菌联合修复技术被应用于越来越多的水体治理项目中[2],成为治理富营养水体最有发展前景的技术。魏瑞霞等[3]在唐山市南湖公园用植物浮床-细菌修复富营养化水体,基本解决南湖公园水体的污染问题;邹万生等[4]利用苦草、菹草和细菌以及水芹菜、水葱和细菌净化珍珠蚌养殖废水取得较好的净化效果。研究表明,水生植物根系分泌物及环境因素会直接影响根际细菌群落结构,根际细菌群落结构又会影响细菌的功能[5],进而影响到对污染水体的净化效果。同时,植物通过根系吸收、降解有害物质,但植物与细菌种类不同其净化效果差异很大,因此,研究不同植物-细菌体系对水体的净化功能具有重要意义。
该研究将黄菖蒲种植在用河道底泥配置的水体中,添加枯草芽孢杆菌处理,构建黄菖蒲-枯草芽孢杆菌净化体系,利用16S rDNA测序技术分析该净化体系根部细菌的多样性变化,以探究黄菖蒲-枯草芽孢杆菌净化体系在河道底泥的净化效果,为水生植物-细菌联合修复水体提供技术支持。
1 材料与方法
1.1 试验材料
2019年8月20日从沙河上游河道挖取河道底泥。选择生长健壮、无病虫害、生长期一致的黄菖蒲(Irispseudacorus)72株。从中国普通细菌菌种保存管理中心购置枯草芽孢杆菌(BacillussubtilisBE_91)菌株。
1.2 试验方法
1.2.1 制备枯草芽孢杆菌菌液 采用LB液体培养基培养枯草芽孢杆菌,恒温培养摇床设定200 r/min、37 ℃,12 h取出菌液。在560 nm的波长下,测定枯草芽孢杆菌菌悬液的吸光度,定容菌悬液OD560 nm=0.8,放入冰箱备用。
1.2.2 试验材料的样本分组与处理 将采集的河道底泥分成7份,每份5 L。其中1份作为对照组;3份置于花盆中,分别加入1 000 mL去离子水搅拌均匀并标记水位,作为黄菖蒲组;3份置于花盆中,分别加入2 00 mL枯草芽孢杆菌菌液和800 mL去离子无菌水搅拌均匀并标记水位,作为黄菖蒲+枯草芽孢杆菌组。每组处理均为3次重复。
2019年9月9日栽种黄菖蒲,对照组、黄菖蒲组和黄菖蒲+枯草芽孢杆菌组每盆种植8株黄菖蒲,置于25 ℃日光温室中培养,根据水分蒸发情况,用去离子无菌水补充蒸发损失至标记水位。生长到第42天,采集黄菖蒲组和黄菖蒲+枯草芽孢杆菌组的黄菖蒲根部底泥,各处理组3次重复,均取根部底泥50 mL置于无菌PC管中,-20 ℃保存、备用。将试验分为第0天对照组(DAY0)、第42天黄菖蒲组(DAY42CK)和第42天黄菖蒲+枯草芽孢杆菌组(DAY42BS)。
1.3 根部细菌DNA提取和测序
使用天根生化科技(北京)有限公司生产的土壤基因组DNA提取试剂盒(DP336),提取第0天对照组、第42天黄菖蒲组和第42天黄菖蒲+枯草芽孢杆菌组根部底泥的DNA,并纯化总DNA,经1%琼脂糖凝胶电泳测定DNA完整性,提取的DNA于-20 ℃保存、备用。
将检测合格的DNA利用16SrDNA V4区段引物进行PCR扩增,引物为515F/806R(515F是5′-CAGCMGCCGCGGTAA-3′;806R是5′-GACTACHVGGGTWTCTAAT-3′)[6]。DNA扩增条件为95 ℃预变性1 min,95 ℃变性10 s,50 ℃退火30 s,72 ℃延伸60 s,30个循环,72 ℃延伸5 min。建库和测序委托北京诺禾致源生物信息科技有限公司完成,采用HiSeq测序平台进行高通量双端测序。
1.4 生物信息学分析
使用合并配对端(V1.2.7, http://ccb.jhu.edu/software/FLASH/)[7]对每个样本的测序进行拼接,得到的拼接序列为原始序列数据,参照Qiime(V1.9.1,http://qiime.org/scripts/split_libraries_fastq.html)[8]的序列质量控制流程处理得到高质量的序列数据(Clean Tags)[9]。再将序列通过矢量化搜索(https://github.com/torognes/vsearch/)与物种注释数据库进行比对检测嵌合体序列,并最终去除其中的嵌合体序列,得到最终的有效数据(Effective Tags)[10]。利用代表性序列鉴定算法(Uparse Tags)软件(Uparse v7.0.1001,http://www.drive5.com/uparse/)对所有样本的全部有效序列进行聚类,以97%的一致性(Identity)将序列聚类成为可操作的分类单元,采用Mothur方法与SILVA132(http://www.arb-silva.de/)[11]的SSUrRNA数据库[12]进行物种注释。
1.5 数据统计和分析
使用Qiime软件(Version 1.9.1)计算物种种类指数,菌群多样性指数,样本多样性指数;样本多样性指数组间差异分析采用威尔科克森秩和检验方法分析,使用R软件(Version 2.15.3)绘制稀释曲线。无度量多维标定法统计组间细菌群落结构差异,用Qiime软件(Version 1.9.1)计算Unifrac距离(多样本的群落比较方法)、构建非加权组平均法样本聚类树。利用显著性差异分析的方法对组间的物种丰度数据进行假设检验,应用线性判别分析处理组间差异性物种。应用Tax4Fun,以SILVA数据库序列为参考序列聚类出聚类和物种分类,进而获取功能注释信息。
2 结果与分析
2.1 黄菖蒲根部底泥细菌测序数据分析
将测序原始下机数据进行拼接和质控,过滤低质量和短长度序列后得到清晰序列,其中第0天对照组、第42天黄菖蒲组和第42天黄菖蒲+枯草芽孢杆菌组样本的清晰序列数分别为193 250条、186 947条和178 127条。进行嵌合体过滤,得到可用于后续分析的有效序列,然后对所有样本的有效数据以97%的一致性进行聚类分析,分别得到4 668个序列、4 250个序列和4 953个序列(表1)。
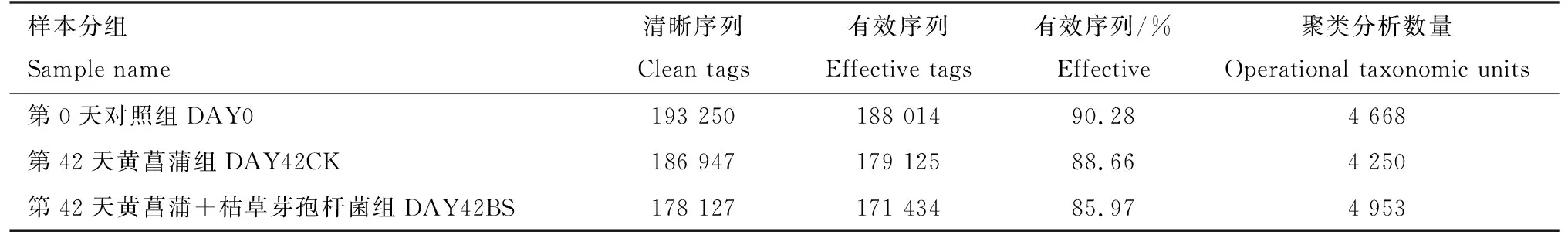
表1 黄菖蒲根部底泥细菌16SrDNA测序数据Tab.1 16S rDNA sequencing data of bacteria in rhizosphere sediment of Iris pseudacorus
2.2 黄菖蒲根部底泥细菌多样性分析
2.2.1 黄菖蒲根部底泥细菌多样性指数 黄菖蒲根部底泥细菌多样性指数见表2与图1。3个处理组样本间的物种数目在2 924~3 150之间,相差不大,说明检测到的聚类数量无显著差异。将黄菖蒲根部底泥细菌多样性绘制为韦恩图。3个处理组样本间的共有细菌2 919种。除去共有细菌外,第0天对照组细菌1 749种;第42天黄菖蒲组细菌1 331种;第42天黄菖蒲+枯草芽孢杆菌组细菌2 034种。第42天黄菖蒲+枯草芽孢杆菌组细菌多样性的值高,进而说明黄菖蒲-枯草芽孢杆菌净化体系有效改变底泥群落多样性状况。在菌群多样性中,第0天对照组、第42天黄菖蒲组的指数相差不大,说明黄菖蒲培养42 d后,没有改变底泥中的细菌多样性。在菌群丰度指数中,第42天黄菖蒲+枯草芽孢杆菌组明显高于第0天对照组、第42天黄菖蒲组,说明黄菖蒲-枯草芽孢杆菌净化体系有效改变底泥群落多样性状况。
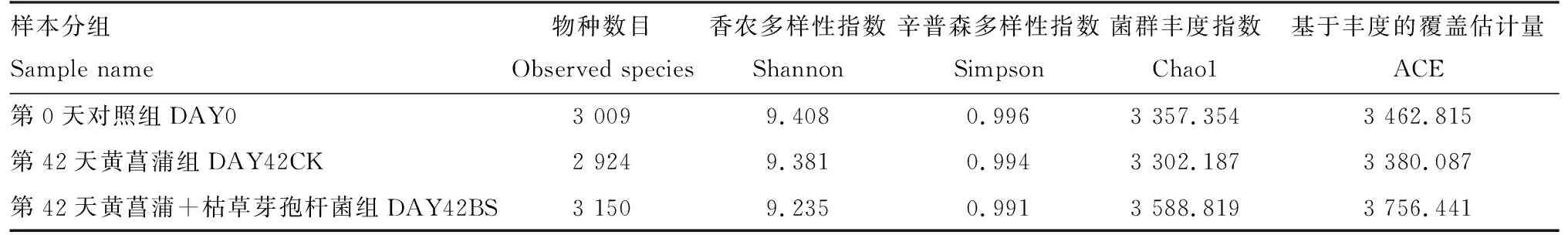
表2 黄菖蒲根部底泥细菌α多样性指数Tab.2 Bacterial α diversity index in rhizosphere sediment of Iris pseudacorus
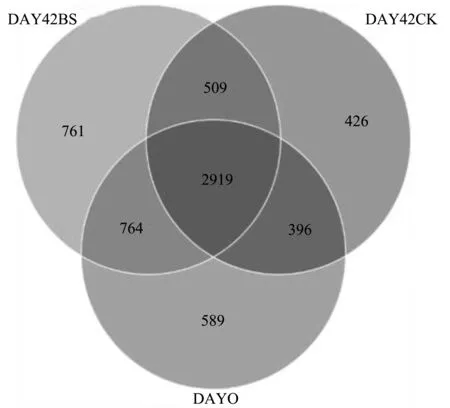
图1 黄菖蒲根部底泥细菌多样性Venn图Fig.1 Venn diagram of bacterial diversity inrhizosphere sediment of Iris pseudacorus
2.2.2 黄菖蒲根部底泥细菌在门分类水平上的分布 根据物种注释结果,选取每个分组在门水平上较大丰度的前10名,生成物种相对丰度柱状累加图,如表3所示。第0天对照组、第42天黄菖蒲组和第42天黄菖蒲+枯草芽孢杆菌组在门水平上都以变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi)为主,其中明显优势菌门为变形菌门(Proteobacteria)。
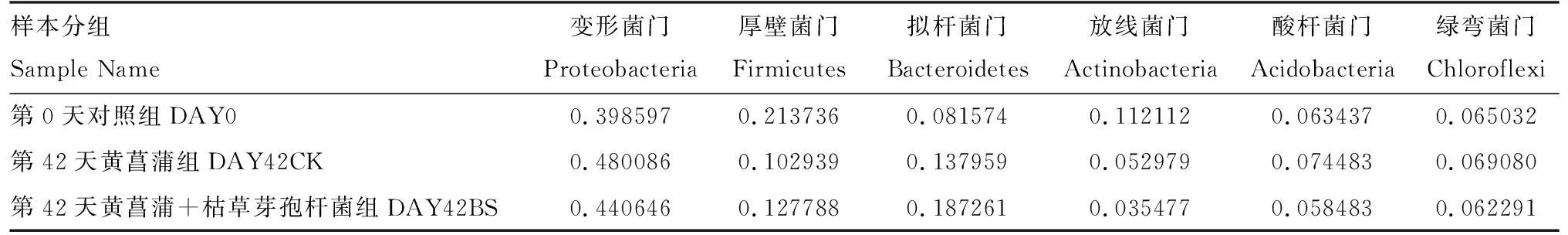
表3 门水平上黄菖蒲根部底泥细菌群落组成Tab.3 Bacterial community composition in rhizosphere sediment of Iris pseudacorus at the phylum level
2.2.3 黄菖蒲根部底泥细菌群落结构差异 第0天对照组、第42天黄菖蒲组和第42天黄菖蒲+枯草芽孢杆菌组组间细菌群落结构位置分布明显不同,经过42 d的培养黄菖蒲对底泥样本中的细菌群落结构产生影响(图2)。第42天黄菖蒲组和第42天黄菖蒲+枯草芽孢杆菌组的位置分布存在明显的差异,说明枯草芽孢杆菌同样对底泥样本的细菌群落结构产生影响,第42天黄菖蒲+枯草芽孢杆菌组中的枯草芽孢杆菌通过营养和空间两方面的竞争形成区域优势菌群,抑制有害细菌的生长繁殖,从而达到改变底泥样本中细菌群落结构的效果。

图2 黄菖蒲根部底泥细菌群落无度量多维标定法分析Fig.2 NMDS analysis of bacterial community in rhizosphere sediment of Iris pseudacorus
2.2.4 黄菖蒲根部底泥细菌组间差异线性判别分析 选取线性判别分析阈值大于4的物种分析作图,如图3所示。
第0天对照组和第42天黄菖蒲组差异比较发现(图3A),第0天对照组,厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、梭状芽胞杆菌纲(Clostridia)、梭状芽胞杆菌目(Clostridiales)和丙酸杆菌目(Propionibacteriales)的相对丰度具有显著差异。第42天黄菖蒲组,拟杆菌门(Bacteroidetes)、γ-变形菌纲(Gammaproteobacteria)、鞘脂杆菌目(Sphingobacteriales)和噬氢菌界(Hydrogenophilaceae)的相对丰度具有显著差异。
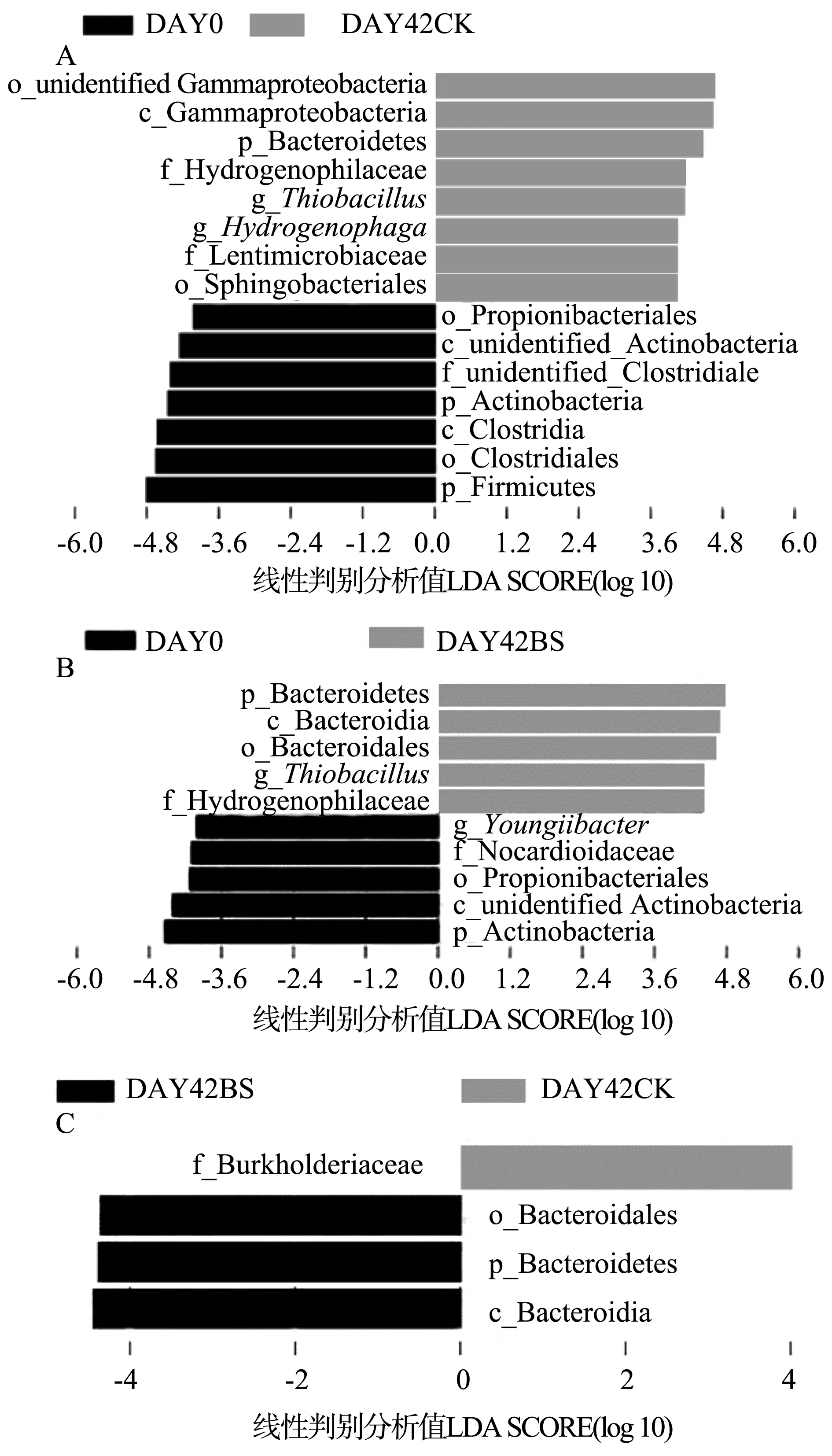
图3 黄菖蒲根部底泥细菌群落线性判别分析值分布Fig.3 LDA value distribution of bacterial community in rhizosphere sediment of Iris pseudacorus
第0天对照组和第42天黄菖蒲+枯草芽孢杆菌组差异比较发现(图3B),第0天对照组,放线菌门(Actinobacteria)、丙酸杆菌目(Propionibacteriales)和诺卡氏菌科(Nocardioidaceae)的相对丰度具有显著差异。第42天黄菖蒲+枯草芽孢杆菌组中,拟杆菌门(Bacteroidetes)、拟杆菌纲(Bacteroidia)、拟杆菌目(Bacteroidales)、噬氢菌科(Hydrogenophilaceae) 的相对丰度具有显著差异。
第42天黄菖蒲组和第42天黄菖蒲+枯草芽孢杆菌组差异比较发现(图3C),在第42天黄菖蒲组中,伯克氏菌科(Burkholderiaceae)的相对丰度具有显著差异;在第42天黄菖蒲+枯草芽孢杆菌组中,拟杆菌门(Bacteroidetes)、拟杆菌纲(Bacteroidia)和拟杆菌目(Bacteroidales)的相对丰度具有显著差异。
2.2.5 黄菖蒲根部底泥细菌功能相对丰度聚类分析 黄菖蒲根部底泥细菌功能相对丰度聚类分析见图4。根据各个样本中细菌功能聚类分析的热度值,第0天对照组底泥中的细菌优势功能具有发酵作用和化能异养的作用;第42天黄菖蒲组中黄菖蒲根部底泥细菌优势功能具有硫酸盐呼吸作用和硫化物呼吸作用;第42天黄菖蒲+枯草芽孢杆菌组中黄菖蒲根部底泥细菌优势功能具有硝酸盐还原、铵硫化物氧化、吸收氮元素和通过呼吸作用代谢硝酸盐。各个时期的优势菌均有差异,其中黄菖蒲+枯草芽孢杆菌组42 d的优势菌有较强的代谢底泥中硝酸盐和吸收氮元素的能力,含氮元素的盐类物质中,尤其是NH4+对水中动物的毒害能力很强,第42天黄菖蒲+枯草芽孢杆菌组菌群对NH4+的处理能力明显强于未处理过的第0天对照组。

图4 黄菖蒲根部底泥细菌功能注释聚类热图Fig.4 Functional annotation cluster heat map of bacteria in rhizosphere sediment of Iris pseudacorus
3 讨 论
黄菖蒲[13]是鸢尾科多年生挺水植物,在中国各地均有栽培,喜生于河湖沿岸的湿地或沼泽地,近年常用于园林绿化。黄菖蒲生物量大、适应性强,根系发达,有较强的输氧能力,可以产生好氧环境。水生植物对环境的修复作用主要有植物的吸收、吸附、富集作用和根际细菌的降解作用,其中根际细菌在修复过程中发挥更为重要的作用。细菌[14]通过降解有机物和代谢作用将富营养水体中的一些复杂有机物转化为简单无机物,并从污染物中获取新陈代谢的能量[15]。研究表明,植物的种植会对原生细菌有一定促进作用,植物会使优势菌种相对丰度发生改变,同时提高原生细菌的丰度与多样性[16]。
该研究基于诺禾致源HiSeq测序平台对黄菖蒲-枯草芽孢杆菌净化体系根部细菌多样性进行分析,16S rDNA测序结果表明,黄菖蒲-枯草芽孢杆菌净化体系根部细菌群落多样性和丰富度较高,共检测到52个优势菌门,各处理组的优势菌门差别较大,表明黄菖蒲和黄菖蒲-枯草芽孢杆菌[17]净化体系在不同程度上改变根部底泥的细菌多样性组成。Alpha多样性指数差异性检验分析表明,黄菖蒲没有对底泥中细菌聚类数量、群落丰富度和多样性造成显著的影响,但是黄菖蒲-枯草芽孢杆菌净化体系有效改变底泥细菌群落多样性状况。该试验在黄菖蒲-枯草芽孢杆菌净化体系根部细菌的群落结构方面,经过42 d的处理,第42天黄菖蒲+枯草芽孢杆菌组和第42天黄菖蒲组都使底泥中细菌群落结构出现差异,且第42天黄菖蒲+枯草芽孢杆菌组差异较第42天黄菖蒲组更加明显。
枯草芽孢杆菌具有净化水体的功能[18],能够产生多种抗菌素和酶,抑制有害细菌生长繁殖,并促进河流污染物的降解。黄菖蒲-枯草芽孢杆菌净化体系中,根部底泥大量富集能还原硝酸盐、氧化铵硫化物、吸收氮元素和代谢硝酸盐的细菌类群,其优势菌具有硝酸盐还原、铵硫化物氧化、吸收氮元素和通过呼吸作用代谢硝酸盐的功能,含氮元素的盐类物质中,尤其是NH4+对水中动物的毒害能力很强,黄菖蒲+枯草芽孢杆菌组菌群对NH4+的处理能力明显强于未处理过的第0天对照组,并且黄菖蒲-枯草芽孢杆菌联合修复底泥污染能取得比仅用黄菖蒲更好的净化效果。黄菖蒲-枯草芽孢杆菌净化体系对降低河道底泥和污水中铵类物质有较强的潜在能力,对恢复河流物种多样性有较好的应用前景。
