升结肠原发未分化多形性肉瘤1例报告
2022-03-10山东大学齐鲁医院普通外科程志强王延磊
山东大学齐鲁医院普通外科 陈 畅,程志强,张 翔,王延磊,戴 勇
山东第一医科大学第一附属医院普通外科中心 胡三元
未分化多形性肉瘤(undifferentiated pleiomorphic sarcoma,UPS)既往被称为恶性纤维组织细胞瘤(malignant fibrous histiocytoma,MFH),是常见的软组织肉瘤,多发生于四肢[1],预后较差,2 年生存率与5 年生存率仅为60%与47%[2],原发于结肠的UPS 罕见。截至2016 年7 月,国内仅有来自北京协和医院的3例报道;世界范围内报道的结肠原发UPS 总计不超过30例。结肠原发的UPS 预后更差,其2 年生存率不足50%[3]。结肠原发的UPS 缺乏特异性临床表现及病理学特征,大多数诊断是在手术切除后通过充分取材及各种辅助检查作出的排除性诊断[3]。早期、完整的手术切除是结肠原发UPS 的主要治疗手段,术后辅助治疗方案及疗效目前仍不明确。本文报道1例合并淋巴瘤既往史的升结肠原发UPS 病例,以期为结肠原发UPS 的诊疗提供临床参考。患者男,66 岁,BMI 27 kg/m2,因“弥漫大B 细胞淋巴瘤化疗8 周期后4 年余,频繁发热1 月余”入院。患者4 年前无明显诱因出现舌根部疼痛,于我院确诊为弥漫大B 淋巴瘤,规律性化疗8 个周期(R-CHOP 方案),耐受良好,后规律复查,未见明显异常。化疗6 个周期后,PET-CT 检查示:与治疗前相比,患者原有左侧扁桃体及邻近左侧口咽部病灶、多区域淋巴结病灶消失;原有肾间隙内可疑淋巴结病灶大小较前变化不明显、氟代脱氧葡萄糖(fludeoxyglucose,FDG)代谢活性明显减低,提示治疗有效。患者1 个月前无明显诱因出现每日发热,最高达39℃,无其他自觉症状,自行口服非甾体类退热药物,体温可下降至正常。于当地医院进行强化CT 检查示腹腔软组织密度灶。为明确诊断,于我院行PET-CT,结果示:升结肠肠壁增厚并不均质性摄取FDG,标准摄取值最大为9.0。病灶周边脂肪间隙模糊,内见多发不同程度摄取FDG 的结节状及团片状软组织密度影,大者约3.6 cm×1.8 cm,标准摄取值最大为2.8,见图1;另于右肾后间隙见多发轻度摄取FDG 的团片状软组织密度影,升结肠病灶及周边软组织灶为活动性淋巴瘤病灶可能性大,右肾后间隙软组织灶活动性淋巴瘤不能排除。患者入住我科后查体发现右上腹部可触及质硬肿块,约6 cm×5 cm 大,活动度差,无压痛、反跳痛及肌紧张等。全身无浅表淋巴结肿大。患者每日发热,通过口服退热药物缓解。实验室检查示白细胞9.69×109/L,血红蛋白4.18×1012/L,谷丙转氨酶56 U/L,谷草转氨酶38 U/L,γ-谷氨酰转肽酶129 U/L,碱性磷酸酶195 U/L,总胆红素39 μmol/L,直接胆红素29.9 μmol/L,白蛋白28.6 g/L,肿瘤标志物未见明显升高,大便潜血阳性。骨髓细胞学检查未见明显异常,结肠镜检查示升结肠巨大息肉,约5 cm×5 cm 大,病理结果示病灶肌纤维母细胞增生,伴有异型增生,组织坏死明显,符合增生的肉芽组织(图2)。患者诊断不明确,经多学科联合会诊讨论后考虑为淋巴瘤化疗后复发可能性大,暂无手术指征。为取得进一步治疗依据,我们再次对升结肠的病灶及右肾间隙的病灶做了活检,升结肠活检示升结肠坏死组织及少量黏膜组织慢性炎,肾周间隙组织示疏松纤维结缔组织伴慢性炎较多成熟浆细胞浸润。再次多学科联合会诊讨论,患者多次活检未明确诊断,血液科无治疗依据,每日发热,症状明显,且为避免肿瘤进展可能出现的肠梗阻,并获取整块组织病理,以指导后续治疗,遂行腹腔镜辅助右半结肠切除术(图3)。术后病理示结肠内查见一隆起型肿物,肿物表面积7.3 cm×5.2 cm,肿物表面灰黄附脓苔,高起肠黏膜6 cm,切开切面灰黄质软韧,切面积14.5 cm×5 cm,肉眼观似侵及肠管全层。切缘及吻合器切缘未查见肿瘤,肠周淋巴结32 枚,均未见转移(0/32),免疫组化CDK4(+),Bcl-2(+),CD34(血管+),Dog-1(-),CD117(-),S-100(-),SMA(-),Desmin(-),Myogenin(-),MyoD1(-),LCA(-),Ki-67 阳性率30%,结合各项检查,病灶考虑UPS(图4)。术后第1 天患者体温即恢复正常,未再出现发热,术后第6 天复查血常规,白细胞3.77×109/L,第7 天顺利出院。术后随访9 个月,无明显复发征象,腹膜后肿物未出现明显变化。

图1 复查PET-CT,可见升结肠不均匀摄取FDG
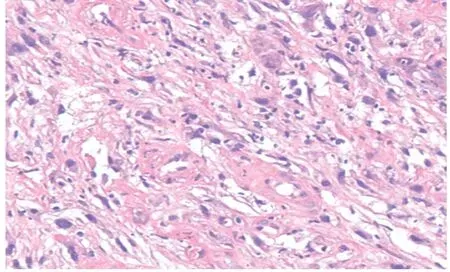
图2 入院肠镜病理(HE×100)示肌纤维母细胞增生,有炎性细胞浸润

图3 术中所见升结肠“肿物”及术后大体标本
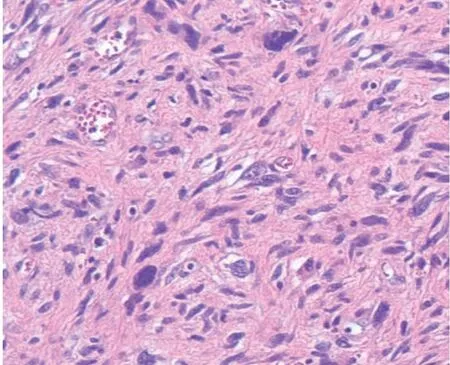
图4 术后结合免疫组化考虑UPS(HE×100)
讨论 本例患者为罕见的原发于升结肠的UPS,患者以“反复发热”为首诊症状,入院查体发现腹部肿块,肠镜检查排除上皮来源癌肿的可能。考虑患者既往淋巴瘤病史,因此怀疑淋巴瘤结外复发可能性大。然而术前经过多次病理活检仍未明确诊断,血液科无治疗依据。结合多次多学科联合会诊讨论意见,患者最终接受手术治疗后得到确诊。术后患者发热症状迅速缓解,表明发热与肿瘤直接相关,提示治疗有效。
MFH 由Ozzello 等于1963 年首次提出[4],于1964 年被OˊBrien、Stont 完善,1978 年被分为4 种亚型:黏液样、梭形细胞型、巨细胞型及炎症型。2002 年世界卫生组织将其重新分组为多形性、巨细胞、炎症型MFH/UPS;2013 年彻底删除MFH 的说法,UPS 归类于未分化软组织肉瘤。炎症型UPS 以高复发率、高转移率及高病死率为临床特点,可产生大量与其细胞来源相关的细胞因子,刺激骨髓细胞增殖,出现白细胞增多或类白血病反应及相关的临床症状,当原发肿瘤切除后白细胞计数可恢复正常[5]。本例患者出现了相似表现,首发症状为顽固发热,白细胞水平于术前升高、切除肿物后出现迅速的回落,病理活检中可见较多的炎性细胞浸润。Kazama 曾报道过1例炎性UPS 病例,发现术前顽固性发热的患者,血清粒细胞集落刺激因子、IL-6升高,全身骨骼多发地摄取FDG,而手术切除肿瘤后快速恢复正常[6]。
UPS 的诊断是其治疗的首要难题。UPS 患者通常有腹痛(38.5%)、腹部肿块(30.8%)或发热(23.1%)[3],这些症状可同时出现,也可单独出现,但无诊断特异性。鉴于本例患者弥漫大B 细胞淋巴瘤的病史,我们首先考虑淋巴瘤复发,但与后面多次的病理结果及相关辅助检查并不符合。腹腔镜辅助右半结肠切除术后,经充分取材结合其他辅助检查,最终诊断为炎症型UPS。目前的诊断主要是手术切除后经各项辅助检查所做出的一种排除性诊断。其辅助检查缺乏特异性,肿瘤标记物通常无明显异常,唯有伴明显炎症的亚型可能会有白细胞升高或类白血病反应[5]。影像学方面虽然有学者提出PET-CT[6]及磁共振成像[7]在辅助诊断或评估术后复发方面或许会有帮助,但明确诊断需依靠病理活检结合免疫组化。在组织学上,原发于结肠的UPS 可能源于肠系膜的间充质干细胞[8],瘤细胞最常见的形式由席纹状区域、多形性区域混合而成,多形性区域出现大量富于染色质、核不规则的多核巨细胞可视为一个特征性的表现。巨细胞成强嗜酸性,常提示肌母细胞分化[9],此现象可能提示预后差[10]。此外,由于肿瘤较大,通常会有出血区域与坏死组织。虽然典型的UPS 中波形蛋白、α-抗胰蛋白酶、α-抗糜蛋白酶、CD68、Ⅷa 因子、铁蛋白、Ⅷa 因子胞质原酶常呈阳性反应[11],但具有特异性的仅有波形蛋白。患者术前出现轻度的白细胞升高,PCT-CT 出现病灶及全身多处骨骼、骨髓的FDG 摄取,病理活检提示肌纤维母细胞伴慢性炎症,从某种程度反映了肿瘤的性质,遗憾的是未进行波形蛋白及粒细胞集落刺激因子检测,以进行佐证。
UPS 具有明显的侵袭性,目前认为治疗的核心是早期完整地切除肿瘤,获取阴性切缘,以减少肿瘤复发的几率。尽管如此,术后UPS 仍具有较高的复发风险[12]。此外,由于淋巴转移的风险低,并不建议术中常规清扫淋巴结。原发于结肠的UPS预后较其他部位的UPS 更差,可能因发现时瘤体多已较大[3],且术后放疗或化疗的效果尚不明确。其预后与肿瘤部位深浅、肿瘤大小、分化程度及治疗是否彻底等因素密切相关[11]。对于伴明显炎症的UPS,类白血病反应越严重,预后越差[13]。
虽然原发于结肠的UPS 罕见,但对于难以明确诊断的结肠肿物,且具有腹痛、发热等症状时,应考虑UPS 的可能。早期、完整地手术切除仍是其主要治疗手段。一些细胞因子如粒细胞集落刺激因子的升高可能作为炎症型UPS 肿瘤复发的提示。
致谢:感谢山东大学齐鲁医院转移性结直肠肿瘤多学科联合会诊团队在该病例诊治过程中提供的帮助。
