免疫富集联合MALDI-TOF MS检测奶粉中阪崎克罗诺杆菌的方法建立
2022-03-09赵良娟张俊哲朱韶英赵玉玲谭有兰赵化冰刘国红董志珍
赵 宏,杨 柳 ,赵良娟,庞 璐,张俊哲,朱韶英,赵玉玲,谭有兰,赵化冰,刘 培,刘国红,吴 岚,董志珍,4,
(1.天津海关动植物与食品检测中心,天津 300461;2.天津科技大学生物工程学院,天津 300457;3.中华人民共和国呼和浩特海关,内蒙古呼和浩特 010090;4.天津市口岸非传统安全风险防控科学与技术重点实验室,天津 300461)
阪崎克罗诺杆菌(Cronobacter sakazakii,CS)是一种可寄生于人和动物肠道内的食源性条件致病菌[1−2],具有易存活、耐高温(54~62 ℃)、耐酸(pH<3.9)、耐干燥及繁殖能力强等特点,在低温、干燥等恶劣环境中极微量的污染就可能进行大量繁殖,是引起新生儿食源性疾病的致病菌之一[1−4]。研究发现,婴幼儿配方乳粉是新生儿感染阪崎克罗诺杆菌的主要途径,据研究报道显示,食用被阪崎克罗诺杆菌污染的奶粉会导致新生儿脑膜炎、小肠结肠炎、败血症等疾病,治愈后仍可能引起神经系统后遗症,流行病学研究显示,其病死率约为50%~80%[2,5−7]。
1961年英国首次报道出现由阪崎克罗诺杆菌污染引起的新生儿脑膜炎病例[8],随后越来越多的病例被报道。2002年,阪崎克罗诺杆菌被国际食品微生物标准委员会列为“严重危害特定人群生命,引起长期慢性实质性后遗症”的一种致病菌[9]。2005年我国国家质检总局颁布了奶粉中检测阪崎克罗诺杆菌的行业标准SN/T1632.1,随后又颁布了婴幼儿配方乳粉中阪崎克罗诺杆菌每批必检的市场准入要求[9−10]。
尽管目前已建立了多种准确灵敏、特异性好的阪崎克罗诺杆菌检测方法,但这些方法仍然存在不足,传统的国家标准检测方法[11]检测周期长,至少需要6 d才能鉴定出结果;分子生物学检测方法[3,12]易受试剂及环境污染,存在漏检及假阳性问题;单一免疫学检测方法因检出限较高而受限制[13];全基因组测序方法[14]样品前处理要求高且复杂,结果分析对于检测人员的相关背景要求较高,因此,本研究将具有较好的特异性、准确性及灵敏性的免疫(immunomagnetic beads, IMB)富集技术[15−16]与灵敏度高、分析速度快、样品制备简单的新型软电离质谱技术-基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time of flight mass spectrometry, MALDI-TOF MS)[17−18]相结合用于检测婴幼儿配方乳粉中的阪崎克罗诺杆菌,以克服以上检测技术存在的检测周期长、特异性不高等问题。
1 材料与方法
1.1 材料与仪器
阪崎克罗诺杆菌标准菌株(Cronobacter sakazakiiATCC 12868、ATCC 29004、ATCC 29544)、金黄色葡萄球菌(Staphylococcus aureusATCC 27660)、鼠伤寒沙门氏菌标准菌株(Salmonella typhimurium,S.TATCC 14028);单核增生李斯特氏菌(Listeria monocytogenes)、大肠杆菌(Escherichia coli)、本实验室分离的未知阪崎克罗诺杆菌(盲样分离株) 本实验室储藏;兔抗阪崎克罗诺杆菌多克隆抗体 北京博奥森生物技术有限公司;溶菌肉汤培养基(lysogeny broth, LB) 实验室自行配制;阪崎克罗诺杆菌显色培养基 上海欣中生物工程有限公司;N-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(N-(3-dimethylaminopropyl)-N'-ethylcarbodiimide hydrochloride, EDC)、羟基丁二酰亚胺(N-hydroxysuccinimide, NHS)、2-吗啉乙磺酸(2-(N-morpholino)ethanesulfonic acid,MES) 分析纯,美国Sigma-Aldrich公司;饱和基质CHCA(α-氰基-4-羟基肉桂酸) 上海阿拉丁生化科技股份有限公司; PM3-020聚合物羧基磁珠(180 nm)磁珠 上海奥润微纳新材料科技有限公司;婴幼儿配方奶粉(12~36月龄) 天津海关动植物与食品安全检测中心抽检样。
ZHJH-C1214B垂直流洁净工作台、LHR-150生化培养箱、HZQX-500C恒温振荡培养器 浙江赛德仪器设备有限公司;AXIMA confidence MALDITOF MS质谱仪 日本岛津公司;MS-12多功能磁分离架 上海奥润微纳新材料科技有限公司;BE-1100四维旋转混匀仪 北京海天友诚科技有限公司。
1.2 实验方法
1.2.1 抗体制备 委托北京博奥森生物技术有限公司对4株阪崎克罗诺杆菌分离株(ATCC 29004、ATCC 12868、ATCC 29544、盲样分离株)进行抗体制备。
1.2.2 免疫磁珠的制备 根据上海奥润微纳新材料科技有限公司AllMag®PM3-020的使用说明书活化及制备阪崎克罗诺杆菌多克隆抗体免疫磁珠(CSIMB),该过程大约需要2~3 h。
1.2.3 菌悬液的制备 取适量低温贮藏的标准菌株接种于LB液体培养基中37 ℃、220 r/min恒温振荡培养活化。取1 mL菌液,4000 r/min离心 10 min,弃掉上清液,用无菌生理盐水将菌液进行梯度稀释至实验浓度[19]。
1.2.4 阪崎克罗诺杆菌多克隆抗体特异性验证 将阪崎克罗诺杆菌分别与大肠杆菌、沙门氏菌、单核增生李斯特氏菌及金黄色葡萄球菌以细菌浓度比为1:1进行混合后在最佳反应条件(最佳反应条件已在前期研究进行优化[19])下反应后磁分离,去上清,将菌体-免疫磁珠复合物接种于LB液体培养基过夜培养后进行MALDI-TOF MS鉴定与分析。
1.2.5 阪崎克罗诺杆菌多克隆抗体-免疫磁珠(CSIMB)捕获率验证 将制备好的CS-IMB分别与4株纯培养的阪崎克罗诺杆菌及其混菌菌液(菌浓度约为1×103CFU/mL,4株纯培养的阪崎克罗诺杆菌的比例为1:1:1:1)在最佳反应条件下反应后磁分离,待磁珠充分被吸附后取100 μL上清液接种于LB固体培养基,37 ℃恒温过夜培养后进行菌落计数,每个样品做3个平行,计算免疫磁珠的捕获率,捕获率计算公式如下。
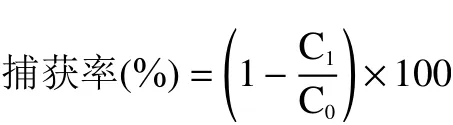
注:C0:原菌液菌落数,CFU/mL;C1:免疫磁珠捕获后的上清液菌落数,CFU/mL。
1.2.6 MALDI-TOF MS鉴定与数据采集分析
1.2.6.1 点样 将磁珠捕获后的菌体-免疫磁珠复合物经甲酸/乙醇提取法[20]处理后取1 μL上清液加至点样靶,每种处理方法得到的样品平行点4个孔,待样液滴晾干后,覆盖1 μL饱和基质CHCA,干燥后进行MALDI-TOF MS鉴定[21]。
1.2.6.2 MALDI-TOF MS数据采集与分析 采用MALDI-TOF MS对样品进行数据采集。分析采用线性模式;激光能量:60~90 Hz;收集质荷比范围(m/z):2000~20000;每个样品激光轰击100次;采集到的数据导入岛津SARAMIS数据库进行分析。每次试验前在采集数据的质量范围内使用大肠杆菌ATCC 8739标准品进行校准[22]。
1.2.7 实际样品检测
1.2.7.1 奶粉检测样制备 从天津海关动植物与食品安全检测中心抽检样中随机选取3种不同品牌婴儿配方乳粉,根据国标GB 4789.40-2016[11]进行检测样品处理。
1.2.7.2 奶粉检测样品中免疫磁珠捕获率验证 向处理好的奶粉样品中分别加入细菌浓度约为1×103CFU/mL的阪崎克罗诺杆菌菌液,在最佳反应条件下反应后磁分离,待磁珠充分被吸附后取100 μL上清液接种于LB固体培养基,37 ℃恒温过夜培养后进行菌落计数,每个样品做3个平行,计算免疫磁珠的捕获率。
1.2.7.3 奶粉检测样品中免疫磁珠特异性及检出限研究 将4株阪崎克罗诺杆菌混菌分别与杂菌(大肠杆菌、沙门氏菌及单核增生李斯特氏菌混菌液,其中三种菌液的混合比例为1:1:1)以1:1、1:10、1:100的比例混匀后加入3种不同奶粉处理液中,在最佳反应条件下反应后磁分离,弃上清,将菌体-免疫磁珠复合物接种于LB液体培养基过夜培养后进行MALDI-TOF MS鉴定并分析。需要指出的是,由于此前对抗体特异性进行研究时发现金葡对本研究的检测结果干扰较大,因此,该项研究并未将金葡作为干扰菌进行研究。
1.3 数据处理
每次实验至少重复3次,应用SPSS 19.0软件进行统计学分析, 多克隆抗体效价的比较采用双样本t检验,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 阪崎克罗诺杆菌抗体制备
高效价的抗体可以提高免疫检测的特异性和灵敏性[13],通过前期查阅分析发现,目前市场上相关的阪崎克罗诺杆菌抗体种类较少,抗体所覆盖的菌株难以满足本实验的要求,因此,本单位委托北京博奥森生物技术有限公司对4株阪崎克罗诺杆菌(ATCC 29004、ATCC 12868、ATCC 29544、盲样分离株)进行混菌抗体制备,实验动物经四次免疫后,采用酶联免疫吸附测定(ELISA)血清效价如表1所示,ATCC 29004、ATCC 12868、ATCC 29544以及盲样分离株的效价分别为1:128000、1:128000、1:512000和1:128000,表明免疫动物血清具有较高效价,满足后续实验要求。对每只动物各取5 mL血清,使用ProteinA免疫亲和层析进行抗体纯化,已有研究表明,ProteinA纯化方法亲和与洗脱过程温和,几乎不会对抗体效价产生影响[13]。因此,本研究使用的高效价抗体可有效提高免疫磁珠的特异性和灵敏性。
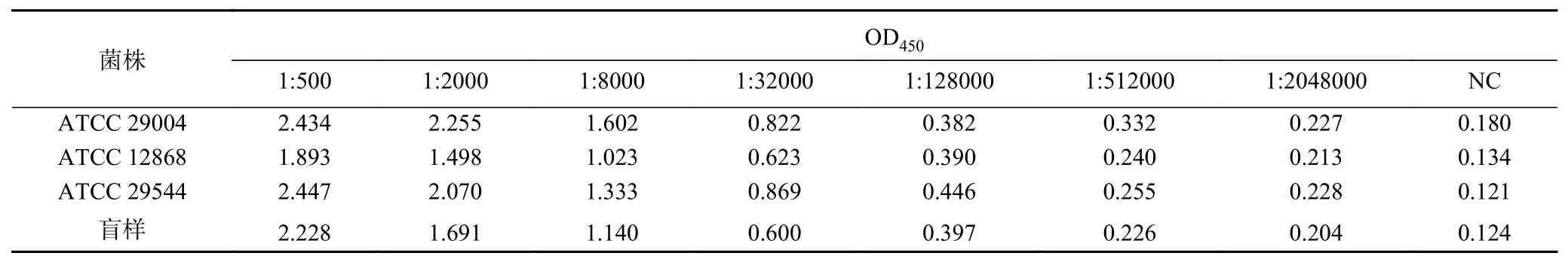
表1 阪崎克罗诺杆菌混菌抗体效价测定结果Table 1 Results of antibody titer determination of Enterobacter sakazakii
2.2 阪崎克罗诺杆菌抗体特异性验证
免疫富集技术以抗原抗体的特异性结合为基础,因而高质量的抗体对于免疫富集的特异性与准确性具有重要意义[23]。采用免疫富集结合MALDI-TOF MS的方法,在不同菌株的干扰条件下对抗体特异性进行验证,验证结果如图1所示,尽管不同样品的细菌指纹图谱峰值强度有所差别,但是,例如m/z约为5381、6256、9482、10288等特征峰的分布基本相同,即在不同菌株的干扰条件下,免疫磁珠富集后的检测样本可以经MALDI-TOF MS准确鉴定为阪崎克罗诺杆菌,说明免疫磁珠具有较好的特异性,根据MALDI-TOF MS对检测样品纯度要求高的特点,同时也间接表明抗体具有较好的特异性,有助于提高后续检测的特异性与准确性。但是,在鉴定过程中,出现少量的金黄色葡萄球菌鉴定结果,同时,空白对照,即未偶联抗体的磁珠捕获样本也出现了金黄色葡萄球菌鉴定结果,考虑可能是由于磁珠自身非特异吸附所造成的影响[24]。

图1 阪崎克罗诺杆菌混菌抗体特异性验证结果Fig.1 Results of antibody specificity verification of Enterobacter sakazakii
2.3 阪崎克罗诺杆菌-免疫磁珠(CS-IMB)捕获率研究
制备的免疫磁珠能否具有高捕获率效果对于检测方法的灵敏性具有重要的影响,因此,本研究对纯培养条件下CS-IMB对阪崎克罗诺杆菌的捕获率进行了研究,结果如图2所示,在纯培养条件下,免疫磁珠对于4株不同阪崎克罗诺杆菌及其混菌的捕获率均>85%,表明免疫磁珠具有较高的捕获率。
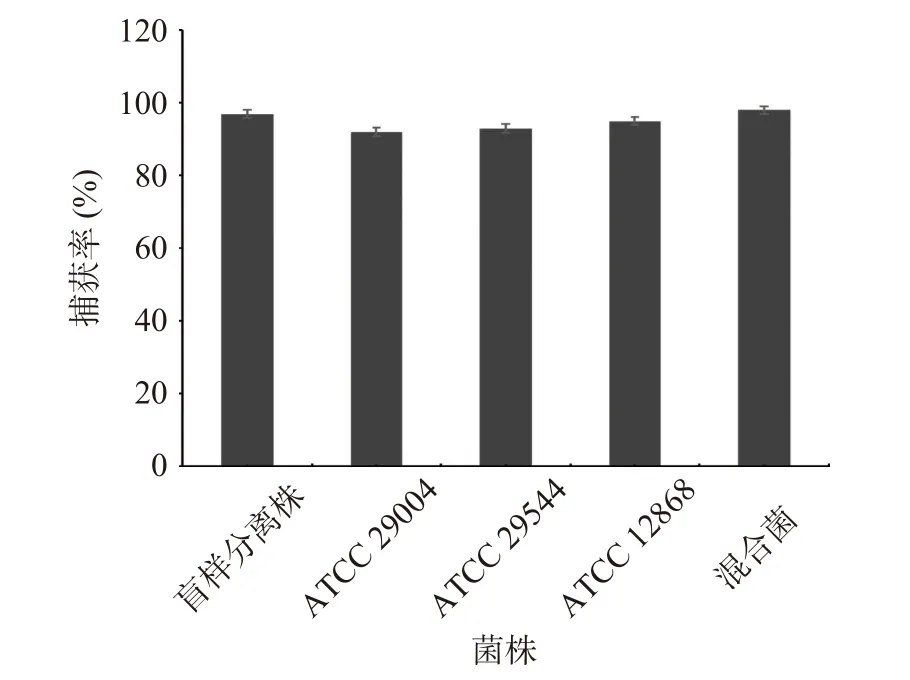
图2 纯培养条件免疫磁珠的捕获率Fig.2 Capture rate of immunomagnetic beads under pure culture condition
2.4 阪崎克罗诺杆菌-免疫磁珠(CS-IMB)在奶粉基质中的捕获率
能否在食品体系中高效捕获目的抗原菌,对于提高检测结果的灵敏性与准确性具有重要意义,因此,对3种不同奶粉基质中CS-IMB对阪崎克罗诺杆菌的捕获率进行研究并取均值。结果如图3A所示,奶粉基质中CS-IMB的捕获率菌>80%,且检测样本可以经MALDI-TOF MS质谱准确鉴定为阪崎克罗诺杆菌(图3B),尽管不同样品的细菌指纹图谱峰值强度有所差别,但是特征峰的分布基本相同,即CS-IMB对目的抗原菌的捕获率及MALDI-TOF MS鉴定结果几乎不受奶粉基质的影响。

图3 奶粉基质中免疫磁珠的捕获率及MALDI-TOF MS鉴定结果Fig.3 Capture rate of immunomagnetic beads in milk powder matrix and identification result of MALDI-TOF MS
2.5 不同奶粉样品中免疫磁珠的特异性及检出限
实际检测工作中,检测样品除污染目的菌外,也可能污染其他病原菌,且污染比例有所不同,然而,目前尚未检索到相关研究人员对高比例杂菌污染条件下免疫磁珠富集的特异性进行相关研究。因此,本研究针对3种不同奶粉样品在不同比例杂菌(沙门氏菌、大肠杆菌、单核增生李斯特氏菌混菌)条件下进行实验,研究免疫富集联合MALDI-TOF MS检测阪崎克罗诺杆菌的方法在实际样品中的检测特异性与检出限。结果如图4所示,即使在高比例(阪崎克罗诺杆菌:杂菌=1:100)杂菌污染条件下,尽管不同样品的细菌指纹图谱峰值强度有所差别,但是特征峰的分布基本相同,且指纹图谱数据与数据库比对相符率均>75%,即检测样品经MALDI-TOF MS准确鉴定为阪崎克罗诺杆菌。同时,检测样本中的阪崎克罗诺杆菌通过平板计数,结果显示细菌浓度仅为20 CFU/mL,说明此时检测样本活菌浓度约为20 CFU/mL,此外,由于平板计数的局限性,该数值也存在一定误差。
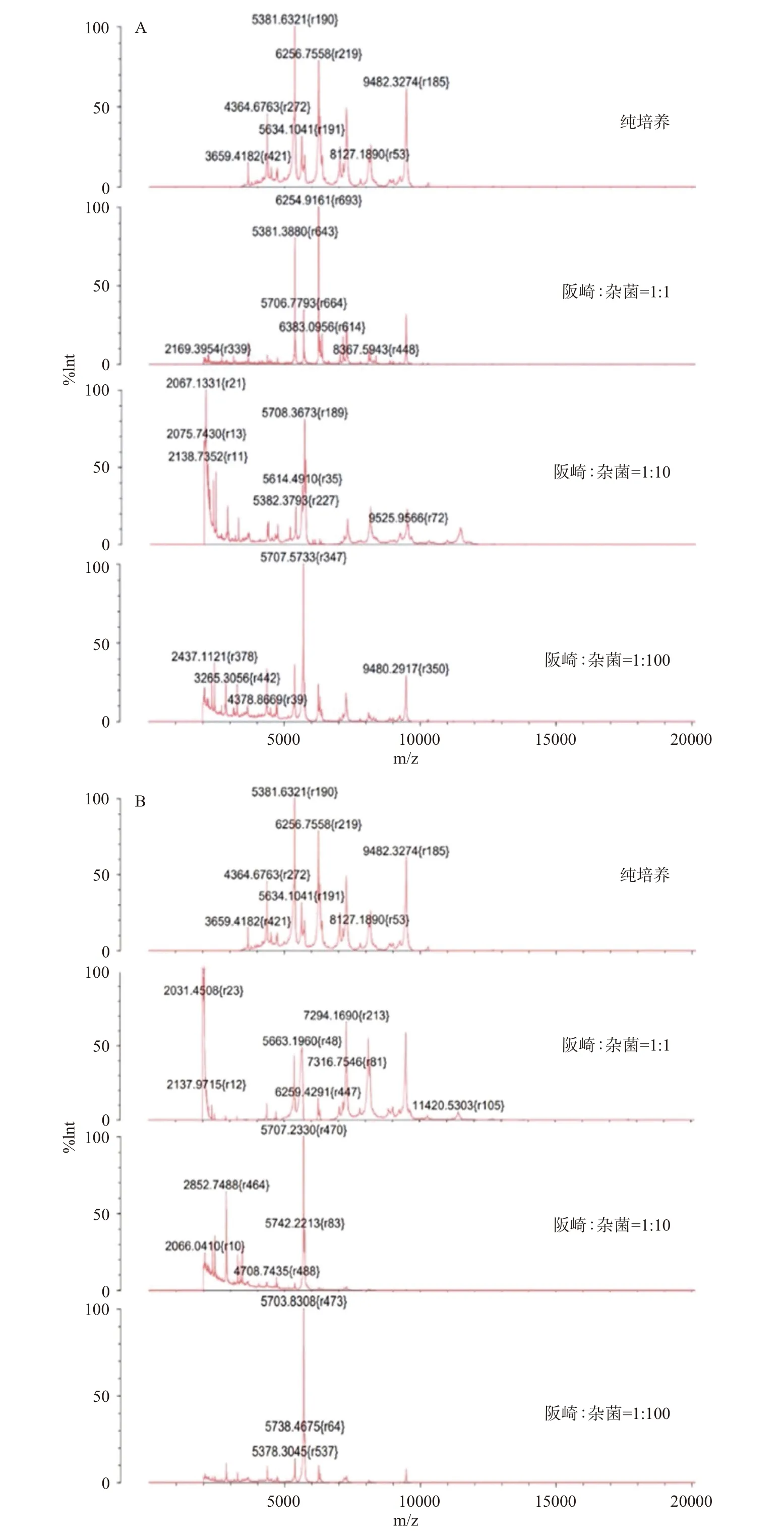

图4 不同奶粉样品中不同杂菌比例条件的蛋白指纹图谱Fig.4 Protein fingerprints of different proportion of mixed bacteria in different milk powder samples
3 结论
在免疫富集联合MALDI-TOF MS检测中,高捕获率及高特异性的免疫磁珠对于检测样本后续的准确鉴定具有重要影响,而免疫磁珠作为一种以抗原抗体特异性结合为原理的分离富集技术,其高效的捕获效率及特异性主要取决于抗原抗体结合的亲和性及特异性。因此,本研究制备了一种可同时对4株不同阪崎克罗诺杆菌具有高亲和性的混菌抗体,通过对其在不同条件下的捕获率进行验证,结果显示该抗体制备的免疫磁珠具有较高的捕获率,且不受奶粉基质的影响。
此外,在实际工作中,检测样本往往可能存在多种致病菌的共同污染,且污染比例不一,所以,能否在复杂污染体系中准确捕获并鉴定目的菌株,也是考验检测方法是否具有特异性及灵敏性的关键。通过对奶粉样品在不同杂菌污染比例条件下的鉴定结果分析显示,尽管在高比例(1:100)杂菌污染条件下,免疫富集联合MALDI-TOF MS鉴定方法仍能对检测样品中的阪崎克罗诺杆菌进行准确鉴定,且此时检测样本中的阪崎克罗诺杆菌浓度约为20 CFU/mL,整个鉴定过程只需约24 h。与传统方法相比,极大缩短了鉴定时间;与分子生物学方法相比[2],克服了试剂及环境的污染;与全基因组测序方法相比,对检测人员的技术要求不高,与单一免疫学方法相比,检出限低至20 CFU/mL。
但是不足之处在于,该检测方法对于抗体的特异性要求较高,且抗体制备耗时,费用高,因此,在抗体方面还有待进一步研究,同时,该方法对于检测单位是否具备MALDI-TOF MS检测条件也有要求。总的来说,本研究建立了一种快速简便,特异性强,准确性高的奶粉中阪崎克罗诺杆菌的检测方法,为奶粉中阪崎克罗诺杆菌的有效快速检测提供了新的方法参考。
