康艾注射液配合化疗治疗晚期大肠癌患者的临床效果
2022-03-09乔运余
乔运余
大肠癌的发生会随着年龄的增加而提高,由于大肠癌在早期并不会出现较为明显的临床症状,因此十分容易被忽视。随着病情的发展,患者会出现血便、脓液血便、大便形状改变、腹部包块等症状[1]。针对晚期大肠癌患者,临床主要采用化疗方式治疗,但化疗会对大肠癌患者的身心健康造成严重影响。对于大肠癌患者,一般采用伊立替康、氟尿嘧啶、亚叶酸钙治疗,但晚期大肠癌患者的身体状况要比早期大肠癌患者差,因此让患者顺利完成化疗,是目前临床研究的重点。本研究就康艾注射液配合化疗治疗晚期大肠癌患者的效果进行分析。现报道如下。
1 资料与方法
1.1 一般资料
选取2019年4月至2020年4月于沈阳市肛肠医院就诊的80例晚期大肠癌患者作为研究对象,随机分为对照组与观察组,各40例。对照组男28例,女12例,年龄51~72岁,平均(68.53±1.54)岁,其中结肠癌21例,直肠癌19例;病理分型:管状腺癌24例,黏液腺癌16例。观察组男25例,女15例,年龄53~74岁,平均(68.72±1.46)岁,其中结肠癌24例,直肠癌16例;病理分型:管状腺癌27例,黏液腺癌13例。两组患者一般资料比较,差异无统计学意义(P>0.05)。具有可比性。
纳入标准:经病理检查确诊为大肠癌,且为晚期患者;预期生存期≥6个月;精神状态稳定;治疗前KPS评分>60分;可正常沟通;ECOG体能状态评分为0或1分;患者或家属知情同意;依从性高,能遵守访视时间、治疗计划以及其他试验流程。
排除标准:精神障碍;其他肠道疾病;明确上消化道出血;既往治疗引起的未恢复至<2级的毒性反应;在入组前30 d内进行过外科大手术;入组前3个月内发生脑血管疾病;合并乙型病毒性肝炎或丙型病毒性肝炎活动期、人类免疫缺陷病毒(HIV)抗体阳性。
1.2 方法
对照组:奥沙利铂注射液(浙江海正药业股份有限公司,国药准字H20093487,规格50 mg)静脉滴注2 h,第1~2天,85 mg/m2;亚叶酸钙(江苏恒瑞医药股份有限公司,国药准字H20000418,规格15 mg)200 mg/m2静脉滴注2 h,每个周期第3~4天使用;5-氟尿嘧啶(南通精华制药股份有限公司,国药准字H32022246,规格10 ml∶0.25 g×5支/盒),400 mg/m2,静脉滴注46 h,每个周期第5~6天使用。21 d为1个周期,治疗2~6个周期。
观察组在上述治疗方案的基础上联合康艾注射液(长白山制药股份有限公司,国药准字Z20026868,规格10 ml×6支、5 ml×12支)60 ml溶于0.9%氯化钠注射液500 ml中静脉滴注,1次/d,治疗2周。
1.3 临床评价
1)疗效判定标准:完全缓解,所有可测量病灶完全消失,并持续4周以上;部分缓解,可测量病灶面积总和减少50%以上,持续4周;稳定,可测量病灶面积总和减少25%~50%,持续4周;进展,可测量病灶的总面积增加25%以上,或出现新的病灶[2]。治疗有效率(%)=完全缓解例数+部分缓解例数/总例数×100%。2)不良反应:包括血小板减少、脱发、胃肠道反应、白细胞减少、肝功能异常、神经毒性。3)生存率:比较两组患者1年、3年生存率。4)免疫功能指标:包括CD3+、CD4+、CD8+、CD4+/CD8+,使用流式细胞仪进行检测。
1.4 统计学分析
采用SPSS 20.0统计软件进行数据分析,计量资料以±s表示,组间比较采用t检验,计数资料以百分率表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组临床疗效比较
观察组治疗有效率高于对照组(P<0.05)。见表1。
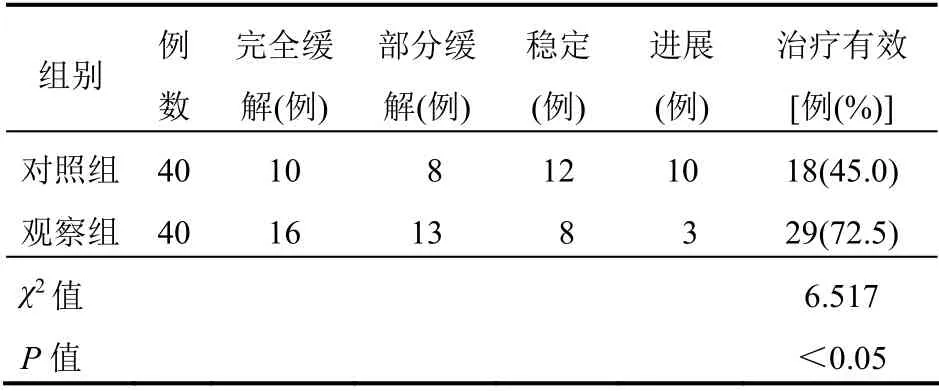
表1 两组患者临床疗效比较
2.2 两组不良反应发生率比较
观察组不良反应发生率低于对照组(P<0.05)。见表2。

表2 两组患者不良反应发生率比较
2.3 两组1年、3年生存率比较
观察组1年、3年生存率高于对照组(P<0.05)。见表3。
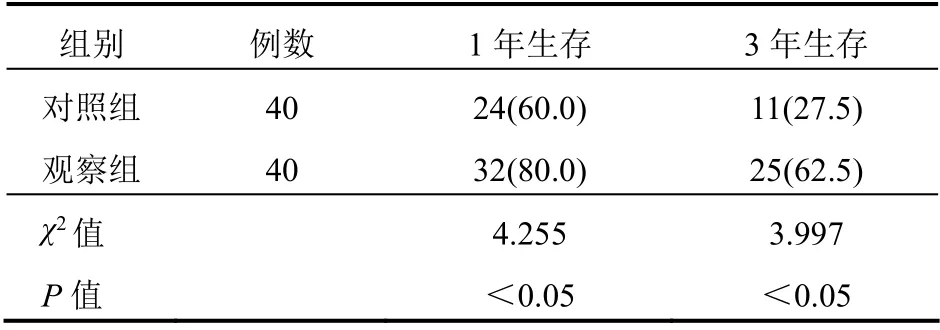
表3 两组患者1年、3年生存率比较[例(%)]
2.4 两组CD3+、CD4+、CD8+、CD4+/CD8+比较
治疗前,两组CD3+、CD4+、CD8+、CD4+/CD8+比较,差异无统计学意义(P>0.05);治疗后,观察组CD3+、CD4+、CD4+/CD8+高于对照组,CD8+低于对照组,差异有统计学意义(P<0.05)。见表4。
表4 两组患者CD3+、CD4+、CD8+、CD4+/CD8+比较(±s)
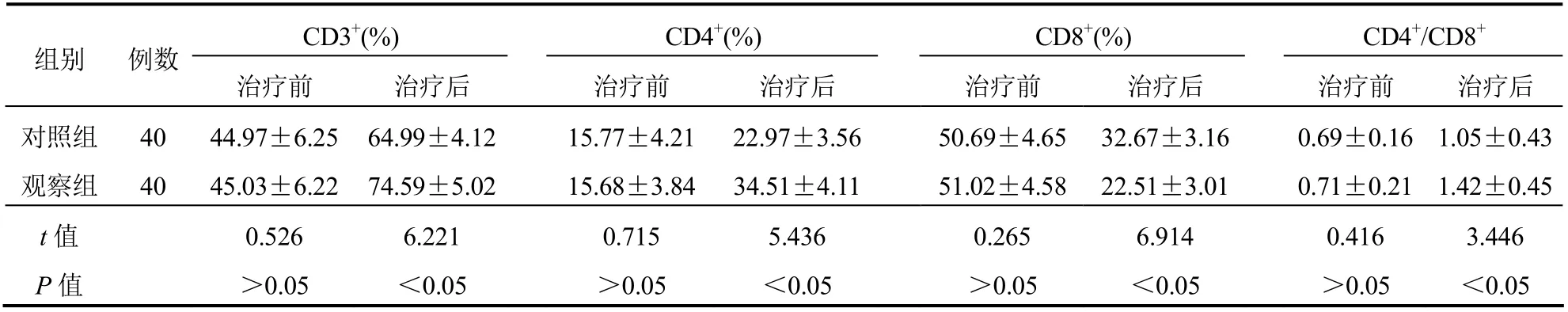
表4 两组患者CD3+、CD4+、CD8+、CD4+/CD8+比较(±s)
CD3+(%) CD4+(%) CD8+(%) CD4+/CD8+组别 例数治疗前 治疗后治疗前 治疗后 治疗前 治疗后治疗前 治疗后对照组 40 44.97±6.25 64.99±4.12 15.77±4.21 22.97±3.56 50.69±4.65 32.67±3.16 0.69±0.16 1.05±0.43观察组 40 45.03±6.22 74.59±5.02 15.68±3.84 34.51±4.11 51.02±4.58 22.51±3.01 0.71±0.21 1.42±0.45 t值 0.526 6.221 0.715 5.436 0.265 6.914 0.416 3.446 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
3 讨论
家族遗传史、不良饮食习惯、生活方式、环境因素等是导致大肠癌发生的危险因素[3]。研究表明,在各种因素中,以饮食因素最重要,大肠癌的发病率与食物中的脂肪消耗量正相关[4]。另外,其也可能与微量元素缺乏、生活习惯改变有关。最近有学者对肿瘤抑制基因与大肠癌发生关系进行研究,发现大肠癌的易感性发病机制与遗传因素有关[5]。肠道的其他慢性炎症也有癌变的可能,如溃疡性结肠炎,有3%~5%癌变。在我国大肠癌是发病率仅次于肺癌的恶性肿瘤。
从中医角度而言,大肠癌的发生与患者正虚感邪、饮食不节、情志失调有关,因瘀毒积聚于肠道,导致传导失司,患者出现排便习惯以及粪便性状的改变。在中医学中并没有大肠癌这个名称,但结合大肠癌患者的临床症状以及病因病机可将其归纳为中医学中的“肠风”“脏毒”等范畴。
目前,临床上针对大肠癌的治疗主要以化疗为主,化疗作为常用的治疗手段,虽然能够控制病情,但是由于接受治疗带来的不良反应明显,部分患者无法完成整个疗程的治疗。而中医药应用于大肠癌患者的治疗在临床上越来越广泛。
本研究中采用的康艾注射液,其作为一种新型抗癌注射液,主要成分包括人参、黄芪、苦参。通过将康艾注射液与化疗药物进行联合治疗,不仅能够发挥出抑制癌细胞的作用,还能够减轻患者接受化疗的不良反应。现代药理学研究指出人参中的有效成分对小鼠艾氏腹水癌细胞、腺癌有明显抑制作用[6]。而黄芪多糖可提高网状内皮系统的吞噬功能,增强机体T细胞、自然杀伤(NK)细胞等的抗癌活性,对改善患者的免疫功能具有重要意义。而苦参中含有的苦参素可对肿瘤细胞诱导的血管内皮细胞增殖有稳定的抑制作用[7]。在常规化疗药物治疗的基础上联合康艾注射液,在本研究中,观察组患者治疗有效率高于对照组,且观察组患者不良反应低于对照组,提示在常规化疗治疗的基础上联合康艾注射液可提高治疗效果,降低不良反应的发生。
临床上为了解康艾注射液应用的疗效,有研究对恶性肿瘤患者采用康艾注射液治疗,结果显示患者的癌胚抗原有明显下降的趋势。另外也有研究指出,针对肿瘤患者采用康艾注射液治疗,能够改善患者临床症状,提高生命质量,降低因接受化疗带来的不良反应[8]。目前,康艾注射液已成为应用比较广泛的中药肿瘤注射剂之一,这是因为该注射液中含有的人参黄芪能够起到补气健脾、益气生津等功效,从而发挥提高患者免疫力,起到良好的抗肿瘤作用。其中含有的苦参素可抑制肿瘤细胞,甚至能够起到直接抑杀癌细胞的作用,有利于控制患者肿瘤的生长。通过对康艾注射液的抑制肿瘤作用进行深入分析,发现注射液中的有效物质能够有效阻断癌细胞DNA分子的合成,从而起到抑制肿瘤细胞生长的目的[9]。另外,作为治疗恶性肿瘤的辅助药物之一,康艾注射液还能够起到缓解患者癌痛的作用。
对于晚期恶性肿瘤治疗的目的在于提高患者的生命质量,控制肿瘤生长,延长患者生存时间。本研究结果显示,观察组1年、3年生存率高于对照组。但由于晚期大肠癌患者身体状态不佳,易因为化疗药物的不良反应而影响到化疗的正常开展,部分患者可能因接受化疗带来的严重不良反应,导致化疗的中止。而为探究康艾注射液这种中药肿瘤注射液的临床疗效,针对已经上市后的康艾注射液用于恶性肿瘤的临床疗效也进行了专门的评估。研究发现,采用康艾注射液+单药化疗的临床疗效并不差于两种化疗药物的联合使用[10]。该临床试验进一步证明了康艾注射液的抗肿瘤治疗作用,在很大程度上奠定了康艾注射液在临床上用于治疗恶性肿瘤患者的地位。
通过将康艾注射液与化疗药物联合应用能够促进造血功能,其中的人参和黄芪可提高人体T细胞亚群及NK细胞吞噬活性,对提高机体抗肿瘤细胞吞噬作用有重要意义。康艾注射液中的苦参素能够抑制肿瘤细胞诱导的血管内皮细胞增殖,还可增强LAK细胞抗癌活性,其中有效成分可增强对肿瘤细胞的杀伤能力。本研究结果显示,治疗后观察组CD3+、CD4+、CD4+/CD8+高于对照组,观察组CD8+低于对照组。同时,其与化疗药物的联合应用有增效作用,还可保护骨髓造血干细胞,在增强抗肿瘤作用的同时减轻化疗不良反应,为提高患者的生命质量,更好地接受后续治疗创造了条件。
综上所述,针对晚期大肠癌患者在接受化疗治疗的基础上联合康艾注射液治疗可获得更加满意的疗效,不良反应低。
