紫苏硬脂酰-ACP 脱氢酶基因家族鉴定及表达分析
2022-03-09董书言周雅莉杨宏斌王计平
邢 志,董书言,王 超,周雅莉,杨宏斌,王计平
(山西农业大学 分子农业与生物能源研究所,山西太谷 030801)
紫苏(Perillafrutescens)古名荏,又名赤苏、桂荏、香苏,系唇形科紫苏属一年生草本植物,在亚洲国家种植广泛[1]。紫苏具有丰富的种质资源,在中国已有2000多年的栽培历史,适宜在光照充足、土壤疏松、肥力足及排水好的环境条件下种植[2]。紫苏具有特异芳香,主要用于油用、药用、食用及香料方面,是卫计委首批公布的60种药食同源植物之一,可以开发出多种保健食品[3]。紫苏种子中含油量高达45%~55%,其不饱和脂肪酸含量丰富,占总脂肪酸含量的 90%以上,其中油酸含量约占12.01%,亚油酸含量约为15.43%,α-亚麻酸含量高达62.73%,是目前发现的亚麻酸含量较高的油料作物之一[4-5]。α-亚麻酸能够提高人体免疫力、降低胆固醇、延缓机体衰老、预防阿尔茨海默病等,常用于保健和治疗疾病[6]。因此,紫苏油极具开发价值,是良好的植物保健资源,其在医药及食品等领域都具有重要的的开发利用价值和良好的市场前景[7]。
植物油脂主要通过脂肪酸(FA)的生物合成和 TAG 的合成积累来形成,脂肪酸的从头合成途径主要发生在质体中,该过程以乙酰辅酶 A 作为底物,在酰基载体蛋白(ACP)的参与下进行催化合成[8]。在脂肪酸合酶复合物(FAS)的催化下,丙二酰辅酶 A 与 ACP 结合,酰基链每个循环经历 2 个碳原子形式的连续缩合反应,产生16∶0-ACP和18∶0-ACP[9]。硬脂酰-ACP脱氢酶(stearoyl-ACP desaturase,SAD)以硬酰基-ACP(C18∶0-ACP)为底物,催化18∶0-ACP 在第9-10碳原子间脱氢形成一个双键产生18∶1-ACP,得到的18∶1-ACP可以进入原核甘油脂途径,或被水解成游离脂肪酸,进而在酰基-CoA 合成酶的作用下活化成脂酰-CoA,并从质体转运到内质网或胞质中[10-11]。植物脂酰-ACP 脱饱和酶定位于植物质体中,是植物中唯一可知的可溶性脱饱和酶家族,包括Δ9硬脂酰 ACP 脱饱和酶、Δ6 软脂酰 ACP 脱饱和酶和Δ4 软脂酰ACP 脱饱和酶等,其中SAD催化硬脂酰基-ACP在Δ9 位置去饱和形成油酰ACP,使硬脂酸脱饱和后形成油酸(18∶1),其存在于质体基质中,调控紫苏不饱和脂肪酸成分的比例,是不饱和脂肪酸合成代谢的关键酶[12],对调节油料作物种子中脂肪酸组成具有重要意义。目前,已经从蓖麻[13]、油菜[14]和棉花[15-16]等植物中克隆获得SAD基因,并验证了其功能和表达特性。Liu 等[16]利用 RNA 干涉对棉花SAD基因进行沉默,结果发现棉花中的硬脂酸含量从20%上升到40%,而棉籽油中的3种主要脂肪酸(棕榈酸、油酸和亚油酸)含量减少。在烟草中过表达SAD基因,硬脂酸(18∶0)被催化为油酸(18∶1),使得多不饱和脂肪酸含量增加,转基因烟草及其种子的抗寒性显著提高[17]。前人研究表明,SAD家族基因在不同组织器官中具有不同的表达模式[15,18-19]。Kachroo等[18]研究表明拟南芥AtSADs呈现组织特异性表达,且在发育种子中的表达量比其他组织都高。Shang等[15]对棉花中SAD基因家族进行鉴定,研究发现棉花GhSAD2 和GhSAD4 在开花后20~35 d的发育种子中表达量较高,在其他组织中表达较低。已有报道显示,SAD基因家族已在棉花[15]、拟南芥[18]、可可[19]等作物中被鉴定,而关于紫苏PfSAD的研究鲜见报道。因此,为解析紫苏硬脂酰-ACP 脱氢酶基因家族(PfSAD)在脂肪酸合成过程中发挥的作用,本研究对紫苏SAD家族成员的基因结构及酶蛋白理化性质等序列特征进行分析,并采用实时荧光定量 PCR 技术对紫苏PfSAD家族基因的表达特性进行研究,为进一步探究PfSAD家族基因的功能以及紫苏油脂合成机制、提高紫苏油品质与产量提供理论依据。
1 材料和方法
1.1 试验材料
供试植物材料为‘晋紫苏1号’品种,种植于山西农业大学农作站试验基地,以点播方式进行种植,每小区分6行,每行6株,株距50 cm,行距50 cm,小区间距50 cm,播种1个月后进行间苗。在苗期、花期及种子发育不同时期分别取样,取6周龄左右的幼苗根、茎、叶、盛花期的花,以及开花后10、20、30、40 d的种子,所有样品液氮速冻后储存于-80 ℃冰箱备用。
1.2 试验方法
1.2.1 紫苏PfSADs基因的鉴定在课题组前期自测序获得的紫苏转录组数据库中筛选出功能注释为SAD的基因序列及氨基酸序列,根据不同物种间同源基因核苷酸序列相对保守的特点,将紫苏SAD的基因序列与拟南芥和蓖麻等植物中的SAD序列进行比对分析,获得紫苏PfSADs基因的CDS序列。
1.2.2 紫苏PfSADs基因编码蛋白的理化性质及结构分析利用生物信息学软件对紫苏PfSAD家族基因进行分析,通过在线工具NCBI-ORF Finder分析紫苏PfSAD家族基因的开放阅读框(ORF);通过在线软件ProtParam(http://web.expasy.org/protparam/)对PfSADs蛋白的分子量、等电点等基本理化性质进行分析;利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)预测PfSADs蛋白质的跨膜结构区域;使用Plant-Multi和TargetP在线网站对PfSADs编码的蛋白进行亚细胞定位预测分析;运用NCBI-CDD分析紫苏PfSADs蛋白序列的功能结构域;采用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_ automat.pl?page=npsa_sopma.html)软件预测PfSADs蛋白质的二级结构;运用SWISS-MODEL(https://swissmodel.expasy.org/interactiv)对PfSADs蛋白质的三级结构进行同源建模和预测分析;采用多序列比对工具ClustalW对紫苏PfSAD家族基因的氨基酸序列进行比对;运用MEGA7软件邻接法(neighbor-joining,NJ)对紫苏及其近缘种的SAD蛋白进行比对分析,并构建系统进化树。
1.2.3 RNA提取及cDNA的合成用艾德莱公司的 EASYspin植物 RNA 快速提取试剂盒提取紫苏根、茎、叶、花和不同发育时期种子的RNA,并检测各个组织RNA 浓度与质量;使用ABM公司的5×All-In-One MasterMix反转录试剂盒进行反转录合成cDNA,保存备用。
1.2.4 紫苏PfSAD家族基因组织特异性表达分析利用Primer 6.0设计实时荧光定量PCR(qRT-PCR)特异性引物(表1),扩增片段长度为150~220 bp,退火温度为53~61 ℃之间,其中以紫苏Actin为内参基因[20]。实时荧光定量PCR使用GenStar公司的2×RealStar Green Power Mixture试剂盒,反应体系为:cDNA模板0.5 μL,正向引物0.2 μL,反向引物0.2 μL,ddH2O 4.1 μL,2×RealStar Green Power Mixture 5 μL,总计10 μL;反应程序为:95 ℃ 10 min,95 ℃ 15 s,Tm 1 min,共40个循环;65 ℃ 5 s,95 ℃ 15 s。应用CFX96TM OpticsModule实时荧光定量PCR仪(Bio-Rad)进行PCR扩增,每个样品进行3次重复,利用2-ΔΔCt法[21]计算紫苏PfSADs基因的相对表达量。

表1 PfSADs基因qRT-RCR引物
2 结果与分析
2.1 紫苏PfSADs基因家族的鉴定及基因结构和蛋白理化性质分析
从紫苏转录组数据库中筛选得到SADs基因,利用拟南芥AtSADs基因序列为模板进行比对分析,通过NCBI-CDD将获得的紫苏SAD序列进行结构分析,鉴定获得6个具有酰基-ACP 脱氢酶保守结构域的PfSAD家族成员,且均属于含有Fe-O-Fe中心的Ferritin-like铁蛋白超家族。
通过在线软件ProtParam对紫苏6个SAD家族基因编码蛋白的基本理化性质进行分析,结果如表2所示:紫苏PfSAD家族基因编码蛋白长度范围为367~396 aa,其蛋白相对分子质量最低的为89 848.27 Da(PfSAD6),最高的为97 876.78 Da(PfSAD1),理论等电点在5.02~5.07之间,均小于7.0,因此预测PfSADs家族可能为一类酸性蛋白,且均为不稳定疏水性蛋白,6个PfSADs蛋白的理化性质均与其他植物SAD的理化性质相近。使用SOPMA网站对PfSADs蛋白的二级结构进行预测,由表3可知,PfSADs的二级结构由4种元件构成,其中α-螺旋所占比例较高为53.08%~57.88%,无规则卷曲所占比例为29.43%~34.10%,β-转角和延伸链则镶嵌于整个蛋白中,所占比例均小于10%。通过TMHMM、Plant-Multi和TargetP分别预测PfSADs蛋白的跨膜结构域、亚细胞定位及N-末端转运肽(TP),结果显示,PfSADs蛋白均不存在跨膜结构域;其中PfSAD1、PfSAD2、PfSAD3、PfSAD4、PfSAD5和PfSAD6分别含有24、33、19、19、35 和33个氨基酸的叶绿体转运肽,cTP值分别为0.665 3、0.909 9、0.0082、0.784 6、0.879 5和0.970 6,表明这6种蛋白定位在叶绿体,在叶绿体中发挥作用。
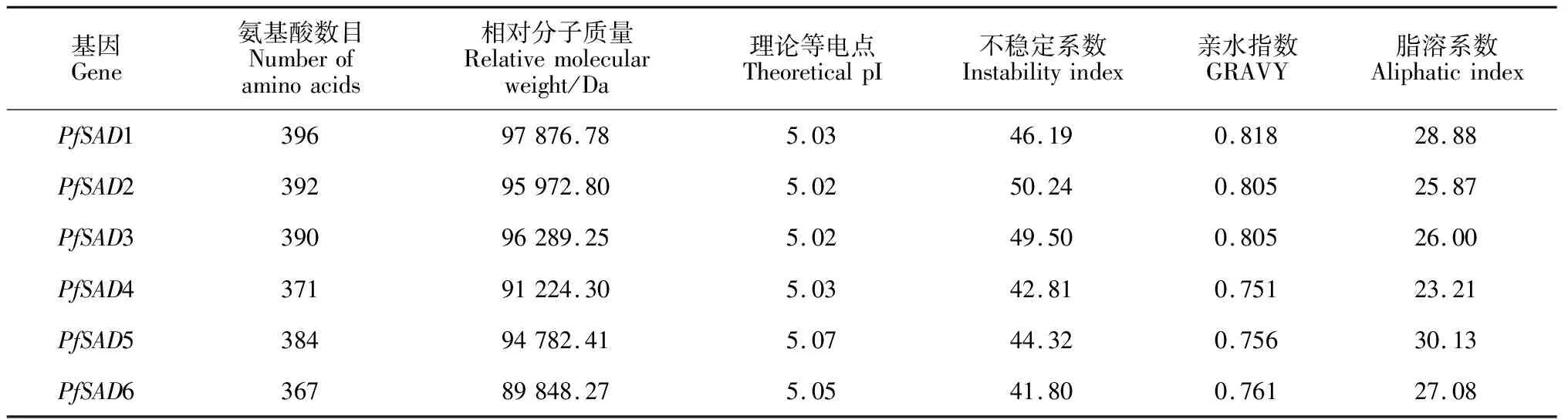
表2 紫苏SAD家族蛋白的基本理化性质
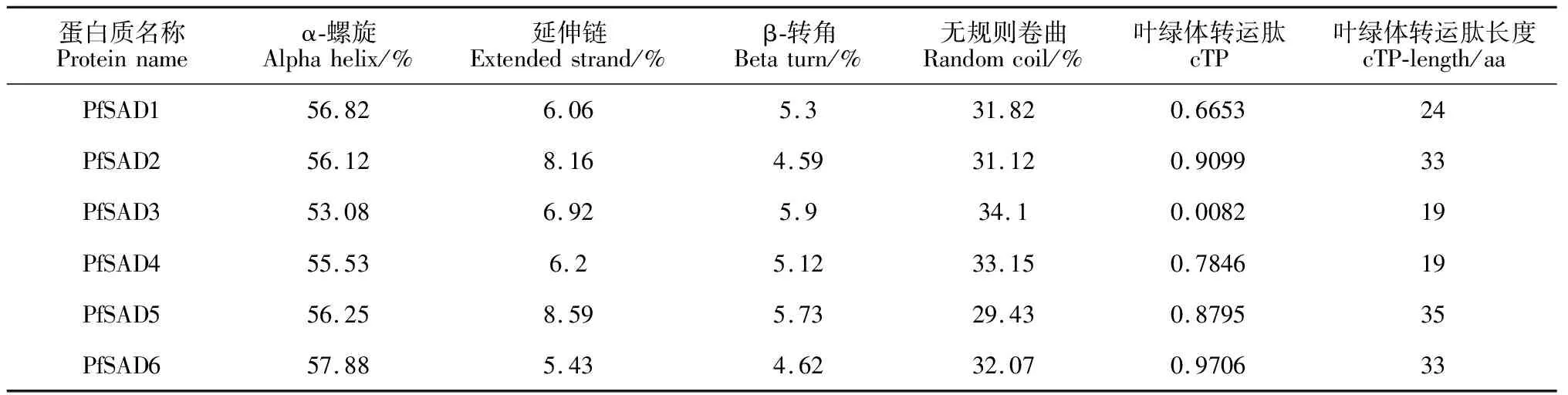
表3 紫苏SAD家族蛋白二级结构跨膜区及亚细胞定位分析
利用 SWISS-Model 软件预测分析紫苏PfSADs蛋白质的三级结构并进行同源建模(图1)。对紫苏PfSADs蛋白进行同源建模时使用的模板为蓖麻1afr.1.A蛋白[13],预测结果显示PfSADs蛋白均与蓖麻1afr.1.A蛋白序列相似度较高,相似性范围为51%~59%,序列覆盖度在87%~92%之间;X射线衍射发现紫苏PfSADs蛋白编码多肽的保守性基本一致,其蛋白活性形式为二聚体,多个二聚体共同形成催化Fe2+的活性位点;PfSADs蛋白包含4个铁辅基[FE(II)ION]配体,其蛋白单体主要由α-螺旋、β-折叠和其他无规则卷曲组成,含有一个由4个α-螺旋束包围的二铁离子,每个蛋白单体还含有2个与其相互作用的金属配合物,由α-螺旋束组成的氨基酸侧链或基团为Fe2+的配基,两个单体的二铁离子位于蛋白二聚体底物结合凹槽的内部,共同构成了催化SAD的活性中心,该中心催化酰基-ACP上第九个和第十个碳原子脱氢形成不饱和键,表明其在蛋白脱氢过程中发挥作用。
2.2 紫苏SAD蛋白同源序列比对
通过ClustalW软件对紫苏PfSADs蛋白家族进行多序列比对分析,将其氨基酸序列与蓖麻(Ricinuscommunis)RcSAD1、拟南芥(Arabidopsisthaliana)AtSSI2、甘蓝油菜(Brassicanapus)BnSAD1和可可(Theobromacacao)TcSAD1的氨基酸序列进行比对。紫苏SAD蛋白同源序列比对结果如图2所示,紫苏PfSADs氨基酸序列与蓖麻 RcSAD1、拟南芥 AtSSI2、甘蓝油菜BnSAD1和可可TcSAD1 氨基酸序列的相似性较高,均大于50%,其保守结构域与RcSAD1、AtSSI2的保守结构域相类似,都分布在11个α-螺旋和2个β-转角之内。前人报道显示,植物SAD脱氢酶催化中心的8个关键氨基酸影响着不同脂肪酰-ACP的选择特异性。例如,拟南芥 AtSSI2的关键氨基酸残基(M152、L153、T155、L156、P217、T219、G226和F227)和蓖麻 RcSAD1(M114、L115、T117、L118、P179、T181、G188和F189)均能使其进行特异性选择并催化 18∶0-ACP 生成 18∶1-ACP[22]。紫苏PfSADs多序列比对结果表明,PfSAD1-PfSAD5具有与 RcSAD1和AtSSI2完全相同的关键氨基酸,PfSAD6含有5个变异氨基酸,分别为M134G、T137S、P199V、T201W和G208A,预测其催化脱氢作用可能对底物的选择有所差异。EENRHG 和 DEKRHE为典型SAD特征的保守组氨酸富集区,PfSADs家族的6个蛋白均存在这两个保守区域,其天冬氨酸(D)和组氨酸(H)为PfSADs蛋白单体的二铁离子提供了必需的结合位点,为脱氢酶的催化中心Fe2+提供了催化活性。
2.3 紫苏SAD蛋白的系统进化分析
利用MEGA 7.0软件构建紫苏PfSADs蛋白与其他植物SADs蛋白的系统进化树。结果如图3所示,通过系统进化分析发现,6个紫苏SAD家族蛋白与其他7种植物蛋白被聚为三大类:PfSAD1与向日葵HaSAD、蓖麻RcSAD1、可可TcSAD1、白头翁LcSAD3等亲缘关系较近,被聚为一类,而PfSAD2和PfSAD3与拟南芥AtSAD3、拟南芥AtSAD4、芝麻SiSAD和白头翁LcSAD2相似性较高,聚在第二类,PfSAD4、PfSAD5和PfSAD6与拟南芥AtSAD6聚在一类,具有较近的亲缘关系。
2.4 紫苏PfSADs基因的表达特性分析
以Actin作为内参基因,运用荧光定量PCR技术分析紫苏PfSADs基因在‘晋紫苏1号’不同组织及不同发育时期种子(开花后10、20、30及40 d)的表达情况。结果(图4)显示,紫苏PfSAD家族基因表达情况具有多样性。紫苏PfSAD1、PfSAD2、PfSAD3在各个组织及不同发育时期种子中均有表达,其中PfSAD1在根中表达量最弱,在叶中表达量最高,PfSAD3在所有组织器官中均有高表达;PfSAD4在叶和开花后10 和40 d基本不表达,在花及开花后20 d时表达较弱,在根、茎、开花后10和30 d时表达量较高;PfSAD5和PfSAD6分别在开花后30 d种子和花中表达较高,其他时期及组织基本不表达。在不同发育时期种子中,PfSAD1和PfSAD3的表达随着种子发育先升高后降低,PfSAD2、PfSAD4呈现先下降后升高再下降的趋势,且PfSAD2在植株开花后10、30和40 d的表达量相较于其他组织具有明显的表达优势;PfSAD1-PfSAD5均在开花后30 d时表达量达到峰值,其中PfSAD2较其他基因具有明显的表达优势。研究结果表明6个基因均具有转录活性,PfSAD1在叶中表达量最高,PfSAD2-PfSAD5在种子发育成熟期时表达量达到高峰,PfSAD6在花中表达量最高,推测紫苏PfSADs基因在不同组织器官中发挥不同的功能。
3 讨 论
紫苏是一种多用途经济作物,既可食用,又可作为医用药品,其中紫苏籽油富含不饱和脂肪酸,在保健和医疗等方面都具有重要作用[3]。硬脂酰-ACP脱氢酶作为高等植物中唯一的脂溶性脱氢酶,在不饱和脂肪酸合成过程中起重要调控作用[10,12]。因此,探究紫苏硬脂酰-ACP 脱氢酶的催化活性及其分子合成机制,对紫苏SAD的功能鉴定及通过转基因技术培育高油酸紫苏具有重要指导意义。
本研究通过筛选紫苏转录组数据库,鉴定并获得6个紫苏SAD基因,其编码蛋白长度、相对分子质量、理论等电点等基本理化性质有所差异,如PfSAD6 编码蛋白长度为367 aa,相对分子量为89 848.27 Da,二级结构的α-螺旋含量最高,分布较为均匀;而 PfSAD3编码蛋白序列较长(390 aa),相对分子质量也较大(96 289.25 Da),二级结构的α-螺旋含量相对最少,在序列中间分布密集;PfSADs蛋白质序列不包含跨膜区域,预测其定位于叶绿体上,这与其他物种中硬脂酰-ACP脱氢酶在细胞质体内进行催化反应的研究结果相一致[23-24];对PfSADs蛋白信号肽预测分析结果表明,均无信号肽,这与预测的PfSADs是非跨膜蛋白的结论相一致;三级结构预测发现PfSADs具有Acyl_ACP_Desat的保守结构域,蛋白活性形式均为同型二聚体,每个蛋白单体包含一个由2个铁原子组成的二铁中心,二铁中心镶嵌在α-螺旋束中,这表明6个PfSADs均具有催化硬脂酰-ACP脱氢酶的活性中心,属于类铁氧化还原蛋白超家族。
已有研究证明,植物SAD酶蛋白的8个关键氨基酸种类影响着SAD 对不同酰基-ACP的选择特异性,当这些关键氨基酸发生突变时,该脱氢酶对底物选择活性会发生改变。蓖麻 RcSAD1的关键氨基酸残基(M114、L115、T117、L118、P179、T181、G188 和 F189)能催化 18∶0-ACP 生成 18∶1-ACP[22],当蓖麻 RcSAD1的 T117、L118、F189和T206突变为其他氨基酸,则 RcSAD1 酶所催化的底物对 16∶0-ACP 的选择活性远高18∶0-ACP[23,25]。本试验多重序列比对分析发现紫苏PfSADs与拟南芥、蓖麻、可可和甘蓝型油菜的关系较近,都含有硬酰基-ACP脱氢酶的关键氨基酸和保守基序,说明SAD的关键氨基酸和典型结构域在进化上是高度保守的,且其关键氨基酸和保守基序在铁氧化还原反应中发挥重要作用,是SAD进行底物特异性选择的重要识别区域。对系统发育树分析表明,紫苏6个SAD家族基因分别被聚到三类,其中PfSAD1属于第一类,第二类包含PfSAD2和PfSAD3,PfSAD4、PfSAD5和PfSAD6与拟南芥SAD6聚为第三类,表明SAD的特定结构域在生物进化中具有高度保守性。
在拟南芥中,发现缺失SAD基因拟南芥突变体叶片中硬脂酸含量较高,且AtSSI2基因活性较高,在油酸(18∶1)合成中发挥重要作用[17,26];牡丹PoSAD基因在花瓣及60 d种子中表达量最高,在根和10 d种子中的表达量最低[27]。Zhang等研究发现可可TcSAD1、TcSAD2和TcSAD7在各组织中均有表达,TcSAD3和TcSAD4在花中表达较高,TcSAD5在根中表达较高[19]。本研究发现,PfSADs基因在紫苏各组织器官中的表达有所差异。其中:PfSAD1在各组织中表达广泛,但在叶中表达量最高,表明其主要在叶中行使功能;PfSAD2、PfSAD4在各组织中均有表达,特别是在发育种子中具有极高的表达量,且PfSAD2在开花后30 d达到最高,PfSAD4在开花后10 和30 d时较其他组织中具有更高的表达量,说明PfSAD2和PfSAD4主要在种子中行使功能;PfSAD3在各组织中表达量均较高,尤其在种子发育时期的表达量显著高于在其他组织中的表达,推测其在各组织中均发挥作用,在发育种子中较显著;PfSAD5仅在开花后30 d表达较强,在其他组织中表达均较弱。PfSAD2-PfSAD5等4个基因均在发育种子中表达量较高,并且都在开花后30 d达到最高值,说明这4个基因在种子中发挥着重要作用并主要催化成熟期种子的表达,在脂肪酸合成过程中催化饱和脂肪酸脱氢反应。PfSAD6仅在花中表达,在其他组织中不表达,且在同源序列比对中PfSAD6的关键氨基酸含有5个变异氨基酸,这可能与该基因在底物特异选择上及其在紫苏组织发育过程中发挥的功能存在一定的联系,这与Zhang等[19]研究发现可可TcSAD3和TcSAD4在花中表达较高的功能较为相似。
油酸为不饱和脂肪酸的重要组成部分,其含量是植物营养价值及理化性质稳定的重要影响因子,近年来,在油菜[14]、花生[28]等油料作物中已经对SAD的功能进行了鉴定,并通过转基因技术进行品种改良,实现了高油酸化。本研究获得了紫苏硬脂酰-ACP脱氢酶基因PfSADs,并对其进行生物信息学分析和表达特性的研究,为进一步提高紫苏油酸含量提供了理论依据。
