代谢工程改造大肠杆菌生产琥珀酸
2022-03-09唐文秀王学明郭亮季立豪高聪陈修来刘立明
唐文秀,王学明,郭亮,季立豪,高聪,陈修来,刘立明
(1 江南大学食品科学与技术国家重点实验室,江苏 无锡 214122;2 江南大学国际食品安全联合实验室,江苏 无锡 214122)
琥珀酸作为一种重要的四碳二羧酸,被广泛应用于食品、化学、制药以及农业领域。由于其广泛的应用价值,2002 年被美国能源部列为12 种大宗化学品之首。由于化学合成法生产琥珀酸存在反应条件苛刻、原料不可再生以及环境污染等弊端,近年来以微生物细胞工厂利用可再生资源生产琥珀酸受到了越来越多的关注。产琥珀酸放线杆菌、产琥珀酸曼氏杆菌、酿酒酵母和大肠杆菌等都被经过代谢工程改造生产琥珀酸。其中,由于大肠杆菌遗传背景清晰、基因改造工具成熟以及营养需求简单等优点,受到了广泛关注。
在大肠杆菌中,存在三种琥珀酸生物合成途径:还原性三羧酸途径(reductive tricarboxylic acid pathway,r-TCA)、三羧酸途径(tricarboxylic acid pathway,TCA)和乙醛酸途径。r-TCA是合成琥珀酸的主要途径,由于受到胞内烟酰胺腺嘌呤二核苷酸(NADH)的限制,琥珀酸的产率仅为1mol/mol葡萄糖。在乙醛酸循环中,由乙酰CoA和草酰乙酸转化为琥珀酸和苹果酸,琥珀酸的产率为1.25mol/mol葡萄糖。有研究表明,在厌氧条件下,激活r-TCA途径和乙醛酸途径,并保持胞内氧化还原电位平衡,琥珀酸的最大理论得率为1.12g/g 葡萄糖(1.71mol/mol葡萄糖);在有氧条件下,琥珀酸的最大理论得率为1.0mol/mol葡萄糖。
目前,代谢工程改造大肠杆菌提高琥珀酸得率的策略主要包括以下四种。①阻断冗余代谢支路。Jantama 等通过阻断副产物路径并结合适应性进化,获得工程菌KJ134,可以产71.5g/L琥珀酸,得率为1.53mol/mol 葡萄糖。②强化C~C的羧化过程。在琥珀酸生物合成过程中,C中间体(磷酸烯醇丙酮酸或丙酮酸)通过固定一分子CO到C中间体(草酰乙酸或苹果酸),是琥珀酸生物合成的关键步骤。加强羧化反应主要包括过表达本源羧化酶(包括磷酸烯醇丙酮酸羧化酶和苹果酸酶)或过表达异源羧化酶(包括磷酸烯醇丙酮酸羧激酶或丙酮酸羧化酶)等。例如,通过在AFP111中过表达丙酮酸羧化酶可使琥珀酸产量提高到99.2g/L。优化和基因的表达,Tang1683 的琥珀酸产量提高到92.7g/L。③提供充足的还原力和能量。增加还原力NADH的供给主要策略为:表达丙酮酸脱氢酶(FDH)和改造戊糖磷酸途径,提高能量的供给策略主要为:过表达磷酸烯醇式丙酮酸羧激酶,将磷酸烯醇式丙酮酸羧化为草酰乙酸的同时生成一分子ATP。④控制氧化还原的平衡。由于菌株NZN111(ΔA,ΔB)的NADH/NAD比例失衡,在厌氧条件不能有效利用葡萄糖,梁丽亚等过表达苹果酸脱氢酶,降低胞内NADH/NAD比例,提高了细胞在厌氧条件下代谢葡萄糖的能力与琥珀酸的合成能力。
尽管上述策略可以提高琥珀酸的得率,但是在琥珀酸发酵过程中仍存在乙酸、乙醇、乳酸和丙酮酸等副产物积累,抑制细胞生长,降低琥珀酸的得率,同时增加了琥珀酸下游提取的成本。为此,本研究通过复合诱变筛选一株能够耐受0.9mol/L NaCl 的突变菌株FMME-N-2,随后采用基因敲除、辅因子调控、发酵优化等策略降低了副产物的积累,最后在30L 发酵罐中菌株FMME-N-26 生产111.9g/L 琥珀酸,得率为1.11g/g葡萄糖(理论得率的99%),为琥珀酸的工业化生产奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒
本研究使用的大肠杆菌JM109 和FMME-N分别用于表达载体的构建和生产菌株,FMME-N 从骆驼瘤胃中分离,经4 轮ARTP 诱变所得,本实验室筛选与保藏,保藏编号CCTCC M2018568。其中本研究所使用的基因工程菌和重组质粒如表1所示。

表1 本研究所使用的菌种和质粒
1.1.2 主要仪器和试剂
PCR仪、全自动凝胶成像系统、电转仪、核酸电泳仪;紫外可见分光光度计;M-100 生物传感器;高效液相色谱仪;厌氧培养箱;渗透压仪。
限制性内切酶、Prime Star高保真酶、Taq DNA聚合酶、TDNA连接酶、DNA marker,大连宝生物工程公司;一步同源重组酶,南京诺唯赞生物科技有限公司;细菌基因组提取试剂盒、质粒提取试剂盒、胶回收试剂盒、产物纯化试剂盒、氨苄青霉素、硫酸卡那霉素、氯霉素、阿拉伯糖、异丙基硫代半乳糖苷(IPTG),生工生物工程(上海)公司;琥珀酸、乳酸、乙酸、甲酸,Sigma 公司;碘化丙啶(PI)、溴甲酚紫,上海阿拉丁生化科技股份有限公司;PCR引物由苏州金唯智生物科技有限公司合成;其他试剂来自国药集团化学试剂有限公司。
1.1.3 培养基
本研究所用培养基及其抗生素如表2所示。

表2 本研究所用的培养基及其抗生素
1.2 实验方法
1.2.1 培养条件
(1)平板培养 取保存于-80℃装有菌液的甘油管三区划线于LB 固体培养基中,在培养箱中37℃倒置培养16h,得到大小均匀的单菌落。
(2)种子培养方法 一级种子培养,挑取平板上大小均匀的单菌落,接种于25mL/100mL 的液体LB 培养基中,37℃、200r/min 培养9h;二级种子培养,将一级种子液转接100μL 至装有50mL/500mL的LB培养基中,37℃、200r/min培养7h。
(3)厌氧摇瓶发酵 按照1%(体积比)的接种量将一级种子培养液接种于装有80mL 发酵培养基的500mL 三角瓶中。有氧阶段:37℃、200r/min培养12h,迅速倒入100mL无菌厌氧瓶中,同时加入10g/L KHCO和4g MgCO用于控制pH,发酵条件为38℃、200r/min。在厌氧阶段发酵过程中,每隔12h添加800g/L的葡萄糖维持发酵液的葡萄糖浓度在10~20g/L,同时添加碳酸镁维持发酵液的pH在6.2以上,发酵至72h结束。
(4)两阶段发酵培养方法 采用3.6L发酵罐进行两阶段补料分批发酵。发酵罐初始装液量为2L。将二级种子液按总体积10%(体积比)的接种量接种至发酵培养基中,开始有氧发酵。有氧阶段:初始转速为400r/min,通气量为1.5vvm(vvm 表示每分钟通气量与罐体实际料液体积的比值),温度37℃,pH 为7.0。发酵过程中流加氨水控制pH 至7.0;培养8h 左右,溶氧(dissolved oxygen,DO)上升,20g/L 的初始葡萄糖消耗完全,启动自动补料模式;约8.5h,停止通气,降低转速至200r/min,补加10g/L KHCO使其短时间内产生大量CO转为厌氧发酵,同时降低葡萄糖补料速率;厌氧阶段发酵条件:发酵温度38℃,转速200r/min,自动控制优化不同的补料速率,并利用2mol/L NaCO+0.5mol/L NaOH控制发酵pH=6.5,发酵至72h结束。
1.2.2 ARTP(atmospheric and room temperature plasma)与Co-γ射线复合诱变及菌株筛选
吸取10μL 菌悬液滴在无菌金属载片中央,置于ARTP 育种机,处理条件详见表3。将诱变处理后的载片放入装有990μL无菌生理盐水的1.5mL离心管中,涡旋振荡仪振荡菌体2~3min,彻底洗脱菌体,转接入装有50mL 种子培养基的500mL 三角瓶中,37℃、200r/min 培养9h,适当稀释后取100μL 涂布于固体筛选培养基,置于充满CO气体的厌氧培养箱中37℃培养24~36h。

表3 ARTP处理条件
将由ARTP诱变后筛选得到的突变株制备菌悬液分置于4 个10mL 离心管中,每管8mL,直接进行γ 射线处理,辐照剂量分别为0、0.2kGy、0.4kGy 和0.6kGy,适当稀释辐照后的菌悬液,取100μL 涂布于固体筛选培养基,置于充满CO气体的厌氧培养箱中37℃恒温培养24~36h。以值为指标[值=变色圈直径(mm)/菌落直径(mm)×菌 落 培 养 时 间(h)], 从 含 有0.9mol/L NaCl(2191mOsmol/L)的高渗固体筛选平板上挑选具有较高值的单菌落于装有80mL 种子培养基的100mL厌氧瓶中,摇瓶发酵验证筛选出琥珀酸生产能力较出发菌株优良的突变株重复进行厌氧摇瓶发酵验证3次,所得发酵液进行琥珀酸产量的分析检测,生产能力最优的菌株即为筛选得到的最佳突变株。将经过复合诱变筛选得到的最优突变株进行4~20代传代培养,分析琥珀酸的产量变化。
1.2.3 基因敲除与菌株构建
采用同源重组技术对FMME-N-2进行基因敲除。采用酶切连接及同源重组方式构建所有载体。为了构建辅因子循环路径,采用PCR 扩增方式克隆PCK和PCK。本研究所用引物如表4所示。

表4 本研究所使用的引物
1.2.4 分析检测方法
(1)细胞浓度测定 取发酵液适当稀释,使用紫外分光光度计在波长600nm的条件下测定OD。大肠杆菌细胞干重(dry cell weight, DCW)=0.41×吸光值×(为样品的稀释倍数),最后计算细胞的生物量。
(2)葡萄糖浓度测定 取发酵液12000r/min离心8min,收集上清液进行适当稀释,使用M-100生物传感器测定葡萄糖浓度(准确测量范围0~2g/L)。
(3)渗透压浓度测定 将发酵液12000r/min离心8min 收集上清液,利用SMC-30D 渗透压仪进行测定。测量范围0~3000mOsmol/L。
(4)辅因子(ATP、NAD和NADH 总量)测定 取不同时间的发酵液,用PBS 溶液洗涤三次,都稀释至OD=1.0 左右,使用ATP 检测试剂盒S0027以及NADH检测试剂盒(WST-8法)进行测定(上海碧云天生物科技有限公司)。
(5)细胞死亡率测定 取1mL发酵液用PBS溶液洗涤2次后,然后用1mL PBS溶液重悬并且稀释至OD=0.6 左右,加入3μL/mL 的碘化丙啶溶液(PI),室温下避光反应15min,用流式细胞仪(BD FACS Aria Ⅲ)进行检测。检测通道:PerCP-Cy5.5(488nm激发激光EL,695/40nm检测滤波器EF)。
(6)有机酸浓度测定 取发酵液12000r/min离心8min,收集上清液,高效液相色谱(HPLC)测定琥珀酸、乳酸、甲酸和乙酸的含量。HPLC检测条件为,色谱分离柱为Aminex HPX-87H(300×7.8mm),流动相为5mmol/L 稀硫酸,柱温52℃,检测器为紫外检测器,进样量10μL,流速0.6mL/min。
2 结果与讨论
2.1 耐高渗突变株的筛选
为了研究出发菌株FMME-N的琥珀酸生产性能,在3.6L发酵罐中进行发酵实验,发现琥珀酸产量为35.6g/L,得率为0.62g/g葡萄糖。同时,发酵液的渗透压增加到1932mOsmol/L,琥珀酸生产强度降低至0.56g/(L·h)(图1)。为了评价渗透压对菌株FMME-N生长能力和生产能力的影响,不同渗透压条件下,测试了细胞生长和琥珀酸生产的情况[ 图 2(a)]。 结 果 表 明, 在 0.9mol/L NaCl(2191mOsmol/L)下,细胞生长受到了显著抑制。在不添加NaCl 的情况下,琥珀酸的最高产量为22.7g/L,随着培养基中渗透压的增加,琥珀酸产量逐渐降低,当添加渗透压为2192mOsmol/L时,琥珀酸产量降至3.1g/L。因此,高渗透压会抑制FMMEN的生长和琥珀酸的合成,提高菌株FMME-N对渗透压的耐受性可能会提高琥珀酸的产量。
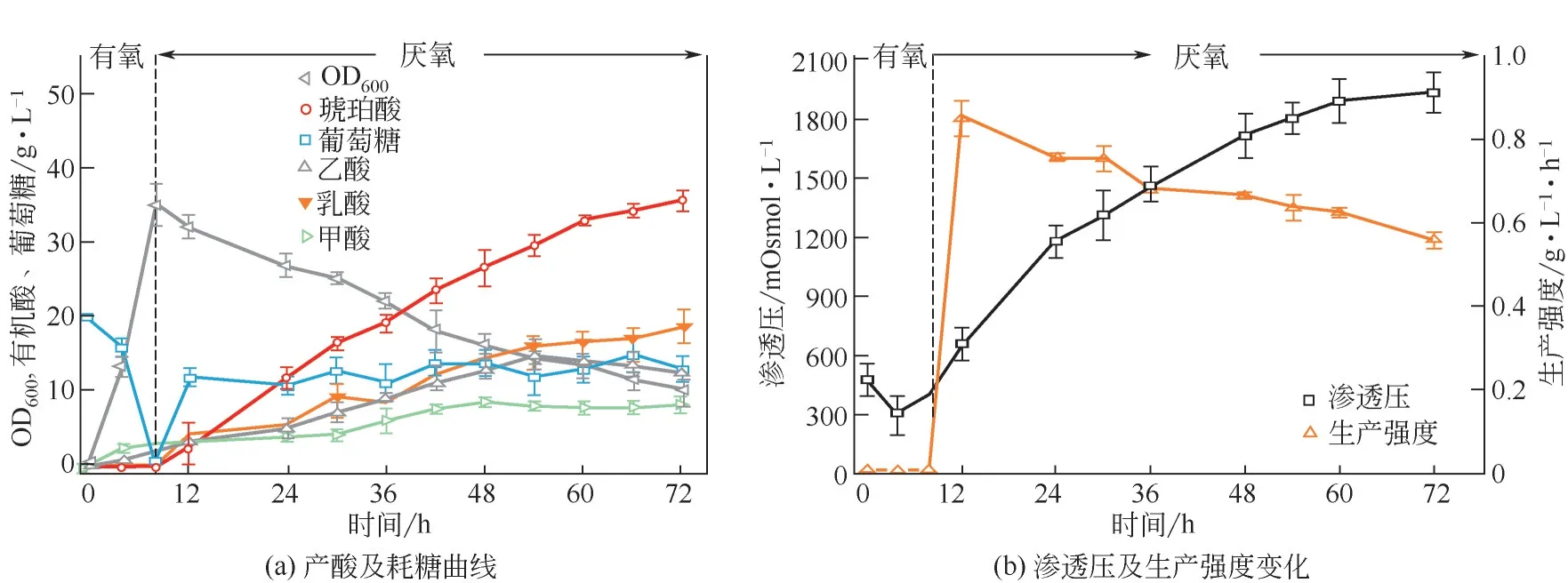
图1 E.coli FMME-N在3.6L发酵罐中的发酵曲线变化
为了提高菌株FMME-N 对渗透压的耐受性,选用ARTP 和Co-γ复合诱变策略进行诱变处理并在含有0.9mol/L NaCl 的平板上筛选(渗透压为2219mOsmol/L)。首先,经过ARTP诱变,从400多个菌落中筛选出40 株值较高的菌株。经发酵验证,突变菌株FMME-N-1 的琥珀酸产量提高至27.3g/L。随后,利用Co-γ 射线对FMME-N-1 处理,从300 多个菌落中选择值较高的27 个菌落。经发酵验证,突变菌株FMME-N-2 可产生32.4g/L琥珀酸,较出发菌株FMME-N 提高了48.6%[图2(b)]。最终,以琥珀酸产量为指标,对菌株FMME-N-2进行4-20代遗传稳定性检验。摇瓶结果显示:菌株FMME-N-2的琥珀酸产量不仅优于出发菌株FMME-N,并且琥珀酸产量变化幅度小(表5),说明菌株FMME-N-2具有良好的遗传稳定性,因此,被选作下一步基因操作的菌株。

表5 FMME-N-2突变株的遗传稳定性
为了验证突变菌株FMME-N-2 的耐高渗透压能力是否提高,从生长、菌体死亡率、细胞形态以及发酵性能4 个方面进行了比较分析。①在不含NaCl时,FMME-N-2的最终细胞浓度(OD=13.5)较 出 发 菌 株FMME-N (OD=12.2) 提 高10.7%[图2(c)];在0.9mol/L NaCl 下,FMME-N 菌株的生物量(OD)下降至1.5,然而菌株FMME-N-2 的生长情况基本保持不变[图2(c)、(d)]。②菌株FMME-N在发酵结束时(渗透压为2232mOsmol/L),约有79.3%的细胞死亡,然而FMME-N-2的死亡率为45.3%[图2(e)]。③发酵结束时,菌株FMME-N-2的细胞表面比FMME-N 更完整[图2(f)]。④菌株FMME-N-2 的生物量、琥珀酸产量、得率和生产强度分别为40.5、51.8g/L、0.70g/g 葡萄糖和0.81g/(L·h),与 菌 株FMME-N 相 比 分 别 提 高 了14.7%、45.5%、12.9%和51.7%[图2(g)]。上述结果表明,增强菌株FMME-N-2 的渗透压耐受性,提高了琥珀酸的产量。
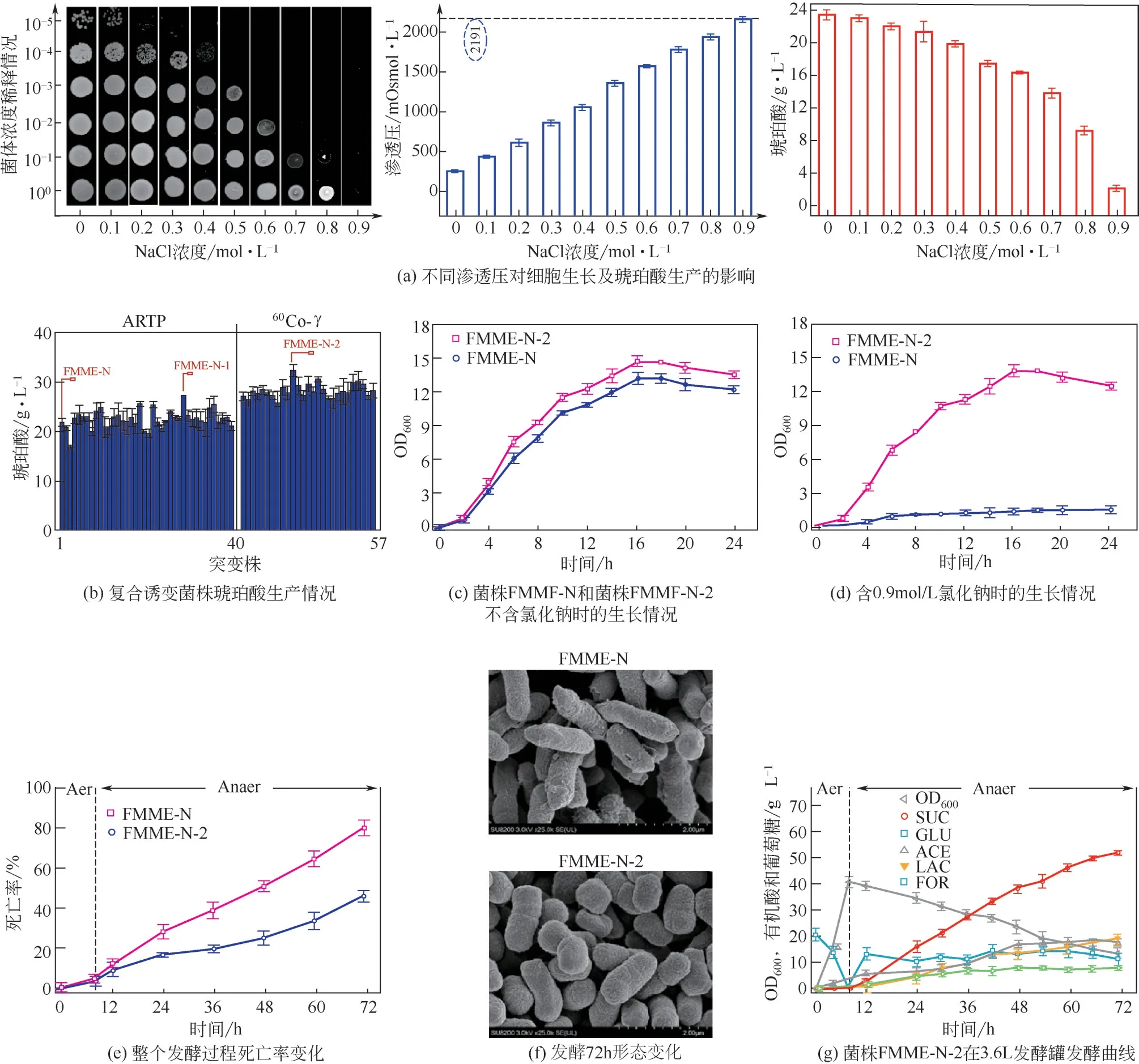
图2 耐高渗琥珀酸生产菌株的筛选与表征
2.2 阻断冗余代谢支路提高琥珀酸得率
在厌氧条件下,葡萄糖经糖酵解途径生成的磷酸烯醇丙酮酸(PEP)是琥珀酸合成的关键节点,PEP不仅能通过r-TCA路径转化为琥珀酸,同时也可以转化为乳酸、甲酸、乙酸和乙醇等副产物[图3(a)]。在研究中发现,菌株FMME-N-2 经72h发酵积累18.8g/L 乳酸、7.6g/L 甲酸和17.3g/L 乙酸[图3(g)],导致琥珀酸得率为0.70g/g 葡萄糖(占琥珀酸理论得率的64.3%)。为了提高琥珀酸得率,单独或组合敲除A、BA、、A基因,获得10 株基因工程菌株[图3(b)]。其中,菌株FMME-N-10(FMME-N-2ΔBAΔAΔ)的生物量降低了14.1%[图3(c)],但琥珀酸产量提高至52.6g/L,得率提高到0.87g/g 葡萄糖。与此同时,乳酸和甲酸的积累量分别降低至1.5g/L和3.4g/L[图3(d)、(e)]。但是,副产物乙酸的浓度增加至18.2g/L[图3(e)]。
为了进一步减少副产物乙酸的积累,敲除乙酸合成路径的相关基因D(编码丙酸激酶)和E(a-酮丁酸甲酸酯裂解酶),构建了菌株FMME-N-13(FMME-N-10ΔDE)。在摇瓶条件下,琥珀酸产量为61.1g/L,乙酸降低了22.1%;在3.6L发酵罐中,发现副产物大大降低,仅有0.6g/L乳酸、3.6g/L甲酸和12.3g/L乙酸积累[图3(f)],而琥珀酸的产量、得率和生产强度分别提高了72.9% (89.6g/L),31.4%(0.92g/g 葡萄糖)和72.8%[1.40g/(L·h)]。上述结果表明,阻断副产物的积累对提高琥珀酸的产量和得率至关重要。

图3 基因敲除菌株的构建与评估
2.3 辅因子工程提高琥珀酸的得率
尽管通过阻断冗余代谢支路提高了琥珀酸得率,但琥珀酸的实际得率(0.92g/g葡萄糖)与琥珀酸理论得率(1.12g/g葡萄糖)相比,仍有很大的提升空间。分析发现,可能是由于:①胞内NADH的缺乏,导致琥珀酸得率低;②胞内能量供应不足,乙酸合成途径与ATP 合成途径偶联,导致乙酸积累。为此,测定了菌株FMME-N-13在发酵过程中胞内ATP、NADH和NADH/NAD的变化情况。结果表明,胞内的ATP、NADH和NADH/NAD含量分别降 低 至1.22μmol/gDCW、20.2μmol/gDCW 和0.23[图4(a)]。
为了增强ATP和NADH的供给,构建了辅因子再生系统,以提高胞内ATP 和NADH 的浓度。在FMME-N-13菌株中单独或组合过表达产琥珀酸放线杆菌的ADP 依赖型PEP 羧激酶(PCK)和博伊丁假丝酵母的NAD依赖型的甲酸脱氢酶(FDH)[图4(b)]。在摇瓶条件下:①过表达PCK,使菌株FMME-N-14 的琥珀酸产量和得率分别提高到67.9g/L 和1.01g/g 葡萄糖,同时胞内ATP的浓度提高至1.53μmol/gDCW,乙酸浓度降低至9.6g/L;②过表达FDH,使菌株FMME-N-15的琥珀酸产量和得率也有所提高,同时胞内NADH的浓度提高了27.0%,且几乎没有甲酸积累;③同时过表达PCK和FDH,使胞内的ATP和NADH浓度均有所提高,但是琥珀酸的产量和得率都没有明显提高,可能是菌株FMME-N-16 中NADH/NAD过高(0.47),导致氧化还原失衡限制了菌株代谢和琥珀酸生产[图4(d)、(e)、(f)]。
为了进一步提高琥珀酸的产量和得率,以绿色荧光蛋白为报告基因,将RBS10、RBS09和RBS03分为高、中和低三个水平。借助不同的RBS 将PCK 和FDH 表达水平控制在高(H)、中(M)和低(L)三个水平,构建了9 株基因工程菌[图4(c)]。经发酵测试,当PCK 和FDH 都低水平表达 时,菌 株FMME-N-24 (L-PCK-L-FDH)能获得最高的琥珀酸产量(74.2g/L),得率为1.04g/g葡萄糖,较出发菌株FMME-N-13分别提高了21.4%和13.0%[图4(d)]。同时,胞内的ATP、NADH 和NADH/NAD分别提高了26.4%、49.2%和47.8%[图4(f)]。此外,乙酸浓度降低至8.4g/L,且几乎没有乳酸和甲酸积累[图4(e)]。为了提高重组菌株在工业发酵中的稳定性,通过同源重组将片段L-PCK-L-FDH 整 合 至 菌 株FMME-N-13 基 因组的PCK 基因处,构建菌株FMME-N-26。最终,菌株FMME-N-26的琥珀酸产量为73.9g/L,得率为1.04g/g 葡萄糖。上述结果表明,优化PCK和FDH 的表达能提高胞内辅因子的供应量,进而提高琥珀酸产量。

图4 调控AsPCK与CbFDH的表达优化辅因子含量
2.4 发酵条件优化提高琥珀酸的产量
为了验证最优菌株FMME-N-26 的生产潜力,在3.6L发酵罐中发酵72h,琥珀酸产量为101.4g/L,得率和生产强度分别为1.05g/g葡萄糖和1.58g/(L·h)。与菌株FMME-N-13 相比分别提高了13.2%、14.1%和12.9%。但是,仍然有5.5g/L 乙酸积累[图5(a)、(e)]。
为了进一步降低乙酸的浓度,利用限制性补糖策略对发酵液中葡萄糖浓度进行了控制与优化。结果表明:①副产物乙酸浓度随着葡萄糖浓度的增加而增加,当发酵液中葡萄糖浓度从10~15g/L 增加到20g/L时,乙酸浓度从5.5g/L增加到9.7g/L,琥珀酸得率降低至0.98g/g 葡萄糖[图5(b)、(d)、(e)];②通过恒pH策略控制发酵液的葡萄糖浓度处于0,虽然乙酸浓度降低至2.4g/L,但是琥珀酸产量也降低至92.1g/L[图5(b)、(d)、(e)],说明较低的葡萄糖浓度不能满足细胞的代谢需求;③通过自动补料将厌氧阶段发酵液葡萄糖浓度维持在0~5g/L,使琥珀酸的产量、产率和生产强度分别达到112.5g/L、1.11g/g葡萄糖和1.76g/(L·h),相较于控制发酵液葡萄糖浓度10~15g/L 分别提高了10.9%、5.7%和11.4%。同时,副产物乙酸浓度降低至2.8g/L[图5(b)、(d)、(e)]。最后,在最优发酵条件下,放大至30L发酵罐进行琥珀酸生产,最终琥珀酸的浓度、得率和生产强度分别为111.9g/L、1.11g/g葡萄糖和1.75g/(L·h),副产物乙酸降低至1.6g/L,同时几乎没有甲酸或乳酸积累[图5(c)、(e)]。上述结果表明,通过发酵条件优化,有助于降低乙酸的积累,进而提高琥珀酸的产量和得率,同时减少琥珀酸下游分离提取成本,具有良好的工业化潜力。

图5 菌株FMME-N-26的两阶段发酵结果
3 结论
(1)筛选具有耐高渗的工程菌株有助于增强微生物细胞工厂的鲁棒性,提高琥珀酸的产量。在有机酸发酵过程中,需要添加碱性物质维持发酵液的pH 在最适范围内。但是,添加的碱性物质以及积累的产物会导致发酵液的渗透压不断升高,导致大肠杆菌活力下降甚至死亡,影响琥珀酸生产效率。为了获得能耐受高渗透压的菌株,发展了多种代谢工程策略:①反向代谢工程结合适应性进化;②添加渗透压保护剂,如甜菜碱、海藻糖和含硫氨基酸;③对全局转录因子进行突变;④诱变策略等。例如,在初始高葡萄糖浓度(120g/L)所引起的高渗透条件下,外源添加渗透压保护剂半胱氨酸可使细胞生长速度提高56%,琥珀酸产量提高了102%。本文采用ARTP和Co-γ 射线复合诱变策略筛选得到一株耐0.9mol/L NaCl 菌株,琥珀酸产量提高了45.5%达到51.8g/L,该策略改变了菌体的基因特性不需要外源添加抗生素等物质降低了生产成本。
(2)副产物会竞争琥珀酸合成路径的碳流,降低琥珀酸得率。阻断副产物积累的方法主要是敲除副产物路径的基因,这一方法已成功用于大肠杆菌()、酿 酒 酵 母()、谷 氨 酸棒杆菌()和产琥珀酸厌氧螺菌()等。然而,基因敲除可能会降低细胞的生长速率或改变胞内的NADH/NAD值。例如,敲除A 和B 基因后,胞内NADH/NAD比率升高,造成氧化还原失衡,菌株NZN111(A、B)失去了厌氧条件下代谢葡萄糖的能力。为此,常常要结合适应性进化提高菌株生长速度,例如,KJ060 结合代谢进化,使菌体浓度升高(OD值从0 提高到5),琥珀酸产量提高至86.5g/L。在本研究中,通过调控PCK 和FDH 的表达水平使NADH/NAD比率维持在一个相对稳定的状态,与其他单独调节氧化还原电位或能量平衡的策略相比,具有两点优势:①能同时提高胞内ATP和NADH的含量;②通过优化PCK 和FDH 的表达,有助于促进细胞生长(ATP 供应的增加)和琥珀酸的合成(NADH 供应的增加)。
(3)通过优化发酵条件,进一步提高了琥珀酸的生产性能。经30L 发酵罐的生产,最优菌株FMME-N-26 能产生111.9g/L 琥珀酸,得率为1.11g/g 葡萄糖。本研究为琥珀酸的工业化生产奠定了良好的基础,对开发用于生产精细化学品的高性能大肠杆菌系细胞工厂具有重要的借鉴意义。
