多层纳米结构蓝色TiO2的电化学氧化性能和稳定性
2022-03-09戴绍铃于桢李逸航成少安
戴绍铃,于桢,李逸航,成少安
(浙江大学能源工程学院,能源清洁利用国家重点实验室,浙江 杭州 310027)
随着全球工业和城市的飞速发展,工业废水和生活污水中大量的难降解有机污染物的处理成为了亟待解决的难题。电化学高级氧化技术(EAOP)是处理这部分污染物最具前景的技术,具有能产生强氧化性自由基、易于操控、效率高、无二次污染等优点。阳极是产生自由基的主要场所,其电氧化性能和使用寿命直接决定EAOP的处理效率和稳定性。目前已发展的阳极材料主要有掺硼金刚石(BDD)阳极和金属氧化物(DSA)电极等。BDD电极具有优异的电氧化性能,但其制备条件苛刻、能耗高、成本高昂,目前难以大规模制备。DSA电极主要有活性阳极(IrO,RuO)和非活性阳极(PbO,SnO)。活性阳极需要使用昂贵的金属,析氧电位(OEP)低,产生自由基的能力较弱。非活性阳极析氧电位高,具有很强的产生羟基自由基的能力,是理想的EAOP电极材料。然而,PbO电极析出有毒金属,SnO电极寿命较短的问题尚未得到有效解决。近年来,还原态的TiO作为一种新型的非活性电极引起了研究者的广泛关注。这类电极具有良好的导电性和较高的析氧电位,表现出出色的电催化活性,可与市售的BDD 阳极和DSA 电极相媲美。由于普通TiO导电性差,在普通TiO作为阳极时,电解池电压会快速升到150V 以上而不能正常工作;蓝色TiO具有良好的导电性,可在电解池电压为5~7V时稳定产生高氧化性物质。因此,还原态蓝色TiO可发挥TiO材料在电化学应用上的潜力。在电化学氧化过程中,还原态TiO能生成大量的物理吸附的OH。当有机污染物吸附在电极表面并与OH反应时,生成的中间体立即占据活性位点,并继续被氧化,可防止废水处理过程中产生有毒副产物。除了具有出色的电催化活性,还原态的TiO制备过程简单,不引入外来杂质,且可通过还原而再生,被认为是一种潜在的具有经济价值的阳极材料。
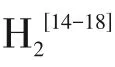
但目前,不管是黑色TiO还是蓝色TiO,都存在作为电催化电极寿命短的问题。虽然蓝色TiO失活后很方便通过电化学还原而再生,但蓝色TiO仍然面临纳米管易剥落、自掺杂程度低等问题。为了增强蓝色TiO电极的稳定性,研究者尝试了一些策略,例如:①使用表面张力小的乙醇进行清洗以减少裂纹;②通过二次阳极氧化加强纳米管的机械稳定性;③采用喷雾热分解法在纳米管的顶部形成保护层,防止阴极掺杂过程中电荷在管尖端泄漏。但这些二次处理措施不仅难以控制,而且对提高蓝色TiO电极的稳定性也作用有限。蓝色TiO电极的稳定性与原始TiO的结构有关,通过调控和掺杂改变原始TiO的结构可能是提高蓝色TiO稳定性的有效方法。有研究通过调控阳极氧化过程的电压、时间、电解质成分等参数改变TiO纳米管的孔径、壁厚和长度,以加强TiO的结构稳定性和自掺杂程度。而Ti 阳极氧化过程中电解质的温度也是影响TiO纳米结构的重要因素。Mao 等研究发现TiO纳米管的壁厚和长度随电解质的温度降低(50℃降至5℃)而增加。随后,Wang 和Lin发现冰水浴阳极氧化可获得管径小的TiO纳米管阵列。然而,通过调控阳极氧化过程电解质的温度制备特定结构的TiO,影响后续制备的蓝色TiO的稳定性,目前还鲜有报道。此外,研究发现采用一步阳极氧化法制备的TiO纳米管阵列的顶部通常沉积有大面积的氧化物污垢(较大的TiO颗粒或者氧化物污染层),会直接影响后续的阴极极化过程。但从另一角度来看,如果选择合适的钛基底厚度和电解液温度,使块状物呈纳米颗粒或者氧化物污染层变为疏松的多孔层结构,均匀分布在TiO纳米管表面,这种结构可能防止阴极极化过程中纳米管顶部的电荷泄漏,从而提高蓝色TiO的自掺杂度和稳定性。
本文采用阳极氧化法,通过冰水浴辅助将电解液的温度降低至0℃,控制TiO颗粒、氧化物污染层和纳米管阵列的生长,从而形成一种新型的TiO多层纳米结构,并采用电化学还原法在TiO中引入Ti缺陷得到多层纳米结构的蓝色TiO,研究蓝色TiO作为阳极降解亚甲基蓝(MB)和去除实际废水COD 的性能和稳定性,分析各种因素影响下羟基自由基和硫酸根自由基对降解MB的贡献,以期改善常温制备时常见的氧化物污垢堵塞表面的问题,为提高蓝色TiO的电化学氧化性能和稳定性提供新的思路和方法。
1 实验
1.1 药品
实验中使用的丙酮、乙醇、乙二醇、甲酸、NaSO、NaNO、NaOH、HSO、MeOH 均来自国药集团化学试剂有限公司,所有药品均为分析纯。NaClO(99%)和TBA(叔丁醇,≥99.5%,色谱纯)来自阿拉丁试剂(上海)有限公司,使用前未进行纯化。
1.2 电极的制备
首先用400 目砂纸抛光钛片(20mm×20mm×1mm,Ti 99.9%),再依次用丙酮、乙醇和去离子水超声处理10min。然后将干燥后的钛片作为阳极,Pt片作为阴极,间距2cm,并将电解池浸没于放有冰袋的水浴锅中(若为非冰水浴阳极氧化,则将电解池置于室温环境)。在100mL 乙二醇溶液[2%(质量分数)HO,0.25%(质量分数)NHF]中,以45V 恒电压将钛片氧化4h,制得多层纳米结构TiO电极。氧化反应结束后,用去离子水清洗电极,并在30℃下烘干。烘干后的电极在450℃下灼烧2h。之后,将多层纳米结构TiO电极作为阴极,Pt片作为阳极,在10%(体积分数)甲酸溶液中,以恒电流20mA/cm还原5min,制得蓝色TiO电极。
1.3 物理化学表征
通过扫描电子显微镜(SEM,SU-8010,Japan)表征电极的形貌,X 射线衍射仪(XRD,X-pert Power XPAN alytical B.V.)分析电极的晶体结构。使用X 射线光电子能谱仪(XPS,Escalab 250XI)分析电极表面元素的价态,参照不定碳的C 1s峰(284.8eV)校正测得的结合能。
采用三电极模式,蓝色TiO电极作为工作电极,Pt片作为对电极,Ag/AgCl电极作为参比电极,在电化学工作站(Biologic,VMP3,France)进行电化学测试。循环伏安(CV)测试在0.50mol/L NaSO溶液中进行,扫描速率分别为5mV/s、10mV/s、20mV/s、50mV/s、100mV/s,电位范围为0.6~0.8V(.Ag/AgCl)。线性扫描伏安(LSV)测试在0.50mol/L NaSO溶液中进行,扫描速率为50mV/s。电化学阻抗谱(EIS) 测试在1mol/L NaSO溶液中进行,AC 电位为10mV,DC 电位相对于开路电位为0,频率范围为1MHz~0.01Hz。加速寿命测试在1mol/L NaClO溶液中进行,直流电源(Agilent,U8001A)提供20mA/cm和100mA/cm的恒定电流,水浴保持温度在(26±2)℃,由数据采集仪(Agilent,34970A)每隔5min采集数据。
1.4 电化学氧化性能试验
通过降解MB(100mg/L)和实际废水评估蓝色TiO的电化学氧化能力。无特殊说明,降解实验条件均为100mL溶液,以0.25mol/L NaSO溶液作为支持电解质,蓝色TiO电极作为阳极,Pt片电极作为阴极,电极间距2cm,磁力搅拌转速250r/min,在20mA/cm的恒定电流下电解2h,每隔30min 采集1.5mL样品。在测试不同浓度NaSO对降解的影响时,通过加入NaNO使溶液的电导率相近。在进行淬灭自由基实验时,使用NaOH(1mol/L)和HSO(2mol/L) 调 整 初 始pH (3~11), 使 用MeOH(5mol/L)和TBA(0.01mol/L)作为自由基淬灭剂,取样1.5mL 进行分析。溶液的pH 和电导率分别由pH 计(FG20,Mettler-Toledo,Switzerland)和离子电导率仪(FG3,Mettler-Toledo,Switzerland)进行测试。
1.5 分析方法
1.5.1 电化学活性面积测试
用CV 法计算出蓝色TiO的双电层电容,进而评估其电化学活性面积。根据双电层充放电与CV 扫描速率的相关性,测量非法拉第电流以确定双电层电容。如式(1)所示。

式中,为扫描速率,mV/s;为非法拉第电流,mA/cm;为双电层电容,mF/cm。
催化表面的双电层电容与理想光滑表面的双电层电容的比值即为电化学活性面积,由式(2)计算。

式中,ECSA 为电化学活性面积(相对比值);为光滑TiO的双电层电容,mF/cm。然而,理想光滑的TiO的没有统一的标准值,很难直接求解出ECSA。由于两种样品都是蓝色TiO,测试条件也一样,那么就相同。因此,直接比较两者的即可比较出ECSA的相对大小。
1.5.2 电化学脱色测试
使用UV-vis 分光光度法(HACH,DR 2800,美国)在664nm的特征波长下测定MB溶液的吸光度。脱色效率根据式(3)算出。

式中,和C分别是初始时间和给定时间时MB溶液的吸光度。
MB 脱色的动力学使用准一阶模型拟合,如式(4)所示。

式中,是动力学速率常数,min;是电解时间,min。
由于测试条件不同,很难直接比较不同研究中电极的脱色性能。本文通过式(5)计算。
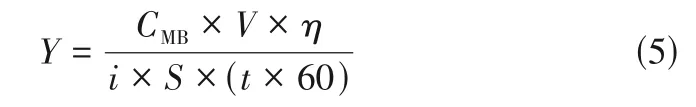
式中,是单位库仑的脱色量,mg/C;是MB 的初始浓度,mg/L;是溶液的体积,L;是电流密度,A/cm;是电极面积,cm;是电解时间,min。
1.5.3 自由基淬灭实验
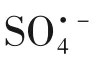
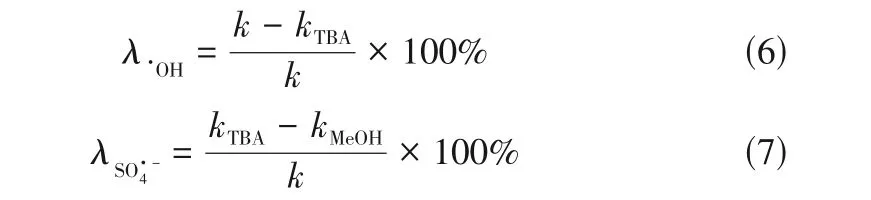
式中,为不添加淬灭剂的MB降解速率常数,min;为添加TBA 后的速率常数,min;为添加MeOH后的速率常数,min。
1.5.4 COD和能耗分析
通过重铬酸盐消解法(HACH Method 8000)测得化学需氧量(COD)。COD 去除率由式(8)计算得到。

式中,COD和COD分别为COD的初始浓度和反应时间对应的浓度,mg/L。
平均电流效率ACE由式(9)计算得出。
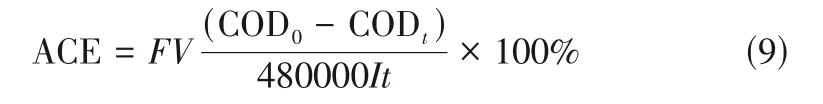
式中,为电流,A;为法拉第常数,96487C/mol;为时间,min;为电解液体积,L。
能耗(kW·h/kg COD)由式(10)计算得到。
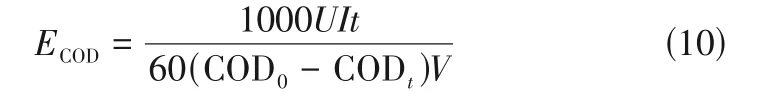
式中,为电解池的槽电压,V;为电流,A;为反应时间,min;为电解液的体积,L。
2 结果与讨论
2.1 形貌与结构
如图1(a)所示,经抛光和超声处理后的钛片,表面光滑,无任何杂质。在图1(b)中,经过冰水浴阳极氧化之后,大量的纳米颗粒均匀地覆盖在多孔结构上,这些颗粒边长约为75nm,颗粒下方的多孔结构的孔径约为10nm。图1(c)是无冰水浴阳极氧化制备的TiO,分布在表面的纳米颗粒比图1(b)中的稍大,粒径约为100nm,下方的纳米孔直径约为50nm,但基本被密封住。从图1(d)可以清楚地观察到,TiO多孔结构下方是纳米管阵列,管内径约为25nm。在图1(e)中,TiO纳米管的内径约为50nm,与图1(c)显示出的管内径很吻合。与图1(b)相比,图1(f)中电极的表面形貌并无明显差异;同样地,图1(g)中的形貌相对图1(c)也基本无变化,表明电化学还原对表面的纳米结构几乎没有影响。

图1 SEM图像
通常由一步阳极氧化法得到的TiO纳米管阵列的顶部会积聚大片的氧化物污垢,而冰水浴将阳极氧化过程的温度维持在0℃,改善了这种不良的形貌,制备出多层的纳米结构。这种多层的纳米结构由三部分组成,从上往下依次为纳米颗粒、多孔层、纳米管阵列。无冰水浴制备的TiO具有较大的纳米颗粒,氧化物污染层没有转变成中间多孔层,底部纳米管的内径较大且被表面氧化物密封。两种TiO上部都有纳米颗粒,但粒径不同,很可能是钛基底的厚度和电解液温度共同影响了阳极氧化过程。使用较薄的钛箔,有利于表面氧化和溶解达到平衡;钛基底太厚,则化学溶解起主要作用,倾向于形成纳米颗粒。再加上冰水浴的温度较低,溶解和形核作用被削弱,则形成尺寸稍小的纳米颗粒。对于纳米颗粒下的多孔层和纳米管阵列,可以依据“两电流模型”和“氧气气泡模具效应”进行解释。离子电流导致氧化物的生长,电子电流导致氧气的析出,“氧气气泡模具”决定圆柱形孔道的形成,氧化物围绕“气泡模具”黏性流动导致孔壁的“自下向上”生长。在阳极氧化过程中,靠近电解液界面的氧化物被阴离子(F、O和OH等)嵌入,形成氧化物污染层。对于无冰水浴阳极氧化,电解液温度过高,阴离子嵌入氧化膜的程度更大,污染层的厚度迅速增加;同时氧化物阻挡层的厚度也在增加,离子电流小,电子电流大,氧气在污染层与阻挡层界面的析出变得容易。当污染层被冲破后,电解液渗入纳米管中,孔底部的阻挡层围绕各自孔底部的“气泡模具”向上方流动。无冰水浴制备的TiO纳米管顶部的孔径更大,但也因此存在污染层过厚的可能性。氧化反应结束后,污染层极易滞留在纳米管上部,将孔道口封闭,从而形成密封的形貌。反之,在冰水浴阳极氧化过程中,由于污染层厚度较薄,不易引起密封,最终形成的多孔层和纳米管的孔径都较小。
此外,还可以用阳极氧化过程的三个阶段的电流变化加以解释。在第Ⅰ阶段(前10s 内),电流密度由30mA/cm快速降至15mA/cm,这是由于氧化膜厚度增加,使总电流下降,此阶段氧化膜生长的主要驱动力是离子传导。在第Ⅱ阶段,当氧化膜厚度达到临界厚度时,氧化膜的生长速率明显降低,污染层的厚度快速增加,电子电导变成主要的导电方式,总电流开始增加。对于无冰水浴的制备过程,电解质温度升至60℃左右,总电流约为25mA/cm;但对于冰水浴过程,电解质温度始终较低,总电流长时间保持下降,最后上升至9mA/cm左右。在第Ⅲ阶段,电解液进入所有纳米管中,氧化物的生长集中在纳米管底部,电解质温度和电流密度基本保持不变。
2.2 晶相与Ti3+含量
由图2(a)可知在制备过程中电极晶相的变化。除了来自Ti基的峰(标有星号),TiO和蓝色TiO在25.4°、48.1°、54.0°、55.1°处的四个衍射峰,分别对应于锐钛矿型TiO的(101)、(200)、(105)、(211)晶面。TiO和蓝色TiO的XRD谱图几乎相同,表明电化学还原对晶体结构影响极小。如图2(b)、(c)所示,TiO中的两个Ti峰分别为455.2eV(Ti2p)和461.1eV(Ti2p),另外两个能量较低的峰出现在454.2eV(Ti2p)和460.1eV(Ti2p)。冰水浴制备的蓝色TiO中Ti的含量为64.3%,无冰水浴制备的有53.2%,由此可见,冰水浴阳极氧化制备的多层纳米结构能促进后续的阴极还原。均匀分布的纳米颗粒既增大了比表面积,也能使底部的纳米孔结构暴露并被还原,可防止阴极掺杂过程中尖端的电荷泄漏。更多的电子被引导至孔壁,而不是在顶部被质子还原所消耗,这会使电化学自掺杂更加显著。相反,无冰水浴制备的电极具有较大的TiO颗粒和密封的纳米管,不仅会增大电子传输阻力,还会阻止底部结构的H插层。正是由于只有表面极薄的一层TiO被还原,光滑表面的蓝色TiO具有很低的Ti含量和电催化活性。此前有研究称,在10%(体积分数)甲酸中阴极极化后,样品中检测到的Ti含量估计为82.3%,而未还原的TiO中为22.2%。但也有研究称制备的蓝色TiO只含有极少量的Ti,或者没有观察到任何Ti峰。推测原因可能是:第一,Ti含量可能因钛片厚度、电解质、电流密度、还原时间而异;第二,靠近TiO表面只有部分Ti被转化为Ti。

图2 蓝色TiO2的XRD和XPS图
2.3 电化学性能表征
如图3(a)所示,两种蓝色TiO的析氧电位大致都为2.5V(.Ag/AgCl),与TiO的析氧电位无异。冰水浴阳极氧化制备的蓝色TiO在析氧电位处的电流密度为7.5mA/cm,而无冰水浴制备的电流密度为4mA/cm,说明前者的电化学活性更高。图3(b)中的插图为EIS拟合的等效电路模型。和分别表示溶液电阻和电荷转移电阻。有、无冰水浴制备的电极分别为27.36Ω和100.00Ω,表明冰水浴阳极氧化制备的蓝色TiO的电子传输阻力更小。这种优异的电子传输能力归因于通过冰水浴获得的多层纳米结构,使蓝色TiO具有更多的Ti-OV 充当电子供体。由式(1)可知,图3(c)、(d)中直线的斜率为双电层电容,即有、无冰水浴制备的蓝色TiO电极的分别为9.15mF/cm和5.53mF/cm,通过式(2)计算得出,前者的ECSA 是后者的1.7 倍,表明通过冰水浴阳极氧化得到的纳米结构能增加蓝色TiO的电化学活性面积。目前被广泛研究的一维的纳米管阵列虽然能降低电子传输阻力,但比表面积不足,相邻的纳米管之间存在相当大的自由空间。针对这一不足,许多研究用大量纳米粒子进行修饰,形成多层的纳米结构,以提供非常大的比表面积。冰水浴阳极氧化制备的具有多层纳米结构的蓝色TiO展示出出色的电子传输能力和非常大的电化学活性面积,是一种较有吸引力的阳极材料。
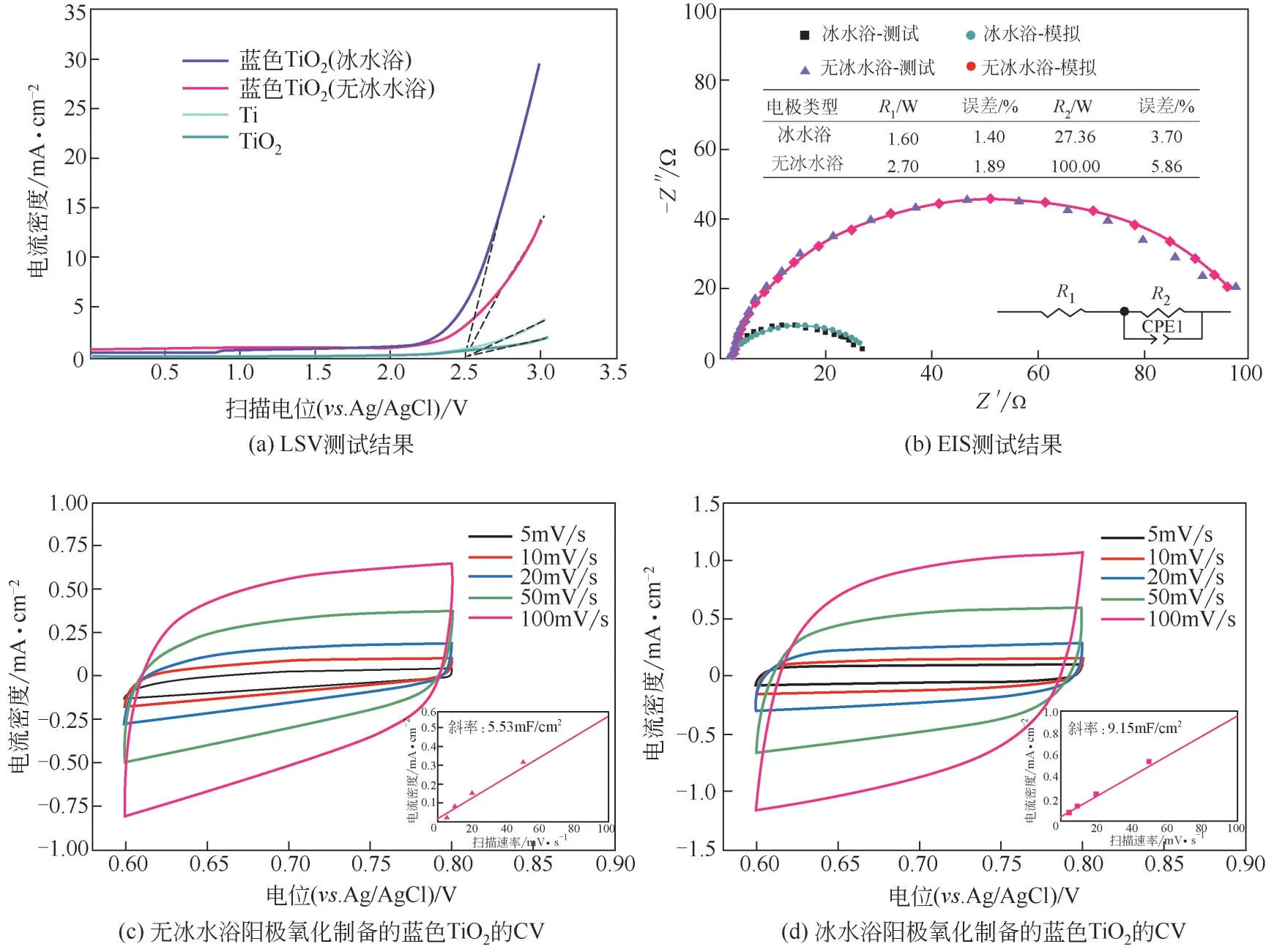
图3 电化学性能表征结果
2.4 电化学降解测试
如图4 所示,经过90min 的电化学降解,冰水浴阳极氧化制备的蓝色TiO对MB 的降解率为96.7%,而无冰水浴制备的蓝色TiO在2h 降解了83.0%。对比表1 中的其他阳极,通过式(5)计算得到蓝色TiO的(mg/C),分别是Ti/SnO-Sb(直流电沉积)、Ti/SnO-Sb(溶胶-凝胶法)、Ti/SnO-Sb-Ce的2.9倍、5.0倍、3.4倍,表明与其他钛基电极相比,蓝色TiO具有优异的电化学降解性能。可以合理地推测,蓝色TiO高效的电氧化性能得益于冰水浴阳极氧化制备的新型纳米结构引入了更多Ti缺陷。
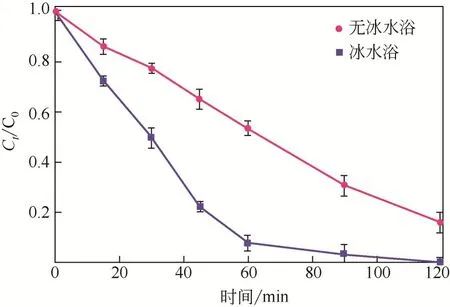
图4 蓝色TiO2电极在0.50mol/L Na2SO4溶液中电化学降解MB曲线
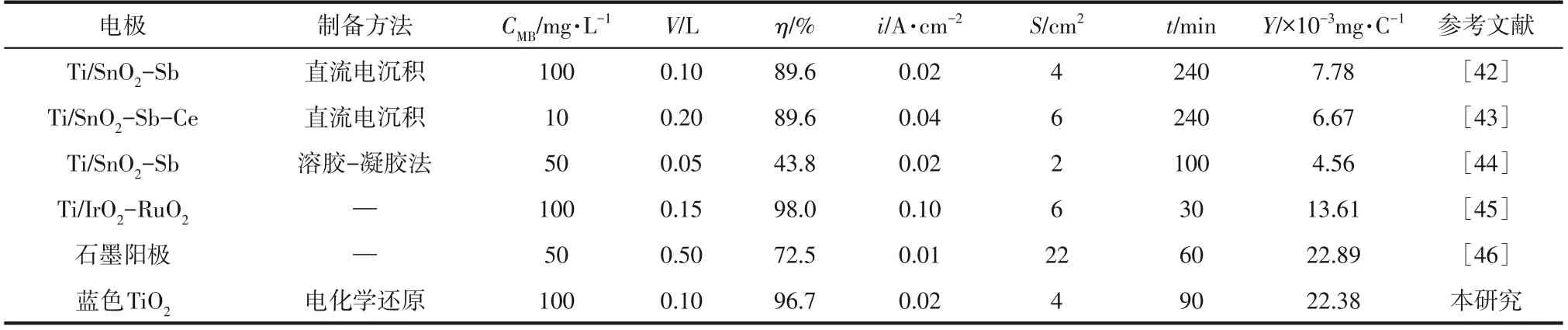
表1 不同电极电化学降解MB的性能比较
2.5 影响蓝色TiO2电化学降解MB的因素
如图5(a)所示,蓝色TiO电极在5mA/cm、10mA/cm、20mA/cm、30mA/cm的恒定电流密度下降解MB溶液(100mg/L)。当电流密度为30mA/cm时,1h的脱色率达到97.7%;当电流密度为20mA/cm,2h的脱色率达到97.4%,表明较高的电流密度有利于蓝色TiO电极产生氧化性自由基。在图5(b)中,随着MB 的初始浓度升高,蓝色TiO对MB 的脱色速率明显下降。例如,蓝色TiO可在1h 内将25mg/L MB 降解为无色,而对于100mg/L MB 则至少需要2h,这可以用电化学中的扩散控制过程来解释。如图5(c)所示,初始pH=5 时降解率最高,中性和过于碱性则降解性能下降,可推测蓝色TiO适用于弱酸性环境。图5(d)表明,高浓度的NaSO可显著提高MB的去除率。1h时含0.50mol/L NaSO的MB 溶液的脱色率几乎是0.10mol/L NaSO的两倍。由于在不同浓度NaSO溶液中加入惰性电解质NaNO排除了电导率的影响,初步推测,蓝色TiO活化硫酸盐生成了硫酸根自由基。
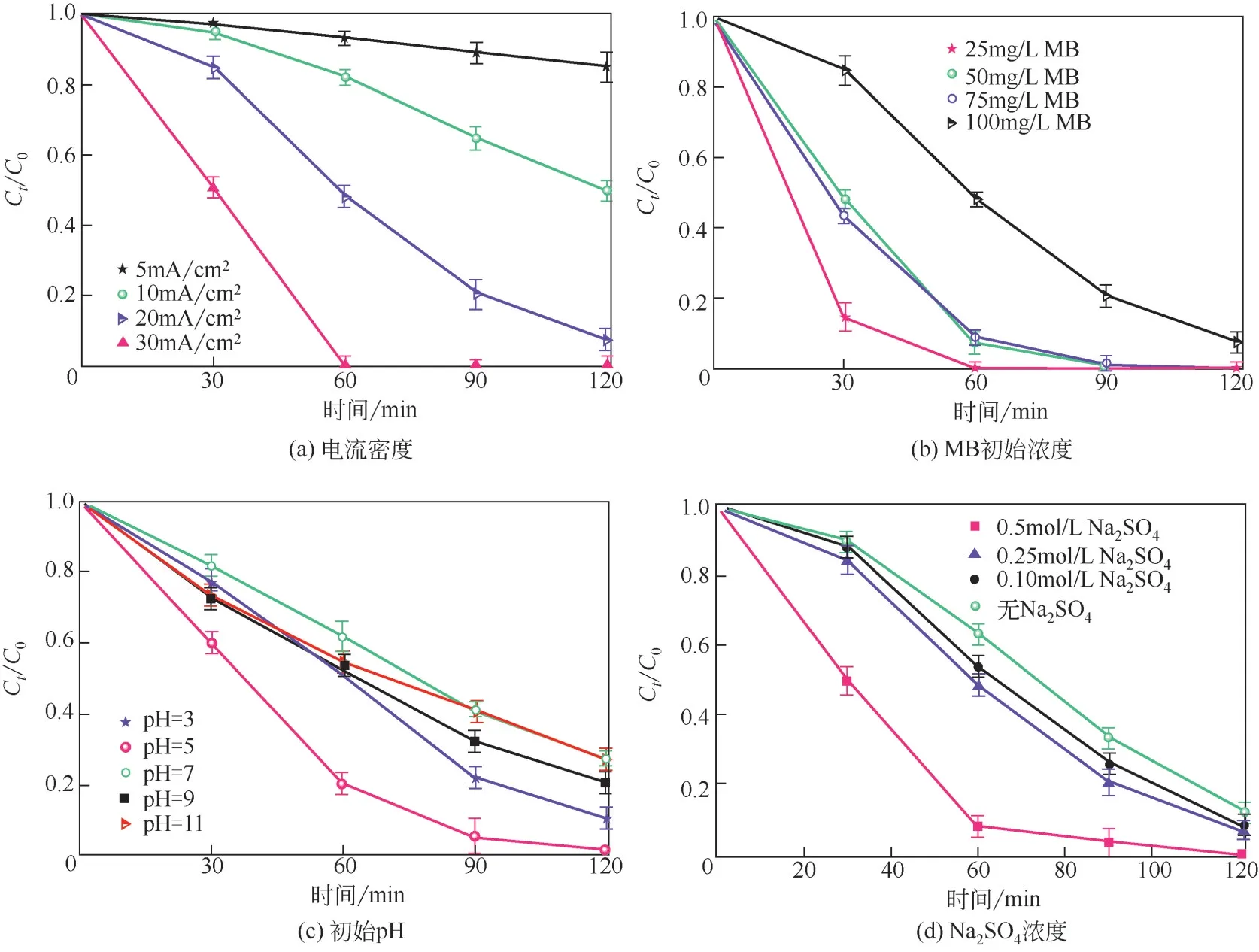
图5 蓝色TiO2在不同条件下电化学降解MB Ct/C0随时间变化的曲线
2.6 降解MB的机理
蓝色TiO能产生大量的羟基自由基(OH)和部分硫酸根自由基(SO)。MeOH 是SO和OH的淬灭剂,TBA仅淬灭OH。由式(6)和式(7)计算并得出图6,分析在蓝色TiO上产生的OH 和SO对降解MB的贡献。
2.6.1 NaSO浓度
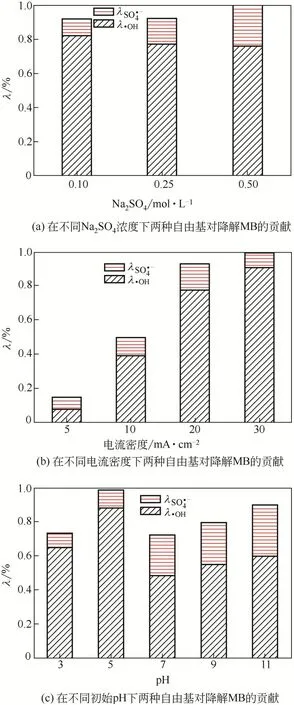
图6 蓝色TiO2在不同影响因素下产生的•OH和SO对降解MB的贡献
2.6.2 电流密度
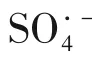
2.6.3 初始pH
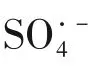

因此,在初始pH=5 时,电极对MB 的降解率最高,当初始pH在7~11时,降解率反而下降。
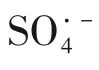
2.7 电极稳定性
在进行加速寿命测试时,蓝色TiO中的Ti被逐渐氧化成Ti,导致电阻增大。当槽电压升至10V时,可认为阳极已失活。如图7所示,槽电压在4~7V 之间缓慢增加,7~10V 之间快速增加。当电流密度为20mA/cm时,冰水浴阳极氧化制备的蓝色TiO电极的寿命为990min,无冰水浴制备的为410min。当电流密度为100mA/cm时,冰水浴制备的电极寿命为127min,无冰水浴制备的电极寿命为90min。Cai等制备的蓝色TiO纳米管阵列在20mA/cm时 寿 命 为105min,100mA/cm时 寿 命 为20min。Yang 等在纳米管顶部沉积一层TiO后,测定该电极在20mA/cm时寿命为420min。由此可知,冰水浴阳极氧化制备的蓝色TiO具有较长的使用寿命。
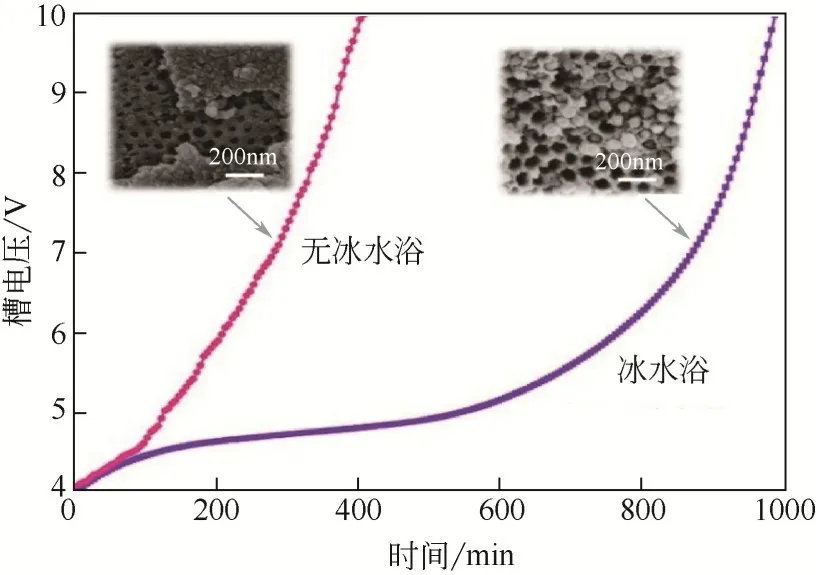
图7 蓝色TiO2的加速寿命测试
如图7插图所示,经过加速寿命测试后,两种方式制备出的蓝色TiO的表面都发生了明显变化。冰水浴制备的蓝色TiO部分区域形成类似马蜂窝的结构,圆孔的直径约为100nm。失活后的电极仍有大面积完整结构,可以假设,再次煅烧和还原会使电极恢复活性。而对于非冰水浴制备的蓝色TiO,表面的纳米颗粒大面积板结,基本遮挡了底部的结构,尽管有部分纳米管阵列暴露,但由于Ti-OV基本存在于表面颗粒层,电极被氧化的速率不会减慢,表现为槽电压很快上升至10V。同样是未掺杂异相元素的蓝色TiO,冰水浴阳极氧化制备的蓝色TiO具有更长的使用寿命,可能是这种多层纳米结构不仅能掺入更多Ti-OV,还能长时间维持表面形貌,从而降低蓝色TiO中Ti-OV被氧化的速度,这为提高这类电极的稳定性提供了新思路。
2.8 降解实际废水
通过降解实际印染废水(杭州萧山污水处理有限公司)的COD,评估冰水浴阳极氧化制备的蓝色TiO处理实际废水的能力。如图8所示,冰水浴制备的蓝色TiO将150mg/L COD完全降解,能耗不到10kW·h/m,在同样的时间里,无冰水浴制备的蓝色TiO降解了132mg/L COD,能耗为12kW·h/m。由式(9)和式(10)计算蓝色TiO电极降解过程中的ACE 和。在降解90min 后,废水由深褐色变为无 色, COD 从150mg/L 降 至48mg/L, ACE 为28.5%,为53kW·h/kg COD。在180min 时,COD 已被完全去除,此时ACE 为21.6%,为70kW·h/kg COD。Yang 等使用掺Co 的蓝色TiO,以较低的COD能耗(62kW·h/kg COD)将人类废水降解为可回用的非饮用水,被认为是去除实际废水中有机污染物的有效阳极。因此,冰水浴阳极氧化制备的蓝色TiO具有潜在的实际应用价值。
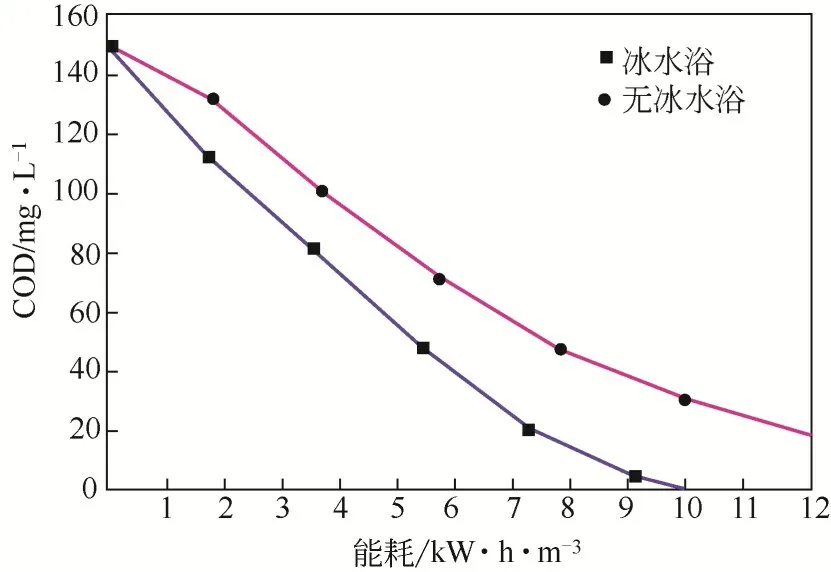
图8 蓝色TiO2降解实际废水的COD能耗
3 结论
(1)冰水浴阳极氧化法可将常温制备时常见的氧化物污染层转化成纳米多孔层,并减小TiO颗粒的粒径和纳米管阵列的内径,从而形成纳米颗粒、多孔层、纳米管阵列依次堆叠的多层纳米结构,通过阴极还原可获得结构不变的蓝色TiO。
(2)冰水浴阳极氧化制备的蓝色TiO具备出色的电化学氧化性能,相比于无冰水浴法,该方法制备的蓝色TiO含有更多的Ti(约64.3%)和更大的活性面积,内阻约为前者的1/4,析氧电位约为2.5V(.Ag/AgCl),更能有效地降解MB(97.7%,120min,20mA/cm)和实际废水(COD 在180min内被完全去除,为70kW·h/kg COD)。
(4)冰水浴阳极氧化制备的电极的寿命为990min(20mA/cm),是无冰水浴制备的2.4 倍。尽管这种多层纳米结构可以提高蓝色TiO的稳定性,但电极使用寿命仍未达到工业应用的标准,需要在此基础上做出新的改进。
