Fe(Ⅱ)、Fe(Ⅲ)和Fe(Ⅵ)活化过硫酸盐氧化降解水中的菲
2022-03-09王乐心李亚男张国凯张继红陈梦洁白昀舒
王乐心,李亚男,张国凯,张继红,陈梦洁,白昀舒
(1. 太原理工大学 环境科学与工程学院,山西 晋中 030600;2. 中海国亚环保工程有限公司,山西 太原 030012;3. 河海大学 环境学院,江苏 南京 210098)
多环芳烃(PAHs)是一类由两个或两个以上的苯环以线性或簇聚方式形成的有机污染物,水溶性较差,由于具有剧毒、致癌、致突变及环境持久性等特点而备受关注。工业生产过程中碳氢化合物不完全燃烧产生的PAHs大多数以废水的形式排放,废水中存在的苯酚等有机物可促进其在水中的溶解,PAHs也被检测到广泛存在于我国流域水体中,因此,需寻求高效降解水中PAHs的方法,以控制PAHs在环境中的污染。
过硫酸盐(PS)是一种双电子氧化剂(氧化还原电位=2.01 V),经热、碱或金属(如铁)离子等活化后,可产生硫酸根自由基SO·(=2.6 V)和羟基自由基·OH(=2.8 V),极大提高对有机物的氧化降解能力。PS活化技术因具有效率高、矿化效果好、pH应用范围宽、选择性小和原料易储存且价格相对低廉等优点,被广泛运用于环境污染修复与治理领域。目前,已有不少PS活化技术用于水中PAHs去除的报道,如氧化钒活化PS、超声活化PS等,但铁活化的则相对较少。
可用不同价态的铁活化PS。Fe(Ⅱ)可活化过硫酸根离子(SO)生成具有较高氧化能力的SO·(式(1)),且Fe(Ⅱ)相对无毒、成本低、对环境友好。相比于Fe(Ⅱ),Fe(Ⅲ)活化PS的效果则较差。SO可还原Fe(Ⅲ)为Fe(Ⅱ),同时生成过硫酸盐自由基(SO·),从而活化PS(式(2))。高铁酸盐是铁的一种高价态(Fe(Ⅵ))形式,被认为是一种绿色的强氧化剂,在酸性和碱性溶液中的分别为2.20 V和0.70 V。Fe(Ⅵ)在氧化过程中会转化为Fe(Ⅲ)或Fe(Ⅱ),可作为PS氧化的替代铁源,从而活化PS生成自由基[21-22]。

菲是含3个苯环的典型PAHs。本工作选用菲作为Fe(Ⅱ)-PS、Fe(Ⅲ)-PS和Fe(Ⅵ)-PS体系氧化降解PAHs的研究对象,考察了反应pH、药剂投加量及氧化时间等因素的影响,并对比了3种体系的降解效果,为含PAHs水体的实际处理提供理论和技术支持。
1 实验部分
1.1 储备液的配制
菲储备液:取0.005 3 g菲(纯度97%)溶于乙腈中,用乙腈定容至100 mL,得到0.3 mmol/L菲储备液。研究显示,菲的水溶性极低,但水中有机物可促进其溶解,并且2%()以下的乙腈对氧化反应影响甚小,故选择乙腈制备菲储备液。
Fe(Ⅱ)/Fe(Ⅲ)/PS储备液:取0.055 6 g FeSO/0.079 9 g Fe(SO)/0.047 6 g NaSO(分析纯),用去离子水定容至100 mL,得到2 mmol/L的Fe(Ⅱ)/Fe(Ⅲ)/PS储备液,均现配现用。
Fe(Ⅵ)储备液:取0.039 6 g KFeO(纯度≥95%),用硼砂-盐酸缓冲溶液(pH=9)定容至100 mL,得到2 mmol/L的Fe(Ⅵ)储备液,现配现用。
1.2 实验方法
室温(约25 ℃)下,取2 mL的菲储备液,用磷酸盐缓冲溶液定容至100 mL,得到6 μmol/L的菲反应液,并置于200 mL烧杯中,匀速搅拌(78-1型恒温磁力加热搅拌器,中国常州恒隆公司)。按实验设计的时间点,向反应液中加入一定量的Fe(Ⅱ)/Fe(Ⅲ)/Fe(Ⅵ)储备液和PS储备液,总反应时间为60 min。反应过程中按设定时点取样至提前加好0.5 mol/L盐酸羟胺的离心管中终止氧化反应,离心,测定上清液中菲的浓度,计算其去除率。
1.3 分析方法
采用荧光分光光度计(RF-6000型,日本岛津公司)测定菲的浓度:激发波长250 nm,发射波长300~500 nm,步长3 nm,扫描速率2 000 nm/min。当菲的浓度处于0~7.5 μmol/L范围内时,荧光强度与浓度有良好的线性关系。
2 结果与讨论
2.1 Fe(Ⅱ)-PS体系对菲的氧化去除效果
实验同时投加Fe(Ⅱ)和PS至反应液中。由于实际水样中过酸或过碱的情况较少,因此选取反应pH(磷酸盐缓冲溶液pH)为5~9。如图1a((菲)∶(Fe(Ⅱ))∶(PS)为1∶2∶2)所示:酸性条件下体系对菲的去除效果较差;中性与碱性条件下的去除效果较好且去除率相差较小;当pH为8时菲的去除率最高,为65.11%(60 min)。低pH时,PS受H催化加速了SO·的生成,SO·浓度较高,因此pH为5的降解效果比pH为6好,但酸性条件下高浓度的SO·也易相互发生淬灭反应(式(3)),导致SO·利用率低,菲的去除效果不佳。但pH过高也不利于菲的降解,高pH时SO·会与OH反应生成·OH(式(4)),碱性条件下·OH的氧化还原电位低于SO·,系统的氧化能力有所降低,导致去除效果变差。

反应pH为8、(菲)∶(PS)为1∶2时,Fe(Ⅱ)投加量对菲去除率的影响如图1b所示。菲的去除率随Fe(Ⅱ)投加量的增加而提高,当(菲)∶(Fe(Ⅱ))为1∶2与1∶3时菲的去除率分别为65.11%与66.74%(60 min)。提高Fe(Ⅱ)投加量,加速了SO·的生成(式(1)),加剧了废水中有机物的氧化反应,因而提高了去除率。但(菲)∶(Fe(Ⅱ))从1∶2增至1∶3时,菲的去除率增加不明显,这可能是因为Fe(Ⅱ)消耗了部分SO·(式(5)),使得自由基对有机物的氧化效率无法达到理论值。综合考虑经济因素和去除效果,选取(菲)∶(Fe(Ⅱ))为1∶2较适宜。

反应pH为8、(菲)∶(Fe(Ⅱ))为1∶2时,PS投加量对菲去除率的影响如图1c所示。随PS投加量的增加,菲的去除率先升后降,当(菲)∶(PS)为1∶2时菲的去除率最高。提高PS投加量,可加速SO·的生成(式(1)),从而加剧废水中有机物的氧化反应,提高去除率。但当PS投加过量时,高浓度PS可能导致大量的SO·释放,使得SO·发生自清除反应(式(3)),而且PS本身也是SO·的淬灭剂(式(6)),会与废水中的有机污染物竞争SO·。


图1 反应pH(a)、Fe(Ⅱ)投加量(b)和PS投加量(c)对Fe(Ⅱ)-PS体系菲去除率的影响
2.2 Fe(Ⅲ)-PS体系对菲的氧化去除效果
实验同时投加Fe(Ⅲ)和PS至反应液中。(菲)∶(Fe(Ⅲ))∶(PS)为1∶2∶2,如图2a所示:中性与碱性条件下菲的去除率较高且相差较小;当pH为8时菲的去除率最高,为55.86%(60 min)。这主要是由于:低pH条件下,Fe(Ⅲ)以多种水合物的形式存在,PS活化效果较差,不利于SO·的生成;而在中性及碱性条件下,Fe(Ⅲ)生成的Fe(OH)絮体,虽较PS活化效果差,但可对有机物起到絮凝吸附作用,从而提高目标物的去除率。
反应pH为8、(菲)∶(PS)为1∶2时,Fe(Ⅲ)投加量对菲去除率的影响如图2b所示。菲的去除率随Fe(Ⅲ)投加量的增加而提高,当(菲)∶(Fe(Ⅲ))为1∶2与1∶3时菲的去除率分别为55.86%与57.07%(60 min)。提高Fe(Ⅲ)投加量,有助于二三价铁的转化,一定程度上增加了Fe(Ⅱ)浓度(式(2)),促进了SO·的生成(式(1)),且可增加Fe(OH)絮体的数量,提高目标物的去除率。综合考虑经济因素和去除效果,选取(菲)∶(Fe(Ⅲ))为1∶2较适宜。
反应pH为8、(菲)∶(Fe(Ⅲ))为1∶2时,PS投加量对菲去除率的影响如图2c所示。菲的去除率随PS投加量的增加而提高,当(菲)∶(PS)为1∶2与1∶3时菲的去除率分别为55.86%与56.40%(60 min)。PS浓度的提高相应地增加了体系中SO·的数量,使去除效果变好(式(1))。综合考虑经济因素和去除效果,选取(菲)∶(PS)为1∶2较适宜。

图2 反应pH(a)、Fe(Ⅲ)投加量(b)和PS投加量(c)对Fe(Ⅲ)-PS体系菲去除率的影响
2.3 Fe(Ⅵ)-PS体系对菲的氧化去除效果
由于Fe(Ⅵ)本身具有强氧化性,为合理发挥Fe(Ⅵ)-PS体系的氧化性能,在反应pH为7、(菲)∶(Fe(Ⅵ))为1∶2的条件下先进行Fe(Ⅵ)对菲的氧化,考察了Fe(Ⅵ)氧化时间对菲去除率的影响,随后立刻加入PS((菲)∶(PS)为1∶2)继续进行氧化降解,结果如图3a所示。反应起始阶段,同时投加Fe(Ⅵ)和PS(即Fe(Ⅵ)氧化时间为0)实验组的菲降解效果最好,Fe(Ⅵ)与PS两种氧化剂同时发挥氧化性能,对菲的氧化效果优于Fe(Ⅵ)单独氧化。反应60 min时,Fe(Ⅵ)氧化时间为5 min实验组的菲去除率最高,为83.37%。这可能是因为该条件下,Fe(Ⅵ)在反应中不仅发挥了自身氧化优势,还通过转移e或2e生成的其他价态铁较好地活化了PS,对菲继续进行氧化降解。
Fe(Ⅵ)氧化时间为5 min、(菲)∶(Fe(Ⅵ))∶(PS)为1∶2∶2时,反应pH对菲去除率的影响如图3b所示。Fe(Ⅵ)氧化5 min时,反应pH为9的实验组菲的去除率最高,可达70.80%。虽然碱性条件下Fe(Ⅵ)的氧化电位低于酸性,但碱性条件下Fe(Ⅵ)较稳定,有较充足的时间与菲接触反应,并生成Fe(OH)絮体吸附去除菲。综合氧化性能、稳定性及吸附性能,碱性条件下Fe(Ⅵ)去除菲的效果较好,这与之前的报道一致。加入PS反应到60 min时,pH为7的实验组菲的去除效果最佳,总去除率可达83.37%。低pH时,受H催化加速,PS生成的SO·浓度较高,易相互发生淬灭反应(式(3)),导致SO·利用率低,菲的去除效果不佳。但pH过高也不利于对菲的去除,高pH时SO·会与OH反应生成·OH(式(4)),碱性条件下·OH的氧化还原电位低于SO·,使得目标物的去除率降低。
Fe(Ⅵ)氧化时间为5 min、反应pH为7、(菲)∶(PS)为1∶2时,Fe(Ⅵ)投加量对菲去除率的影响如图3c所示。在Fe(Ⅵ)氧化阶段,菲的去除率随Fe(Ⅵ)投加量的增加而提高,高浓度Fe(Ⅵ)增加了分子间碰撞频率,加剧了氧化剂与目标物的反应,提高了菲的去除效率。加入PS反应到60 min时,(菲)∶(Fe(Ⅵ))为1∶2时菲的去除率最高。Fe(Ⅵ)投加量的增加提高了反应液中铁离子的浓度,PS活化效果较好,使菲的去除效果变好。但当Fe(Ⅵ)投加过量时,可能会造成反应液中铁离子浓度过高,铁离子会与目标物竞争消耗SO·,从而降低了体系的氧化能力(式(5)),导致氧化效率变低,去除率不再增加。
Fe(Ⅵ)氧化时间为5 min、反应pH为7、(菲)∶(Fe(Ⅵ)为1∶2时,PS投加量对菲去除率的影响如图3d所示。反应加入PS后菲的去除率相差较明显,(菲)∶(PS)为1∶2时最高。提高PS投加量,可加速SO·的生成,加剧废水中有机物的氧化反应,提高菲的去除率(式(1))。但当PS投加过量时,高浓度的PS和SO·会与废水中有机污染物竞争SO·(式(3)和式(6)),不利于菲的降解。
2.4 3种活化PS体系的对比
为对比Fe(Ⅱ)-PS、Fe(Ⅲ)-PS和Fe(Ⅵ)-PS 3种体系对菲的氧化降解效果,采用(菲)∶(Fe)∶(PS)为1∶2∶2以及3种体系中其他因素的最佳条件进行实验,结果如图4所示。反应60 min时,3种体系中菲的去除率从低到高依次为:Fe(Ⅲ)-PS(55.86%),Fe(Ⅱ)-PS(65.11%),Fe(Ⅵ)-PS(83.37%)。
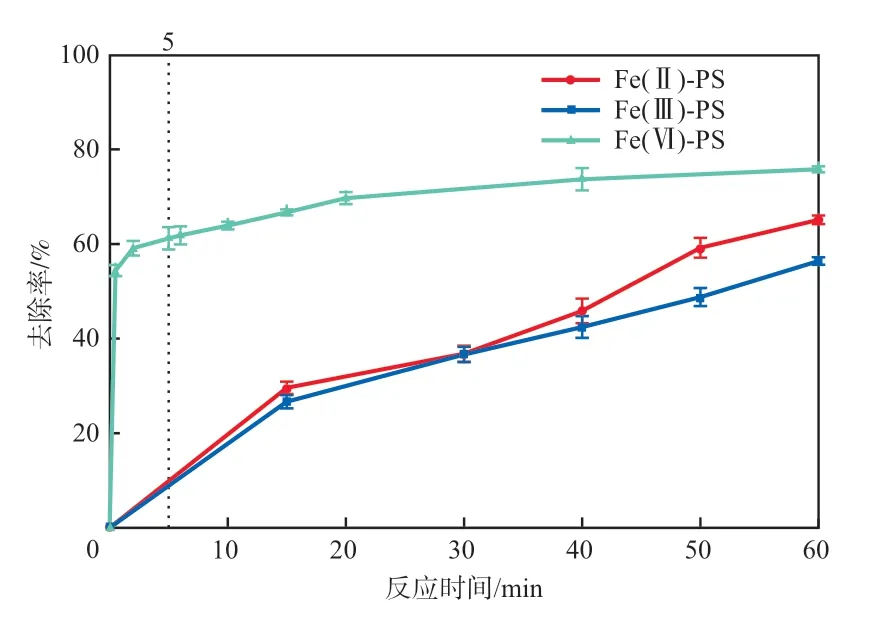
图4 3种活化PS体系的菲去除效果对比
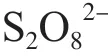
2.5 机理分析
据报道,Fe(Ⅱ)与Fe(Ⅲ)活化PS系数分别为2.7×10L/(mol·s)和1.35×10L/(mol·s)。Fe(Ⅱ)可较好地活化PS,而Fe(Ⅲ)自身活化PS的效果不好,大部分依靠SO2将其还原为Fe(Ⅱ)以活化PS(式(2)和式(1)),进而实现目标物的降解。无法避免的是,Fe(Ⅱ)仍会大量转化为Fe(Ⅲ)(式(1)),从而抑制对PS的活化,对菲的降解效率有限,且反应中易产生铁泥。最佳条件下,Fe(Ⅵ)-PS体系中,5 min时Fe(Ⅵ)反应基本稳定,此时加入PS,菲的降解率在Fe(Ⅵ)氧化的基础上提高了约16个百分点(图3b),表明Fe(Ⅵ)氧化过程中生成的还原价态铁较好地活化了PS,并生成活性氧自由基,如SO·或·OH,进一步实现了对菲的降解。

图3 Fe(Ⅵ)氧化时间(a)、反应pH(b)、Fe(Ⅵ)投加量(c)和PS投加量(d)对Fe(Ⅵ)-PS体系菲去除率的影响
菲醌是菲在化学氧化中的常见产物,而醌类物质可以作为电子穿梭体参与部分铁的还原,促进二三价铁的循环,从而提高体系的氧化能力。中碱性条件下Fe(Ⅲ)易形成氢氧化物,对菲的去除起到了一定的絮凝作用。SO·被证明是酸性PS体系(pH=2~7)中产生的主要自由基,而·OH是碱性体系中的主要自由基(pH>12)。本实验3种体系均在中碱性条件下进行,菲的去除可能是SO·和·OH的共同作用所致;此外,在Fe(Ⅵ)-PS体系中,除自由基作用外高价态铁还可能增加了体系的氧化能力,共同实现了对菲的氧化降解。
SO是PS的最终产物,可作为水体中微生物氧化有机物的电子受体而被消耗。我国《生活饮用水卫生标准》(GB 5749—2006)中规定的SO限值为250 mg/L,实验中产生的SO浓度远低于该限值,对水体的污染程度很小。
3 结论
a)当反应pH为8、(菲)∶(Fe(Ⅱ))∶(PS)为1∶2∶2时,反应60 min后Fe(Ⅱ)-PS体系对菲的去除率为65.11%。
b)当反应pH为8、(菲)∶(Fe(Ⅲ))∶(PS)为1∶2∶2时,反应60 min后Fe(Ⅲ)-PS体系对菲的去除率为55.86%。
c)当Fe(Ⅵ)氧化时间为5 min、反应pH为7、(菲)∶(Fe(Ⅵ))∶(PS)为1∶2∶2时,反应60 min后Fe(Ⅵ)-PS体系对菲的去除率可达83.37%,比单独Fe(Ⅵ)氧化高约16个百分点,表明Fe(Ⅵ)可有效活化PS。Fe(Ⅵ)-PS体系对菲的去除效果优于其他两种体系。
d)3种体系中菲的去除是SO·和·OH的共同作用所致;而在Fe(Ⅵ)-PS体系中,除自由基作用外,高价态铁还可能增加了体系的氧化能力,共同实现了对菲的氧化降解。
