乙型脑炎病毒感染PK15细胞的lncRNA差异表达谱分析
2022-03-08朱静静戴政列李向臣赵阿勇周晓龙杨松柏
朱静静,戴政列,汪 涵,李向臣,赵阿勇,周晓龙,杨松柏
(浙江农林大学动物科技学院·动物医学院,临安 311300)
乙型脑炎病毒(Japanese encephalitis virus, JEV)感染引起的乙型脑炎是一种严重危害人类健康和养猪业的人畜共患病。乙型脑炎主要流行于亚洲和西太平洋地区,据统计有超过30亿人口生活在这些地区[1]。其中我国是乙型脑炎的高发区,曾一度占世界的80%。尽管一些国家在疫苗接种工作中作出了很大努力,乙脑的发病率也已经有了明显下降,但每年仍有约6.8万人感染,其中75%是15岁以下青少年,并造成超过1万人死亡,而其中一半的幸存者会存在运动障碍、认知功能障碍和癫痫等后遗症[2]。猪是JEV的重要扩增宿主,蚊子是将病毒从猪传播给人类的重要载体[3]。因此,猪在JEV感染周期中起着至关重要的作用。此外,JEV感染也给养猪业造成了巨大的经济损失,母猪感染JEV引起流产和死胎,公猪感染引起无精症[4-5]。而猪肾上皮PK15细胞作为一种良好的感染模型,已被广泛应用于JEV感染研究[6-9]。
在人类基因组中,能够转录并翻译成蛋白质的序列只占2%,而基因组中有大量序列会转录成非编码RNA(ncRNA),如果ncRNA的长度超过200个核苷酸,将它定义为长ncRNA(lncRNA)[10]。像mRNA一样,大多数lncRNA都具有5′帽结构,并且具有聚腺苷酸化尾巴。长期以来。由于lncRNA不编码蛋白质,因此被认为是“暗物质”或“垃圾RNA”[11]。后续越来越多研究结果表明,lncRNA参与多种生物学过程,包括细胞生长、分化和凋亡[12-13]。利用高通量测序发现宿主lncRNA在多种病毒感染期后差异表达,包括PRRSV[14]、PRV[15]和PEDV[16],随后通过构建lncRNA-mRNA共表达网络,结果显示,多个差异表达lncRNA与免疫反应相关。
此外,已经证实lncRNA参与免疫反应过程来调控病毒复制。例如,lncRNA-Lnczc3 h7a结合TRIM25蛋白增强RIG-I介导的抗病毒先天免疫反应[17]。lncRNA#32通过正向调节干扰素刺激基因表达抑制病毒复制[18]。LncRNA-IVRPIE可以通过促进干扰素β1和干扰素刺激基因的表达来抑制甲型流感病毒的复制[19]。利用微阵列芯片分析发现,在JEV感染小鼠后,在脑组织中鉴定出618个差异表达lncRNAs,富集分析发现,这些lncRNA在先天免疫反应和炎症反应中可能起关键作用[20]。但是,JEV感染后的猪lncRNA表达模式及lncRNA在JEV感染过程中的潜在功能仍不清楚。
本研究中,利用高通量技术对JEV感染后的PK15细胞进行转录组测序,鉴定JEV感染后差异表达lncRNA,预测其靶基因并对靶基因进行富集分析,最后随机选择9个差异表达lncRNAs,利用荧光定量PCR进行验证。本研究结果将为进一步探索lncRNA参与免疫反应调控JEV感染分子机制奠定基础。
1 材料与方法
1.1 细胞培养和病毒感染
将PK15细胞(中国典型培养物保藏中心)接种于6孔细胞培养板中,加入含有10%胎牛血清(FBS,HyClone)和1%非必需氨基酸(Gibco)MEM培养基(HyClone),置于37 ℃和5%CO2培养箱中培养。第2天,待细胞融合度90%时,感染JEV(SA14-14-2,MOI=1),吸附1 h后,将细胞用PBS洗涤3次,加入含2% FBS的MEM培养基置于细胞培养箱中继续培养。未感染的细胞用作对照组,每组试验重复3次。感染后36 h收集细胞提取RNA,并命名为JEV-1、JEV-2和JEV-3;对照组分别命名为Mock-1、Mock-2和Mock-3。
1.2 文库构建和测序
利用TRIzol试剂(Thermo Fisher)提取总RNA。随后利用NanoPhotometer分光光度计(IMPLEN)和1%琼脂糖凝胶电泳分别检测RNA的浓度、纯度和完整性。然后每个样品取3 μg RNA,通过Ribo-Zero Magnetic试剂盒(Epicenter)去除核糖体RNA,利用NEBNext Ultra RNA文库制备试剂盒(New England Biolabs)进行文库构建。最后,利用Illumina HiSeq 2500系统(Illumina)对文库进行测序。整个流程委托北京博奥晶典生物技术有限公司完成。
1.3 数据质控与lncRNA鉴定
为了保证数据的质量与可靠性,需要对测序的原始数据进行质控。包括删除带接头(adapters)的reads,去除包含N>5%的reads和低质量(Q≤20)的reads,从而获得clean reads。
利用TopHat2将clean reads比对到参考基因组上并使用Cufflinks软件进行组装。利用Cuffcompare软件将组装好转录本和参考基因组进行比较,得到lncRNA和mRNA的相互位置关系。选用CPC、CNCI和Pfam软件对lncRNA进行编码潜能预测,3个软件预测都没有编码能力的即为候选lncRNA。
1.4 表达量分析
使用cuffquant和cuffnorm软件进行表达量分析,利用FPKM进行标准化处理样本,确定lncRNA和mRNA的表达水平。然后使用Deseq2软件鉴定差异表达lncRNA和mRNA,筛选标准为log2Fold Change≥1且Pvalue≤0.05。
1.5 靶基因预测
LncRNA可以调控自身和其邻近编码基因的转录。因此根据lncRNA及其邻近编码基因之间的位置关系,将lncRNA分为5种类型:有义、反义、双向、内含子和基因间lncRNA。有义,当它们与蛋白质编码基因的有义链重叠时;反义,当它们与蛋白质编码基因的反义链重叠时;双向,当它们位于与蛋白质编码基因相反的链上时,其转录起始距离少于1 000个 碱基对;内含子,当它们完全来自另一个转录本的内含子时;基因间,不在任何其他蛋白质编码基因座的10 000个碱基之内。将这5种类型的lncRNA归类为顺式调控lncRNA。使用blat软件对lncRNA和mRNA(3′UTR)序列进行比对,筛选序列相似lncRNA-mRNA对。因此得到多个顺式作用和反式作用的lncRNA-mRNA对,在这些lncRNA-mRNA对中,只有lncRNA和mRNA都为显著差异表达,才判定为lncRNA的靶基因。
1.6 GO和KEGG富集分析
利用GO(gene ontology)和KEGG(kyoto encyclopedia of genes and genomes)对差异表达lncRNA的顺式和反式靶基因进行功能富集分析。利用超几何分布进行假设检验得到富集结果P值,如果P≤0.05,则认为该富集结果显著。
1.7 荧光定量PCR验证差异表达lncRNA
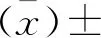
2 结 果
2.1 测序数据评估
对JEV感染组和未感染组共6个样品进行高通量测序,得到70.6~95.3 Mb不等的原始序列。经过质控之后,共得到68.5~92.7 Mb不等的有效数据,有效数据比例达到了96.8 %以上,Q20在97.7 %以上,Q20在93.5 %以上(表2)。测序数据和猪参考基因组的比对率均达到了70.3%以上,97.9 % 以上的序列在参考基因上有唯一的比对位置(表3)。表明测序数据较好,满足后续的数据分析。

表1 实时荧光定量PCR引物
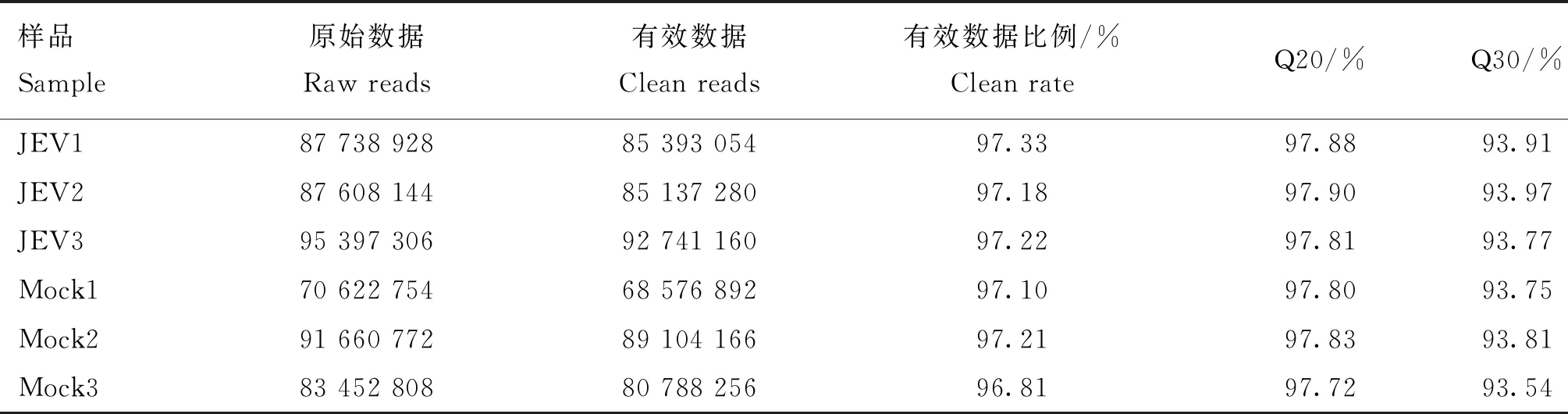
表2 测序数据质控
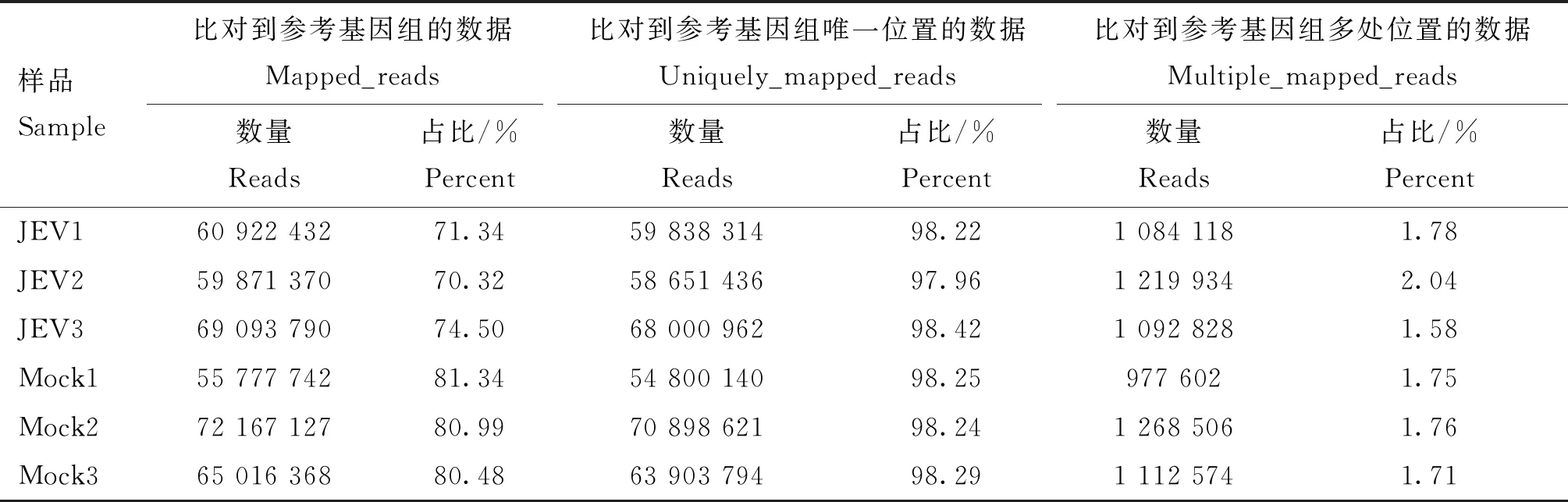
表3 参考基因组比对情况
2.2 lncRNA鉴定与差异表达分析
通过CPC、CNCI和Pfam软件进行筛选后,本研究共鉴定出5 059个新lncRNAs(图1A),
已知lncRNA共3 435个,已知mRNA共12 818个, 新mRNA共23 440个(图1B)。另外分别对lncRNA和mRNA外显子数量和转录本长度进行比较分析,发现和mRNA相比,lncRNA具有较少的外显子数量和较短的转录本(图1C、D)。对鉴定出的lncRNA和mRNA进行差异表达分析,结果表明,差异表达的lncRNA共856个,其中452个显著上调表达,404个显著下调表达(图2A、B);差异表达的mRNA总数为4 165个,其中显著上调表达的为2 253个, 显著下调表达的为1 912个(图2A)。从热图分析来看,同一个lncRNA或mRNA在同一组的表达模式相似,说明组内的样本重复性较好(图2C、D)。
2.3 差异表达lncRNA靶基因GO和KEGG分析
在差异表达lncRNA和mRNA中,通过比较或者比对lncRNA和mRNA的位置关系以及序列相似性,得到差异表达lncRNA的顺式和反式作用的靶基因。结果显示,共得到潜在靶基因1 041个,其中顺式作用靶基因657个,反式作用靶基因384个。为了进一步探究这些靶基因参与的生物学功能,利用GO数据库,将差异lncRNA靶基因进行功能注释。GO功能注释包括生物学过程(biological process)、细胞组分(cellular component)和分子功能(molecular function)。结果显示,共有821个GO条目显著富集。3个功能分类最显著的条目分别是先天免疫反应(innate immune response)、呼吸链(respiratory chain)和NADH脱氢酶活性(NADH dehydrogenase activity)(图3)。KEGG富集分析结果显示,lncRNA的靶基因共富集到156个通路中,其中10个通路显著富集,包括肿瘤坏死因子信号通路(TNF signaling pathway)、NF-κB信号通路(NF-κB signaling pathway)和Toll样受体信号通路(Toll-like receptor signaling pathway)(图4)。

A. CPC、CNCI和Pfam预测的lncRNA的维恩图;B. 鉴定的lncRNA和mRNA的数量;C. lncRNA和mRNA的外显子数目;D. lncRNA和mRNA的长度A. The Venn diagram of lncRNAs predicted by CPC, CNCI, and the Pfam database; B. The number of lncRNAs and mRNAs identified; C. Exon numbers of lncRNAs and mRNAs; D. Transcript lengths of the lncRNAs and mRNAs图1 差异lncRNA的鉴定与基因组特征Fig.1 Prediction and genomic features of lncRNAs
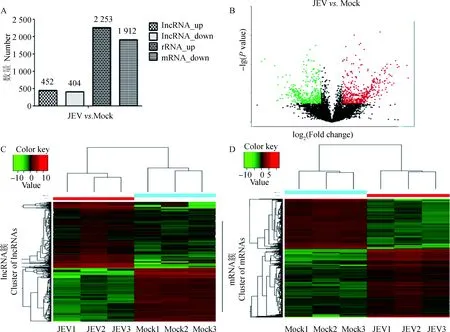
A. JEV感染组中上调和下调的差异表达lncRNA和mRNA的数量;B. 差异表达lncRNA的火山图,红点表示上调的基因,绿点表示下调的lncRNAs,黑点表示没有明显变化的基因;C. 差异表达lncRNA的聚类热图分析;D. 差异表达mRNA的聚类热图分析,红色表示相对较高的表达水平,绿色表示相对较低的表达水平A. The number of upregulated and downregulated differentially expressed lncRNAs and mRNAs in the JEV infected group compared to the mock infected group; B. Volcano plot of differentially expressed lncRNAs. Red dots refer to upregulated and green dots refer to downregulated lncRNAs, and the black dots represent genes with no significant changes; C. Clustering and heatmap analysis of differentially expressed lncRNA; D. Clustering and heatmap analysis of differentially expressed mRNA. Red refers to relative higher expression level, and green refers to relatively lower expression level图2 差异表达lncRNA和mRNA鉴定与表达分析Fig.2 Identification and expression analysis of differentially expressed lncRNA and mRNA

图3 差异表达lncRNA靶基因GO分析Fig.3 GO analysis of target genes of differentially expressed lncRNAs
2.4 定量PCR验证差异表达lncRNA
本研究利用荧光定量PCR方法对测序结果进行验证。首先将JEV感染PK15细胞,感染不同时间点收集细胞,提取RNA,反转录成cDNA,然后随机选取9个差异表达lncRNAs(6个显著上调表达,3个显著下调表达),设计引物,进行荧光定量PCR扩增。结果显示,与0 h未感染组相比,6个显著上调表达lncRNAs(TCONS_00091590、TCONS_00061989、TCONS_00057383、TCONS_00035357、TCONS_00022902、TCONS_00071284)在JEV感染36 h显著上调表达,而且在感染的整个过程中呈现上调表达趋势;3个 显著下调表达lncRNAs(TCONS_00035689、TCONS_00036059、TCONS_00087848)在JEV感染36 h显著下调表达,并且在JEV感染过程中呈现下调表达趋势(图5)。表明荧光定量PCR结果和测序结果一致,说明测序结果可靠。

图4 差异表达lncRNA靶基因KEGG分析Fig.4 KEGG analysis of target genes of differentially expressed lncRNA
3 讨 论
目前,关于JEV感染后引起宿主基因mRNA及miRNA[21]等的表达谱变化已有报道,但JEV感染后引起的猪lncRNA表达谱变化尚未见报道。研究表明,lncRNA在调控病毒宿主基因互作以及病毒增殖中起到关键作用[22]。在一项小鼠的研究中,利用微阵列芯片方法在JEV感染的小鼠脑组织中鉴定出多个差异表达的lncRNAs,通过lncRNA-mRNA共表达网络分析,发现这些lncRNA可能调控JEV诱导的炎症反应[20]。本课题组前期通过荧光定量PCR技术检测到4个lncRNAs在JEV感染PK15细胞后差异表达,并鉴定出lncRNA-SUSAJ1显著抑制JEV增殖[23-24]。本研究中,通过高通量测序方法鉴定JEV感染PK15细胞后的lncRNA表达谱。结果显示,共鉴定出5 059个新lncRNA。和mRNA相比,这些lncRNA具有较短的转录本和较少的外显子,这些lncRNA特征和之前的研究结果一致[25-27]。进一步通过表达分析发现,和对照组相比,感染组有856个差异表达lncRNAs。
在病毒感染细胞的不同阶段,宿主基因以及lncRNA往往会呈现出不同的表达谱。杜程涛等[23]在研究JEV感染PK15细胞动力学发现,在感染后的36 h时,病毒的滴度已经达到较高水平,而且这时细胞并没有发生明显病变。因此本研究选择了JEV感染36 h的细胞进行转录组测序。为了验证测序数据的准确性以及选择JEV感染时间点的普遍代表性,利用JEV感染PK15细胞,在感染不同时间点(0、12、24、36和48 h)收集细胞,提取总RNA,反转录成cDNA。随后随机选取转录组测序筛选到的9个差异表达lncRNAs进行荧光定量PCR验证。结果显示,这些lncRNAs在感染后36 h以及在病毒感染的整个过程中的表达趋势和测序结果一致。说明测序结果的可靠性高以及选择感染时间点具有代表性。

与0 h未感染组相比,*.P<0.05;**.P<0.01Compared with 0 h of uninfected group,*.P<0.05;**.P<0.01图5 荧光定量PCR验证差异表达lncRNAFig.5 Validation of differentially expressed lncRNAs by qRT-PCR
lncRNA能够通过顺式作用调控邻近基因的表达或通过反式作用调控不同染色体上的基因表达[28]。因此,本研究通过判定lncRNA和mRNA的相对位置以及序列相似性预测差异表达lncRNA的顺式和反式调控的靶基因。进一步通过GO分析发现这些靶基因在生物学功能中最显著富集于先天免疫反应。说明这些差异表达lncRNA可以通过调控宿主先天性免疫反应激活模式识别受体信号通路从而诱导干扰素和细胞因子的表达。例如,在一项丙肝病毒(HCV)的研究中发现,干扰素处理或HCV感染能诱导lncRNA-CMPK2的表达,同时在干扰素刺激的肝细胞中,敲低lncRNA-CMPK2表达后正调控干扰素信号通路进而抑制HCV复制[29]。lncRNA-NRAV通过组蛋白修饰抑制干扰素刺激基因的转录进而促进甲型流感病毒的复制[30]。lncRNA-ITPRIP-1通过激活MDA5诱导先天免疫反应,而lncRNA-EPS通过调控核小体的状态抑制免疫反应基因转录[31-32]。lncRNA-LncATV抑制RIG-I介导的先天免疫从而促进多种RNA病毒(包括丙型肝炎病毒、寨卡病毒)的复制[33]。因此本研究中筛选到的差异表达lncRNA参与先天性免疫反应调控JEV复制需要进一步验证。
差异表达lncRNA靶基因的KEGG富集结果中,显著富集的通路包括肿瘤坏死因子信号通路、NF-κB信号通路和Toll样受体信号通路。研究表明,Toll样受体(TLR)通过识别病毒复制产物,传递一系列信号激活细胞因子和I类干扰素表达启动先天性免疫反应发挥抗病毒作用,其中TLR3、TLR7和TLR8可以识别病毒RNA[34]。Toll样受体在宿主抗JEV感染发挥关键作用。例如,敲低TLR3基因表达后显著促进JEV复制[35-36]。在小鼠的脑组织中特异性敲低TLR7基因的表达后再感染JEV,发现在脑组织中IFN-α和抗病毒蛋白显著降低,同时病毒的载量显著升高[37]。研究表明,lncRNA能调控Toll样受体信号通路基因表达。比如lncRNA MEG3通过抑制TLR4信号通路基因表达促进呼吸道合胞病毒(RSV)的感染[38]。本研究筛选到多个差异表达lncRNA靶向免疫相关信号通路,因此,推测这些lncRNA介导先天性免疫反应相关通路调控JEV感染。
4 结 论
利用高通量测序技术对乙型脑炎病毒(JEV)感染后的PK15细胞进行了转录组测序,筛选到多个差异表达lncRNA,并预测这些差异表达lncRNA的顺式作用和反式作用的靶基因。进一步通过GO和KEGG富集分析发现,这些靶基因主要富集于免疫反应相关通路。推测lncRNA通过参与免疫反应调控JEV复制。本研究为进一步从lncRNA角度探究宿主基因参与调控JEV感染提供了理论依据。
