敲低组蛋白甲基转移酶ASH1L基因对牛卵丘细胞表达谱的影响
2022-03-08田雅晴崔立欣郝海生邹惠影庞云渭赵学明朱化彬杜卫华
田雅晴,崔立欣,郝海生,邹惠影,庞云渭,赵学明,朱化彬,杜卫华
(中国农业科学院北京畜牧兽医研究所,北京 100193)
在畜牧业生产中,卵泡的发育和排卵是影响母畜繁殖力和生产力的重要因素[1]。卵泡中,卵丘细胞包围卵母细胞,通过缝隙连接与其进行物质交换和信息传递,如运输环状鸟苷酸、环状腺苷酸、乳酸、丙酮酸和磷酸肌酸等作用于卵母细胞[2],而卵母细胞则通过旁分泌分化生长因子9(growth differentia-tion factor 9,GDF9)和骨形态发生蛋白15(bone morphogenetic protein 15,BMP15)来调节卵丘细胞的增殖和分化[3]。在牛卵丘-卵母细胞复合体(cumulus-oocyte complexes,COCs)的体外成熟过程中,去除卵丘细胞可显著降低卵母细胞的成熟率和胚胎的发育潜力[4]。
缺失的、小的、同源异形1(absent, small, or homeotic 1,ASH1)是组蛋白赖氨酸甲基转移酶,最初在果蝇中被鉴定出来[5]。ASH1含SET(su [var]3-9, enhancer-of-zeste, trithorax)结构域,具有甲基转移酶活性[6]。在哺乳动物中,类ASH1L(ASH1-like)可催化组蛋白H3K4和H3K36的甲基化,从而调控同源异形盒基因(homeobox gene,HOXgene)的表达[7]。Ash1L基因缺失后,小鼠发育能力降低,并伴有生殖器官的缺陷[8]。干扰ASH1L基因表达可抑制牛卵丘细胞的增殖,促进细胞凋亡,促凋亡基因BAX和CASPASE-3表达上调[9]。然而,ASH1L基因调控卵丘细胞增殖和分化的具体途径仍不清楚。
作为高通量技术,转录组测序(RNA-seq)能从基因组水平上研究细胞中的基因表达及其调控规律[10]。采用该法鉴定出在牛卵母细胞和卵丘细胞中共同表达的499个配体编码基因与转录调控相关,且富集于跨带突触形成的功能条目;另外,大量的差异表达基因富集于卵泡形成过程中的转录、翻译、凋亡、转运以及细胞分化等功能,可见卵丘细胞的基因表达与卵母细胞中的生物过程和胚胎的发育能力息息相关[11]。COCs经玻璃化冷冻后,卵丘细胞中存在大量的差异表达基因,推测其可能与冷冻卵母细胞发育潜力的降低相关[12]。本试验对敲降ASH1L基因的牛卵丘细胞和野生型卵丘细胞进行RNA测序,筛选两株细胞中的差异表达基因,通过生物信息学方法分析其功能和参与的信号通路,为揭示ASH1L基因在卵丘细胞增殖、卵母细胞成熟和胚胎发育中的作用机制提供新的研究思路。
1 材料与方法
1.1 试验材料
本研究所用试剂若无说明均购自西格玛奥德里奇(上海)贸易有限公司;DMEM/F12培养基、0.25%胰酶、DPBS液和转染试剂盒(Lipofectamine3000)购自赛默飞世尔科技(中国)有限公司。
1.2 卵丘细胞的分离和培养
屠宰场采集牛卵巢,于含双抗(100 IU·mL-1青霉素和100 μg·mL-1链霉素)的30 ℃生理盐水中,2 h内运回实验室。用真空泵连接18号针头,抽取直径为2~6 mm卵泡中的卵泡液。在体视显微镜下挑选状态良好,且带有3层及以上卵丘细胞的COCs,洗涤后放入成熟滴中,于38.5 ℃、5% CO2、饱和湿度条件下培养22 h。用0.1%透明质酸酶消化COCs,在显微镜下移除卵母细胞,将卵丘细胞用DPBS离心(1 000 r·min-1,5 min)洗涤两次,用含10% FBS和1%双抗的DMEM/F12培养基重悬细胞,接种在六孔板中,于37 ℃、5% CO2、饱和湿度条件下培养。
1.3 靶向牛ASH1L基因的siRNA合成
根据Cui等[9]的研究,按照NCBI提供的牛ASH1L基因序列(登录号:NM_001192743),由上海吉玛基因股份有限公司合成一对siASH1L及阴性对照siRNA序列(negative control,NC)。
1.4 卵丘细胞的转染
观察细胞密度达到80%,且状态良好时进行转染。将5 μL转染试剂Lipofectamine3000与50 μL Opti-MEM培养基混匀后室温静置5 min;将5 μL siRNA或NC序列与50 μL的Opti-MEM培养基混匀;然后将上述两种Opti-MEM培养基混匀,室温静置20 min。移除细胞孔中的培养基,DPBS清洗两次,加入600 μL Opti-MEM培养液;将含转染试剂和siRNA的混合物加入细胞孔,混匀后于37 ℃培养箱中继续培养。4~6 h后更换为含10% FBS和1%双抗的DMEM/F12培养基,48 h后收集细胞用于后续试验。
1.5 卵丘细胞RNA文库构建、转录组测序和数据分析
siRNA或siNC序列转染牛卵丘细胞48 h后,分别收集干扰组和对照组细胞提取RNA,每组3个重复,共6个样品RNA送至上海欧易生物医学科技有限公司,使用Illumian HiSeqTM2500平台进行测序。使用Trimmomatic软件对原始数据进行质量评估后,利用Hisat2将所得clean reads比对到牛参考基因组(版本号:UMD3.1.1)上。利用DESeq软件对各个样本基因的counts数目进行标准化处理(采用basemean值来估算表达量),计算差异倍数,以差异倍数>1.5及P<0.05来筛选差异表达基因。然后利用GO(gene ontology)和KEGG(Kyoto encyclopedia of genes and genomes)数据库分别对差异表达基因进行富集分析,并用超几何分布检验方法计算代表GO功能集在差异表达蛋白编码基因/转录本列表中富集的显著性,及每个Pathway条目中差异表达基因富集的显著性。
1.6 基因集富集分析(gene set enrichment analysis,GSEA)
利用GSEA软件,选用Hallmark(H)、Curated(C2)、Ontology(C5)数据库对RNA-seq测得的全部表达基因进行富集分析,以错误发现率(FDR)q值<0.25为标准筛选富集的基因集。
1.7 可变剪切分析和SNP位点分析
使用StringTie软件对reads进行组装,采用ASprofile软件检测样本中存在的可变剪切事件。
利用Samtools软件进行染色体坐标排序、去重等处理,再用Samtools、Bedtools等软件预测样本中的SNP位点,然后采用SnpEff等软件进行功能注释。使用QUAL(a quality score associated with the inference of the given allele)≥20,且DP(combined depth across samples)≥4对数据结果进行过滤。
1.8 实时定量RT-PCR(RT-qPCR)检测卵丘细胞中的基因表达水平
将siASH1L(干扰组)和siNC(对照组)分别转染牛卵丘细胞,每组3个重复,转染48 h后收集细胞。参照动物组织/细胞总RNA提取试剂盒(华越洋生物北京科技有限公司)说明书提取RNA,并反转录为cDNA,利用CFX96TM实时荧光定量PCR仪(BIO-RAD,美国)进行定量检测。牛GAPDH、ASH1L、紧密连接蛋白6(claudin-6,CLDN6)、冠蛋白1A(coronin 1A,CORO1A)和肌钙蛋白C1(troponin C 1,TNNC1)基因的引物参考崔立欣[13]的研究设计,并由华大基因公司合成;BMP4基因(登录号:NM_001045877.1)引物序列为F:TGGCCCAAGAGAACCCTAAG,R:ATCCGGGTGTTCCTTCATGT;SMAD蛋白6(SMAD family member 6,SMAD6)基因(登录号:NM_001206145.2)引物序列为F:GCCAACTCCCTCATCACAGC,R:AGGTAGGTCGTAGAAGATGC;头蛋白(Noggin,NOG)基因(登录号:XM_002695554.6)引物序列为F:CCAGCACTATCTCCACATCC,R:GGGGTCAAAGATAGGGTCCG。RT-qPCR的反应体系为15 μL:上、下游引物各0.5 μL, cDNA模板2 μL,TB Green Premix Ex Taq II(2×)7.5 μL,RNase free ddH2O 4.5 μL。反应程序:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,39个 循环。每个样品重复3次, 以牛GAPDH为内参基因,采用2-△△Ct法计算基因的相对表达量。
1.9 蛋白免疫印迹(Western blotting)检测卵丘细胞中的ASH1L蛋白表达水平
将siASH1L(干扰组)和siNC(对照组)分别转染卵丘细胞48 h后,用0.25%胰酶分别消化、收集干扰组和对照组细胞,加入200 μL含蛋白酶抑制剂的细胞裂解液,充分裂解后12 000 r·min-1离心5 min,吸取上清。将上清、β-巯基乙醇和Buffer混和,100 ℃蛋白变性10 min,取20 μL样品经SDS-PAGE胶电泳分离;再用200 mA电流、300 V电压将蛋白转移到硝酸纤维素膜上,37 ℃摇床、5%脱脂奶粉中封闭1.5 h。膜于一抗(1∶500)中4 ℃孵育过夜;TBST洗膜3次后,于二抗(1∶5 000)中37 ℃孵育1 h,洗膜后显影。凝胶成像仪中曝光采集数据,采用图像分析软件(Image-J)进行蛋白定量分析。以β-tubulin作为内参,每个样品至少重复3次。
1.10 数据统计分析
利用SPSS 26.0软件对数据进行组间单因素方差分析(ANOVA)和邓肯检验(Duncan test),结果以“平均值(Mean)±标准误(SEM)”形式表示,P<0.05为统计学差异显著。本研究中的柱状图均使用GraphPad Prism 7.0软件制作。
2 结 果
2.1 牛ASH1L基因在卵丘细胞中的表达及siASH1L的干扰效果
分别采用RT-qPCR和Western blotting方法检测牛卵丘细胞中ASH1L mRNA和蛋白的表达水平(图1A和1B),结果显示:ASH1L mRNA和蛋白在卵丘细胞中均有表达,且均显著低于内参基因的表达水平(P<0.05)。
将前期试验筛选的靶向ASH1L基因的siRNA序列(干扰组)和siNC序列(对照组)分别转染牛卵丘细胞,检测ASH1L基因和蛋白表达水平(图1C和1D)。结果发现:干扰组细胞中该基因的mRNA和蛋白表达水平显著低于对照组细胞(P<0.05),siRNA干扰效率达60%~70%。
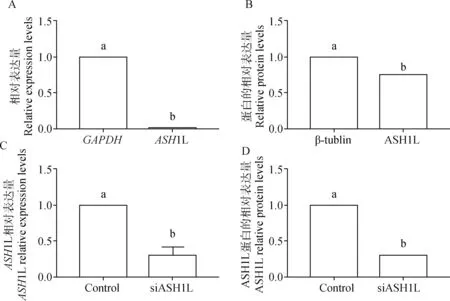
A.卵丘细胞中ASH1L基因的mRNA表达水平;B.卵丘细胞中ASH1L蛋白的表达水平;C.siRNA干扰后,卵丘细胞中ASH1L基因的mRNA表达水平;D.siRNA干扰后,卵丘细胞中ASH1L蛋白的表达水平。不同字母代表差异显著(P<0.05)A. Expression level of ASH1L gene in bovine cumulus cells; B. Protein level of ASH1L in bovine cumulus cells; C. Expression level of ASH1L gene in bovine cumulus cells with siRNA interference; D. Protein level of ASH1L in bovine cumulus cells with siRNA interference. Different letters indicate significant difference (P<0.05)图1 ASH1L在牛卵丘细胞中的表达及siASH1L干扰效果Fig.1 Expression levels of ASH1L in bovine cumulus cells with or without siRNA interference and interference effect of siASH1L
2.2 差异表达基因的筛选
干扰组与对照组细胞的RNA-seq原始数据进行质量过滤后,获得有效数据量44 G,Q30碱基分布在93%以上,数据可靠,可用于后续的生物信息学分析。两组细胞共筛选出2 046个差异表达基因,其中上调基因1 078个,下调基因968个(图2)。上调倍数较大的基因有铁调素调节蛋白2(hemojuvelin 2,HFE2)、肌球蛋白轻链7(myosin light chain 7,MYL7)和水通道蛋白1(aquaporin 1,AQP1),分别上调了6.72、5.29和4.31倍;下调倍数较大的基因有肌肉骨骼受体酪氨酸激酶(muscle, skeletal, receptor tyrosine kinase,MUSK)、血管非炎性分子1(vanin 1,VNN1)和代谢型谷氨酸受体8(metabotropic glutamate receptor 8,GRM8),分别下调了6.32、6.01和3.74倍。
为验证测序结果的可靠性,选取6个差异表达基因进行RT-qPCR验证(图3)。与对照组相比,干扰组细胞中CLDN6、CORO1A和TNNC1基因的表达量显著上调,而BMP4、SMAD6和NOG基因的表达量显著下降(P<0.05);可见,以上基因表达水平的变化趋势与RNA-seq结果一致。
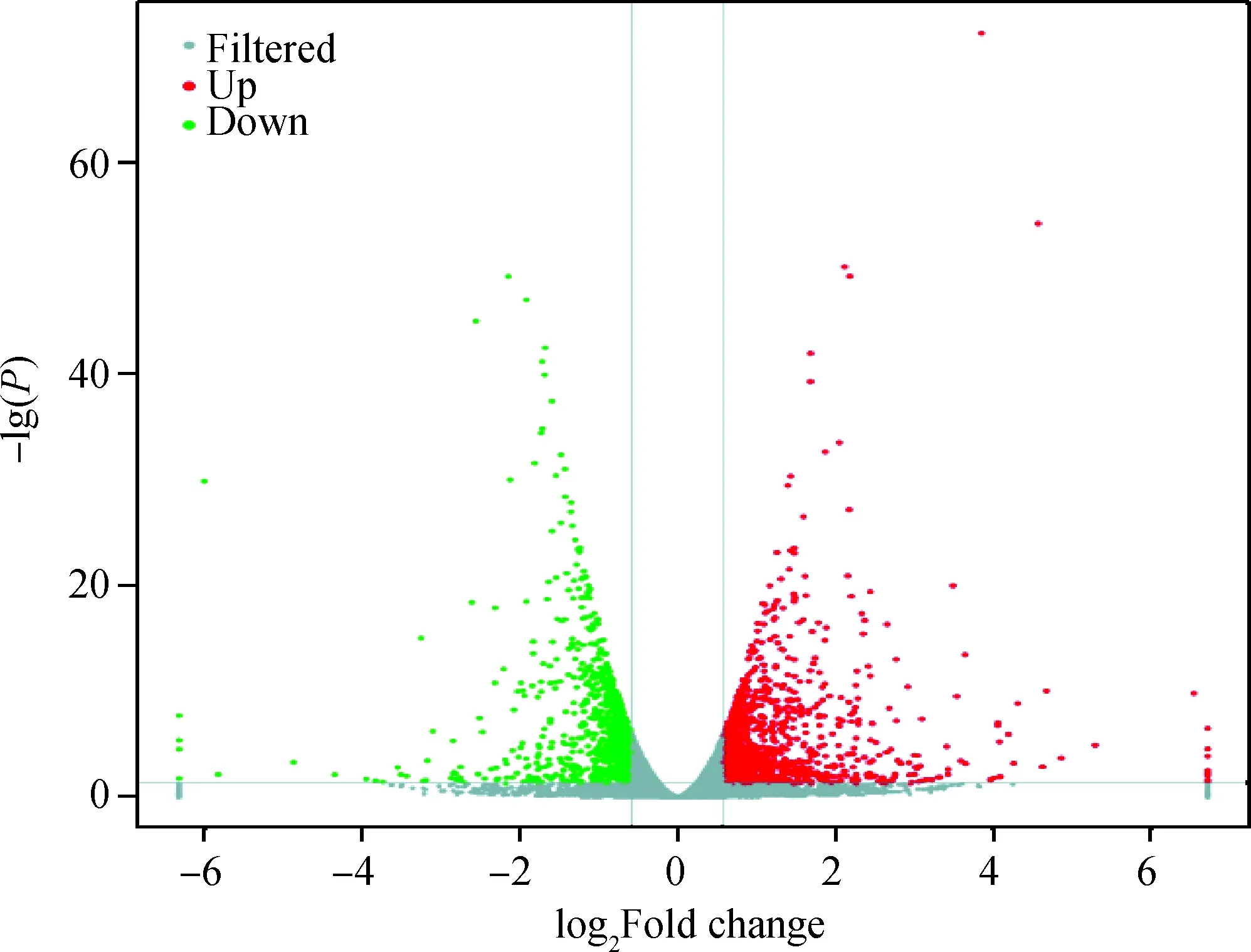
图2 ASH1L干扰组和对照组卵丘细胞中差异表达基因火山图Fig.2 Volcano map of differentially expressed genes in bovine cumulus cells with or without interference of ASH1L
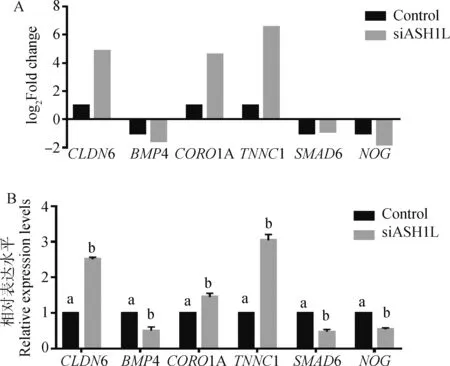
A.RNA-seq中差异表达基因的log2(fold change);B.差异表达基因的RT-qPCR分析A. log2(fold change) of differentially expressed genes; B. RT-qPCR analysis of differentially expressed genes图3 ASH1L干扰组和对照组卵丘细胞中差异表达基因RT-qPCR验证Fig.3 RT-qPCR verification of differentially expressed genes in bovine cumulus cells with or without interference of ASH1L
2.3 差异表达基因的GO富集和KEGG通路分析
对2 046个差异表达基因进行GO注释分析,结果其主要富集到2 802个GO条目。其中,生物学过程类条目包括血小板活化的正调控、纺锤体检验点、细胞迁移的正调控、细胞分裂等;细胞组分类条目包括白介素6受体复合物、细胞外基质蛋白、细胞外空隙、细胞连接等;分子功能类条目包括微卫星结合、细胞外基质结合、钙离子结合、胰岛素样生长因子I结合、组蛋白甲基转移酶活性、H3K36二甲基化等(图4A)。
KEGG分析发现,两组细胞的差异表达基因共富集到53条通路,显著富集的通路主要包括白细胞跨内皮迁移、细胞凋亡、Hippo、细胞黏附分子、PI3K-Akt、细胞外基质受体相互作用等(图4B)。参与白细胞跨内皮迁移通路的基因中,表达量变化较大的有α-辅肌动蛋白3(α-actinin 3,ACTN3)、CLDN6和VAV鸟嘌呤核苷酸交换因子3(vav guanine nucleotide exchange factor 3,VAV3),分别上调了1.65、4.86和2.59倍;参与细胞黏附分子通路的基因中,表达量变化较大的有整合素β7亚基(integrin β7 subunit,ITGB7)、CLDN6和选择素P(selectin P,SELP),分别上调了2.51、4.86倍和下调了2.75倍。其中,CLDN6是一种紧密连接蛋白基因,同时参与细胞黏附分子和白细胞跨内皮迁移两个通路。
2.4 全部表达基因的基因集富集分析
利用GSEA分析干扰组和对照组卵丘细胞的全部表达基因在GO gene sets和curated gene sets基因集中的富集情况(表1)。结果,ASH1L基因可能与发育诱导、细胞周期、胚胎干细胞、H3K4特异性组蛋白甲基转移酶活性、组蛋白去甲基化等生物学过程相关。
2.5 差异可变剪切分析
6个样品的转录组测序共鉴定出12种可变剪切方式,共117 994个可变剪切事件(表2)。绝大多数的基因发生外显子跳跃类型的可变剪切,其中单外显子跳跃、可变第一外显子和模糊边界单外显子跳跃3种剪切方式分别占可变剪切事件的37%、32%和11%。
2.6 转录组SNP位点筛选与分析
测序数据中共检测到522 205个SNPs位点,其中绝大多数SNP分布在内含子、外显子和基因下游(表3);碱基转换的发生频率显著高于颠换,其中A-G和T-C转换频率较高,G-C和C-G颠换频率较高。
3 讨 论
哺乳动物中,卵丘细胞的增殖和凋亡对卵泡的生长、卵母细胞的成熟和早期胚胎的发育潜力至关重要[14];而组蛋白甲基化等表观修饰参与调控卵丘细胞的增殖和生长[15]。本试验首先分析了组蛋白甲基转移酶ASH1L在牛卵丘细胞中的表达水平,然后通过RNA干扰技术敲降ASH1L基因,研究其低表达对牛卵丘细胞基因表达谱的影响。
本研究采用GO富集和GSEA基因集富集两种方法对敲降ASH1L基因的卵丘细胞和野生型卵丘细胞中的表达基因进行分析,前者是对两组细胞中的差异表达基因进行富集分析,而后者是利用所有基因的表达信息进行基因集富集分析[16]。GO分析表明,两组细胞的差异表达基因主要富集在细胞分裂、组蛋白甲基转移酶活性、H3K36二甲基化、细胞连接等GO条目;而GSEA富集分析发现,两组细胞中表达的基因显著富集到发育诱导、H3K4特异性组蛋白甲基转移酶活性、H3K27me3和组蛋白去甲基化等基因集。可见,ASH1L基因与组蛋白甲基转移酶的催化功能和卵丘细胞的生长调控等密切相关;崔立欣等[17]对卵丘细胞中H3K36me1/2/3的荧光免疫染色结果也说明,干扰ASH1L基因可显著降低H3K36me1/2/3甲基化水平,以上结果与ASH1L可特异性甲基化H3K4和H3K36的前期研究一致[12,18]。另外,GSEA富集分析表明,敲降ASH1L基因能够导致H3K27me3水平上调,其核心基因包括HOXA3、HOXD8和HOXD4等。H3K4、H3K36、H3K79甲基化与基因激活有关,H3K9、H3K27、H3K20甲基化与基因沉默或异染色质形成有关[19];ASH1L可特异性催化H3K36甲基化,并通过干扰核小体上多梳抑制复合体2(polycomb repressive complex 2,PRC2)的活性而抑制H3K27甲基化,从而调控HOX基因的表达[20]。
敲降ASH1L基因的卵母细胞和野生型卵丘细胞中的差异表达基因富集到53条通路,而下调基因显著富集的通路中包含转化生长因子β(transforming growth factor-β,TGF-β)。TGF-β是机体内重要的信号通路之一,可调节细胞的增殖与分化、胚胎发育、器官形成和免疫功能等[21];该通路包含大量不同的多肽类形态发生因子,如肌肉生长分化因子GDF8、GDF9和骨形态生成蛋白4(BMP4)。GDF8也称肌肉生长抑制素(myostatin,MSTN),是大多数哺乳动物肌肉生长的调节因子,在颗粒细胞中以旁分泌因子的形式表达[22]。GDF8通过调节p38 MAPK磷酸化和细胞内活性氧自由基水平来调节猪卵母细胞的体外成熟和胚胎发育[23];GDF8还可下调正五聚蛋白3(pentraxin 3,PTX3)的表达来调节卵丘细胞的扩散、排卵和体内受精[24],PTX3缺乏会严重影响卵丘细胞的扩散[25]。牛卵丘细胞中GDF9的表达量随卵母细胞成熟进程而呈动态变化,在成熟培养12 h表达水平达到峰值,启动细胞的扩展;培养24 h成熟完成时,其又下调表达,可见其对卵母细胞的成熟具有重要的调控作用[26]。根据差异表达基因的生物信息学分析结果,BMP4参与转录正调控、生长因子活性、BMP信号通路等GO条目,以及细胞因子与细胞因子受体的相互作用、TGF-β信号通路、调节干细胞多能性等通路。而且,BMP4在胚胎发育[27]、细胞生长[28]、迁移和分化等方面发挥着重要作用,其不仅通过抑制卵母细胞凋亡、参与BMPs/SMADS经典信号通路来实现对卵泡生长的调控,降低原始卵泡闭锁[29];还通过PI3K/PDK-1/AKT信号通路抑制牛颗粒细胞的凋亡[28]。SMAD1、SMAD5和SMAD8是BMP受体下游激活的细胞内信号传导途径的主要组成部分[30],干扰siASH1L下调了卵丘细胞中SMAD6基因的mRNA表达水平,可见ASH1L对TGF-β信号通路的重要调控作用。
差异表达基因的KEGG通路富集分析表明,ASH1L蛋白可能通过细胞黏附分子和白细胞跨内皮迁移通路调节卵丘细胞的生长,其中CLDN6同时参与这两个通路。CLDN6是一种紧密连接蛋白,也是早期胚胎发育过程中的标记物[31];CLDN6异常表达会破坏紧密连接的完整性,导致细胞异常增殖、迁移和侵袭[32]。CLDN6在小鼠胎儿上皮细胞中表达,并在内胚层组织中具有重要作用,其表达水平与上皮细胞的去分化及恶性增殖相关,同时也是囊胚形成所必需的[33]。CLDN6基因过表达导致小鼠细胞增殖/凋亡失衡,从而使小鼠发育迟缓[34];BMP信号通路的抑制剂NOG可拮抗其表达,表明CLDN6可能通过TGF-β/BMP通路调控囊胚的形成和早期胎儿上皮细胞增殖[35],推测CLDN6可能是ASH1L的下游靶标。类似地,对包裹水牛GV/MII期卵母细胞外周的卵丘细胞进行miRNA测序,结果筛选的差异表达miRNAs也主要通过细胞连接和细胞增殖等途径在卵丘细胞中发挥作用,进而调控卵母细胞的成熟[36]。
4 结 论
本研究在牛卵丘细胞中检测到ASH1L mRNA和蛋白的表达,敲低该基因的表达可改变卵丘细胞的表达谱,通过分析基因表达差异、可变剪切和SNP位点,证明ASH1L参与细胞分裂、细胞连接和H3K4特异性组蛋白甲基转移酶活性等过程,且其对细胞黏附分子和白细胞跨内皮迁移等通路具有调控作用,为深入研究ASH1L在卵丘细胞生长和胚胎发育中的功能提供理论基础。
