可视化RPA-LFD技术快速检测猪链球菌
2022-03-08张闪闪李书光刘明成姜金庆胡建和雷连成沈志强夏小静
张闪闪,何 斌,李书光,刘明成,姜金庆,胡建和,雷连成,沈志强 *,夏小静 *
(1. 河南科技学院动物科技学院,新乡 453003; 2. 山东省滨州畜牧兽医研究院,滨州 256600; 3. 吉林大学动物医学学院,长春 130062)
猪链球菌(Streptococcussuis,SS)是猪的重要病原体,可导致化脓性脑膜炎、心内膜炎、多发性浆膜炎、败血症、中毒性休克样综合征(STSLS)和关节炎[1]。猪链球菌以共生菌株形式在上呼吸道定殖,从而产生病原携带猪[2]。此外,猪链球菌也可作为机会致病菌出现[3]。猪链球菌的感染不仅会造成养殖业巨大的经济损失,而且对公共卫生构成重大威胁。在西方国家,猪链球菌被认为是一种职业病,感染通常为单病例散发,例如养猪户、兽医、屠宰场工作人员。感染主要通过皮肤伤口与受污染的猪肉直接接触而发生,即使在没有明显伤口的情况下也可被感染[4]。另一方面,在东南亚国家,主要的感染途径是胃肠道。在这些国家,食用未煮熟的猪肉产品现象普遍存在[5]。人类感染猪链球菌中最常见的症状是脑膜炎和败血性休克[6]。据报道猪链球菌脑膜炎幸存者常伴有神经系统后遗症[7]。两次大规模的人类猪链球菌流行导致患者中毒休克样综合征(STSLS),尽管采取了适当的治疗措施但仍导致较高的死亡率[8-10]。
传统的分离培养和生化分析费时、费力且灵敏度低[11]。ELISA技术是实验室用于检测细菌和病毒的最普遍使用的免疫测定方法。该方法具有成本低,速度快,灵敏度高,易于使用和可靠性高的优点,并且可以在单个试验中筛查大量样本。本团队前期分别以gdh、sao-M为诊断抗原建立了Dot-PPA-ELISA、PPA-ELISA检测方法[12-14],实现对猪链球菌的快速诊断,弥补了分离培养和生化分析的不足,提高了检测的准确性和灵敏度。基于胶体金的免疫层析试纸法和免疫传感器技术也被用于检测猪链球菌感染[11, 15]。这些方法均可用于猪链球菌的快速、灵敏检测,但是,大多数方法需要专业的操作技术人员,有赖于特殊仪器,限制了其推广应用[11, 15]。目前,基于PCR的分子生物学技术是最常用于猪链球菌检测的技术。单个或多重PCR、荧光定量PCR等方法对猪链球菌保守基因或不同血清型特异的荚膜多糖基因进行扩增与测序[16-17],在基因水平上实现对猪链球菌的快速检测。此外,环介导等温扩增技术(LAMP)也成功应用于检测猪链球菌[18]。然而LAMP技术存在引物设计复杂、需要多对引物、产物间易相互作用造成非特异扩增、无法通过测序验证扩增结果的正确性等问题[19]。因此,临床仍然需要一种简单、快速、灵敏的方法来实现SS感染的快速诊断。
重组酶聚合酶等温扩增技术(recombinase ploymerase amplication, RPA)是一种新型核酸等温扩增技术,在37~42 ℃条件下,模拟体内DNA复制过程,可实现对目标片段有效等温扩增,20 min即可完成反应,且操作简便,同时还具有特异性好和灵敏度高的特点[20]。RPA技术与侧流层析试纸条(lateral flow dipstick,LFD)相结合形成RPA-LFD检测体系,不需要电泳仪、荧光值监测设备,可在5~10 min实现对扩增产物的快速可视化检测[21],适用于临床及野外检测。目前,国际上尚无基于RPA-LFD技术检测猪链球菌的报道。
谷氨酸脱氢酶(glutamate dehydrogenase, GDH)是碳氮代谢的连接桥梁,在细菌能量代谢过程中具有重要作用,直接影响细菌的致病性[22]。猪链球菌GDH蛋白表达于菌体细胞壁,是进化上极其保守的种特异性抗原成分,可作为猪链球菌的诊断性抗原,建立针对猪链球菌所有血清型的通用检测方法[12, 23]。本研究以gdh为检测靶标,将RPA与LFD结合,开发了RPA-LFD封闭式检测体系。此外,作者通过与PCR方法的比较及其在快速筛选临床样本中的应用,评估了该方法的特异性和敏感性,力求建立一种速度快,特异性好和灵敏度高的猪链球菌通用检测方法。
1 材料与方法
1.1 菌株与质粒
1型菌株JZLQ036,2型菌株CVCC606、CVCC1941、JZLQ022、ZY05719、05ZYH33、JZLQ019,7型菌株JZLQ034,9型菌株JZLQ035由滨州畜牧兽医研究院沈志强研究员和吉林大学雷连成教授惠赠。肠致病性大肠杆菌、副猪嗜血杆菌、巴氏杆菌,由河南科技学院预防兽医学实验室分离、鉴定并保存;猪胸膜肺炎放线杆菌(L20)、沙门菌(ATCC25922)、金黄色葡萄球菌(ATCC49525)、嗜水气单胞菌(AH-1)和pMD-18T-gdh质粒均由本实验室保存[24]。
1.2 试验试剂
TwistAmp®Basic、TwistAmp®nfo 试剂盒购自TwistDX公司;侧流层析试纸条及检测装置购自杭州优思达生物技术有限公司;PCR Master Mix试剂盒购自生工生物工程(上海)股份有限公司。E.coliDH5α感受态细胞购自天根生化科技(北京)有限公司。细菌 DNA 提取试剂盒购自生工生物工程(上海)股份有限公司。
1.3 方法
1.3.1 细菌DNA提取 利用Ezup柱式细菌基因组 DNA 抽提试剂盒提取对数生长期的猪链球菌、肠致病性大肠杆菌、沙门菌、副猪嗜血杆菌、金黄色葡萄球菌、胸膜肺炎放线杆菌、巴氏杆菌、嗜水气单胞菌的基因组DNA;保存于-80 ℃备用。
1.3.2 引物与探针的设计与合成 从GenBank下载猪链球菌gdh基因序序列,并在DNAStar软件(DNASTAR,麦迪逊,威斯康星州,美国)上进行了比对分析。根据《TwistAmp DNA扩增试剂盒分析设计手册》,使用软件Primer 5.0设计引物8对(表1)。为结合侧流层析试纸条的可视化检测,反向引物5′端用生物素标记。根据TwistAmp Basic试剂盒(英国TwistDX)的说明书设计两个TwistAmp®nfo探针。探针的5′端用羧基荧光素(FAM)标记,而3′端用C3-Spacer修饰。然后,将THF(四氢呋喃)位点置于距探针5′端30 bp处,并替换1个核苷酸。THF残基后3′端至少添加15个核苷酸。引物与探针均由上海生工生物工程股份有限公司合成。
1.3.3 普通PCR检测 根据参考文献[25-26]进行。
1.3.4 Basic-RPA反应体系的建立和反应条件的优化 根据TwistAmp®Basic试剂盒(英国,TwistDX)的说明书建立50 μL反应体系进行RPA反应。组分包括29.5 μL反应缓冲液、正向和反向引物各2.4 μL,2.2 μL模板(DNA)和11 μL无核酸酶水。轻轻混匀以上混容物,并将其加入到冷冻干燥的RPA反应管中。反应管中含有经真空冷冻干燥处理的固体反应物,用移液器吸打混匀,使冻干状态的固体反应物复水。之后,加入2.5 μL 280 mmol·L-1MgAc,并使用热循环仪在39 ℃下孵育20 min,扩增产物用2%琼脂糖凝胶电泳检测。为了提高灵敏度,作者对Basic-RPA反应的关键参数进行了优化,包括各种反应温度(30、35、37、39、45 ℃)和时间(5、10、15、20、25、30、35和40 min)。筛选的反应温度和时间用于后续nfo-RPA反应。nfo-RPA反应体系:29.5 μL反应缓冲液、正向和反向引物各2.1 μL,0.6 μL探针(10 μmol·L-1),2.2 μL模板(DNA)和11 μL无核酸酶水。其他操作同Basic-RPA。
1.3.5 RPA-LFD检测反应产物 nfo-RPA反应体系:29.5 μL反应缓冲液、正向和反向引物各2.1 μL,0.6 μL探针(10 μmol·L-1),2.2 μL模板(DNA)和11 μL无核酸酶水。反应操作同Basic-RPA。反应产物无需纯化,按照TwistAmp®nfo试剂盒(TwistDx,英国)提供的说明书进行LFD结果分析。取出10 μL扩增产物用190 μL经过滤的去离子水稀释,通过移液器适当混合后,使用一次性核酸检测试纸条检测RPA扩增产物。最后,可直接用肉眼观察可视化结果。即当样品线和对照线均可见时,该反应被认为是阳性的;如果只有控制线可见,则测试被解释为阴性;未见控制线则检测结果无效。
1.3.6 特异性试验 为了分析建立的RPA-LFD方法的特异性,选择肠致病性大肠杆菌、沙门菌、副猪嗜血杆菌、金黄色葡萄球菌、胸膜肺炎放线杆菌、巴氏杆菌、嗜水气单胞菌用合适的培养基培养,按“1.3.1”方法提取细菌DNA作为模板,利用最佳反应条件进行 RPA 检测,评价上述建立的RPA-LFD方法的特异性。用猪链球菌作为阳性对照,回收RPA产物分别克隆到T-vector pMD-19T载体,转化至大肠杆菌DH5α感受态细胞后各挑取3个单菌落,用通用引物进行菌液PCR鉴定,将PCR鉴定为阳性的重组质粒进行送往上海生工测序,并分析测序结果。

表1 猪链球菌通用RPA扩增引物及探针序列
1.3.7 灵敏性试验 将本室保存的pMD-18T-gdh阳性质粒按10倍倍比稀释至7个浓度(1.0 × 107~1.0 × 100拷贝·μL-1),作为模板以最佳反应条件使用开发的Basic-RPA和RPA-LFD进行检测,确定该方法的最小检出量。同时采用前述PCR Master Mix试剂盒进行常规PCR检测,比较3种检测方法的敏感性。
1.4 临床应用试验
本研究首先应用所建立的猪链球菌RPA-LFD检测方法检测1型菌株JZLQ036,2型菌株CVCC606、CVCC1941、JZLQ022、ZY05719、05ZYH33、JZLQ019,7型菌株JZLQ034,9型菌株JZLQ035基因组DNA初步评价其实用性。为进一步确证RPA-LFD在临床应用中的使用效果,选择河南省不同规模化猪场45头临床症状疑似猪链球菌感染的病猪,采集扁桃体组织总DNA,以pMD-18T-gdh重组质粒为阳性对照,以ddH2O为空白对照,以健康猪的扁桃体组织总DNA为阴性对照,按照最佳反应条件进行RPA-LFD检测;同时对上述样品进行传统细菌分离培养、常规多重PCR检测[26],并对试验结果进行比较分析。
2 结 果
2.1 RPA引物和探针选择
猪链球菌gdh基因因其高度保守的特性被本研究选为建立猪链球菌通用型检测方法的靶标。用核酸蛋白分析仪测定本室保存的重组pMD-18T-gdh阳性质粒浓度,经公式计算得出重组质粒拷贝数为1.84×1010拷贝·μL-1。根据RPA引物设计原则,针对gdh基因设计了8对通用引物(表1),并分别以pMD-18T-gdh阳性质粒为模板在没有探针的情况下进行扩增,随后利用琼脂糖凝胶电泳进行评估。利用引物GDH1166F/GDH1346R和GDH874F/GDH812R对gdh进行RPA 扩增,可出现清晰条带,而其他引物扩增无条带、拖带、或者特异性不好,由此确定引物GDH1166F/GDH1346R和GDH874F/GDH812R特异性较好(图1,部分数据未显示)。后续试验证实GDH874F/GDH812R及其探针存在非特异性扩增,故本试验仅使用引物GDH1166F/GDH1346R及其探针。
2.2 RPA检测体系的建立与优化
为了确定最佳测定条件,使用Basic-RPA方法对RPA两个主要参数(时间和温度)进行优化。首先将相同RPA反应体系在不同温度(25~45 ℃范围内)下孵育30 min以确定最佳扩增温度。如图2A所示,在30~45 ℃条件下,扩增子均具有预期的大小(图2A)。当RPA反应体系在39 ℃孵育时,可以看到清晰的扩增条带,这表明它是理想的扩增温度。30、35和37 ℃反应30 min后,分别显示出预期的RPA扩增条带较弱。45 ℃反应30 min后扩增条带亮度较39 ℃开始减弱。最终确定本方法的最佳反应温度为39 ℃。
在上述最佳反应温度下,筛选了不同的反应时间(5、10、15、20、25、30、35和40 min)。 结果显示,在39 ℃温度下,反应进行10 min 时已经开始出现目的条带,反应15 min时能够较为清晰地看到特异性扩增条带。结果表明,RPA反应在不低于10 min时,即可得到清晰的特异性扩增条带,但在10、15 min时检测到的扩增目的条带荧光强度较低,本研究选择20 min为最佳扩增时间(图2B)。

M. 500 bp DNA ladder; 1. 引物GDH1166F/GDH1346R; 2. 引物GDH874F/GDH1002R; 3. 引物GDH556F/GDH706R; 4. 引物GDH162F/GDH240R; N. 阴性对照M. 500 bp DNA ladder; 1. Primer GDH1166F/GDH1346R; 2. Primer GDH874F/GDH1002R; 3. Primer GDH556F/GDH706R; 4. Primer GDH162F/GDH240R; N. Negative control图1 不同引物的RPA扩增结果Fig.1 The results of different primers detected by RPA

A. Basic-RPA反应温度优化;B. Basic-RPA反应时间优化;M. 500 bp DNA ladder; 1~6. 反应温度分别为25、30、35、37、39、45 ℃;7~14. 反应时间分别为5、10、15、20、25、30、35、40 minA. Basic-RPA reaction temperature optimization; B. Basic-RPA reaction time optimization; M. 500 bp DNA ladder; 1-6. The reaction temperature are 25, 30, 35, 37, 39, 45 ℃, respectively; 7-14. Reaction time are 5, 10, 15, 20, 25, 30, 35, 40 min, respectively图2 RPA反应温度和反应时间优化扩增结果Fig.2 Optimization of reaction temperature and time for RPA
2.3 RPA检测方法的特异性
利用优化后的RPA反应体系及条件分别对猪链球菌、肠致病性大肠杆菌、沙门菌、副猪嗜血杆菌、金黄色葡萄球菌、胸膜肺炎放线杆菌、巴氏杆菌、嗜水气单胞菌8种常见致病菌进行检测,结果显示Basic-RPA和RPA-LFD仅对猪链球菌扩增出目的产物,其他7种常见致病菌并未扩增出条带(图3)。为了进一步明确获得的扩增产物是特异的猪链球菌序列,将扩增获得的约121 bp的RPA产物分别克隆至pMD-19T载体,对鉴定为阳性的重组质粒进行测序,结果表明以上2个猪链球菌阳性样品为模板的RPA扩增产物均是特异的猪链球菌gdh基因序列,与NCBI上猪链球菌gdh基因序列的相似性为100%(数据未给出)。以上结果表明本研究建立的猪链球菌 RPA-LFD检测方法具有较强的特异性。

A. Basic-RPA;B. RPA-LFD. M. 1 000 bp DNA ladder;1. 阳性对照;2~8.肠致病性大肠杆菌、沙门菌、副猪嗜血杆菌、金黄色葡萄球菌、胸膜肺炎放线杆菌、巴氏杆菌、嗜水气单胞菌基因组检测结果;N. 阴性对照A. Basic-RPA; B. RPA-LFD; M. 1 000 bp DNA ladder; 1. Positive control; 2-8. Detection results of enteropathogenic Escherichia coli, Salmonella, Haemophilus parasuis, Staphylococcus aureus, Actinobacillus pleuropneumoniae, Pasteurella, Aeromonas hydrophila, respectively; N. Negative control图3 猪链球菌RPA检测方法特异性评价Fig.3 Specificity evaluation of RPA-LFD detection method for Streptococcus suis
2.4 RPA检测法的灵敏性
为确定RPA检测方法的灵敏性,将构建的质粒标准品pMD-18T-gdh按照10倍的比例依次稀释为1 × 107、1 × 106、1 × 105、1 × 104、1 × 103、1 × 102、1 × 101、1 × 100拷贝·μL-1。这8个浓度梯度在最佳反应条件下扩增后与PCR方法的检测结果进行对比。结果如图4所示,RPA具有比PCR更高的灵敏度,其最低检测限为100拷贝·μL-1。
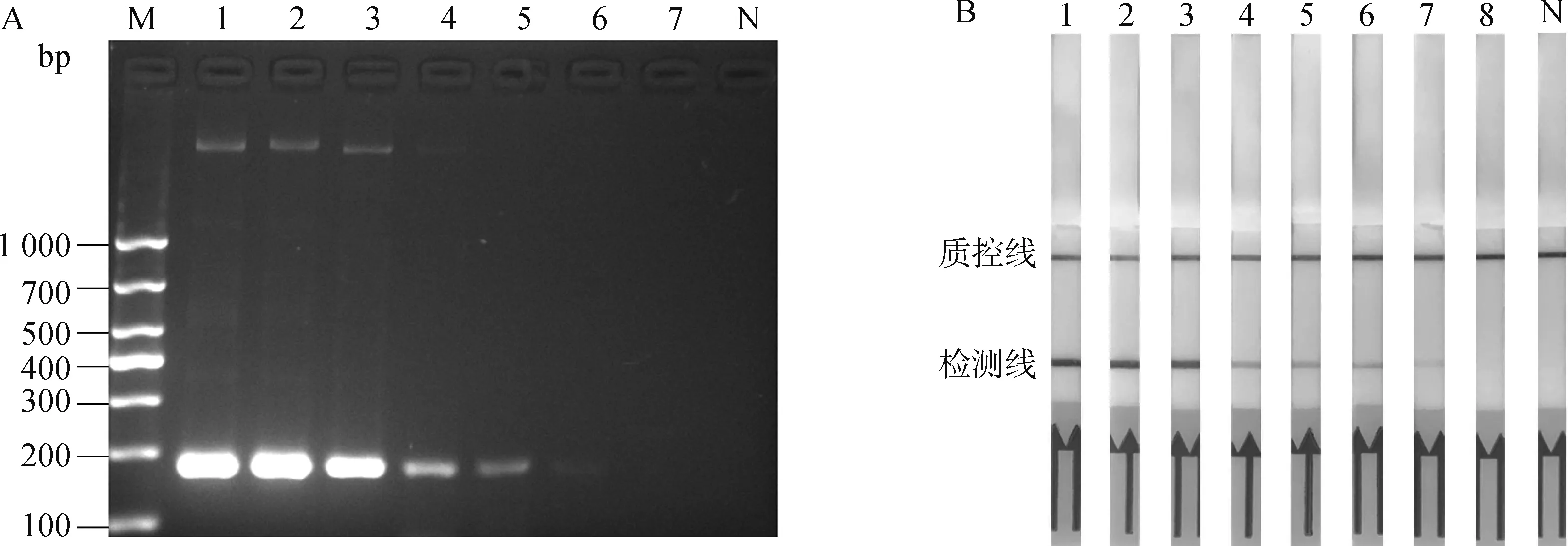
A. PCR; B. RPA-LFD;M. 1 000 bp DNA ladder;1~8. 模板DNA浓度分别为1 × 107、1×106、1×105、1×104、1×103、1×102、1×101、1×100拷贝·μL-1;N. 阴性对照A. PCR; B. RPA-LFD; M. 1 000 bp DNA ladder; 1-8. Template DNA concentrations are 1×107, 1×106, 1×105, 1×104, 1×103, 1×102, 1×101, 1×100 copies·μL-1; N. Negative control图4 猪链球菌RPA-LFD检测方法灵敏度评价Fig.4 Sensitivity evaluation of RPA-LFD detection method for Streptococcus suis
2.5 RPA检测方法的临床应用
采用建立的LFD-RPA方法检测1型菌株JZLQ036,2型菌株CVCC606、CVCC1941、JZLQ022、ZY05719、05ZYH33、JZLQ019,7型菌株JZLQ034,9型菌株JZLQ035,均可出现清晰的检测线(图5,其中JZLQ019结果未展示)。对45份疑似SS感染的临床样品,采用常规分离培养共检出阳性样品10份,多重PCR检测方法共检测出阳性样品18份,其中,2型菌株7株,7型菌株3株,9型菌株2株,分别占总样本数的15.5%、6.7%和4.4%(表2)。LFD-RPA共检出阳性样品19份,与多重PCR方法比较具有更高的检出率(表2)。

1. 1型菌株JZLQ036; 2~6. 2型菌株CVCC606、CVCC1941、JZLQ022、ZY05719、05ZYH33; 7. 7型菌株JZLQ034; 8. 9型菌株JZLQ035;9. 阴性对照1. Type 1 strain JZLQ036; 2-6. Type 2 strain CVCC606, CVCC1941, JZLQ022, ZY05719, 05ZYH33; 7. Type 7 strain JZLQ034; 8. Type 9 strain JZLQ035; 9. Negative control图5 PRA-LFD方法检1、2、7和9型菌株基因组DNA的可行性评价Fig.5 Evaluation of the feasibility of PRA-LFD method for detecting genomic DNA of type 1, 2, 7 and 9 strains

表2 不同方法在临床样本检测中的应用
3 讨 论
猪链球菌是引起猪多种疾病的重要病原,不仅造成了巨大的经济损失,而且对公共卫生构成重大威胁[27]。本研究选择高度保守的gdh基因作为诊断靶标,开发了一种具有灵敏度高,特异性强和检测普广的RPA-LFD检测方法,可方便快捷地应用于实验室和现场诊断。
在分子生物学检测方法中,准确地选择靶基因至关重要,其可直接影响检测结果的可靠性。猪链球菌菌株在各血清型内和血清型间表现出广泛的遗传异质性[23],增加了建立诊断方法的难度。gdh序列具有良好的保守性和较低的点突变率,已成功用于艰难梭菌的检测[22]。此外,猪链球菌的gdh基因在所有荚膜血清型中都高度保守,可用作诊断抗原[25]。作者前期研究选取gdh作诊断抗原,开发了PPA-ELISA和Dot-PPA-ELISA诊断方法应用于猪链球菌感染的大规模和现场诊断[12, 14]。基于gdh的PCR技术也已被用于检测猪链球菌[23, 28]。基于这些观察,本研究选择gdh为靶标建立猪链球菌RPA-LFD快速检测方法。
相较于PCR,核酸等温扩增技术提供了简化的核酸人工复制条件,仅需要恒定的温度而不需要热循环。核酸等温扩增技术不仅通过消除重复的加热和冷却步骤减少扩增的时间,还可以实现多个分子反应异步进行,大大提高了核酸扩增效率[29]。RPA是由Armes团队于2006年首次提出的一种新型核酸等温扩增技术,在37~42 ℃条件下模拟体内DNA复制过程,可实现对目标片段有效等温扩增,20 min即可完成反应,且操作简便,同时还具有特异性好和灵敏度高的特点[20,30]。基于侧流层析的结果展示可在预制的试纸条上完成,且无需任何额外设备,可在5~10 min观测结果[21]。另一方面,通过封闭式LFD检测装置判读结果可有效避免核酸产物外泄造成的假阳性污染。这些特点使PA-LFD可视化检测体系,在基层卫生部门及野外环境中,都有极大的应用潜力[31]。
PCR的加热过程可避免引物间结合引发的非特异扩增,RPA恒温反应条件的核酸扩增较易出现引物二聚体,不仅影响反应的扩增效率,而且产生的非特定信号可能影响试验结果。因此,在设计RPA反应的引物时,应竭力避免引物二聚体的产生。此外,对于RPA-nfo反应而言,探针的设计也要避免扩增过程中形成的非特异信号影响后续侧流层析的结果[32]。本研究以猪链球菌gdh基因为靶序列共设计8对RPA引物,首先利用TwistAmp-Basic试剂盒对引物进行筛选,最终选择特异性好、扩增效率高的GDH1166F/GDH1346R引物对及其探针。
筛选RPA最佳反应温度发现在30~45 ℃反应均可出现预期的RPA扩增条带,提示RPA的反应条件要求比较宽松,体温或加热水浴锅即可完成反应。这对于实验条件恶劣或经济条件较差地区的应用和推广极为有利。探索RPA最佳反应时间的结果显示,当RPA反应时间为10 min时已经开始出现目的条带,快于常规PCR方法所需的检测时间,本方法更加有利于实现快速的现场检测或野外检测。
检测技术的可信度取决于特异性。本研究建立的猪链球菌RPA-LFD检测结果显示,该检测方法与其他7种常见的病原微生物不发生交叉反应,表明该方法特异性良好。灵敏度的高低直接影响临床样本的检出率。本研究建立的RPA-LFD灵敏度试验结果显示,模板标准质粒DNA 100拷贝·μL-1时可出现清晰的检测线,该检测灵敏度约是常规PCR的10倍,说明RPA-LFD的检测方法具有更高的灵敏度。对临床样品的检测结果显示,RPA-LFD检出率高于多重PCR,表明本研究建立的RPA-LFD检测方法优于常规PCR。
4 结 论
本研究建立了针对猪链球菌的广谱RPA-LFD检测方法,有灵敏度高、特异性强、反应快速、可肉眼直接观察结果、无需大型精密仪器等优势,十分适合于现场检测或野外检测的需求,具有广阔的应用前景。
