奶牛乳腺上皮细胞的原代培养及其生物学特性分析
2022-03-08孙培皓赵鑫哲吴涵潇杨利国梁爱心
孙培皓,赵鑫哲,吴涵潇,吕 策,杨利国,2,梁爱心,2*
(1. 华中农业大学 农业动物遗传育种与繁殖教育部重点实验室,武汉 430070;2.动物遗传育种与繁殖国际联合研究中心,武汉 430070)
乳腺是哺乳动物特有的腺体组织,具有分泌乳汁的功能。腺泡是合成和分泌乳汁的基本单位,腺泡的周围紧密地排列着乳腺上皮细胞,其能将血液内的各种营养物质通过一系列过程合成乳汁[1]。同时,奶牛乳腺上皮细胞的来源丰富、采集简单,易在体外培养、扩增和导入外源目的基因[2]。因此,奶牛乳腺上皮细胞已经作为一种重要的细胞模型用于研究泌乳调控机制以及乳腺炎的发病机制。
体外获得奶牛原代乳腺上皮细胞的方法主要有3种,分别为酶消化法、组织块接种法和乳汁分离法。乳汁分离法由于乳汁中脱落的细胞数量较少,并且分离过程中对环境的要求比较高,所以并不常用[3-5]。组织块接种法能够保持细胞的二倍体活性,并且不会对细胞的活性造成影响,但获得细胞的周期较长[6-9]。目前,国外使用较多的是酶消化法,包括胶原酶Ⅰ消化法[10-11]、胶原酶Ⅱ消化法[12-13]、胶原酶Ⅳ消化法[14]、胰酶消化法[15]等。虽然奶牛乳腺上皮细胞在体外分离培养的研究已有很多年,但是体外分离培养的方法尚存在一些问题,比如用组织块接种法分离细胞时容易污染[16],而且获得完整细胞的周期太长,一般都需要14 d左右[17];酶消化法分离细胞时会浪费较多细胞,并且酶消化法对于消化时间和消化浓度都有着一定的要求,消化时间不足就无法得到足够的细胞[18-19],消化时间过长则会对细胞本身造成很大的损伤,无法得到状态完好的细胞[20-21]。本研究通过采用改进的胶原酶Ⅰ消化法体外分离培养奶牛乳腺上皮细胞,同时对所获得的细胞的生长特性与分泌功能进行检测,得到了稳定可用的奶牛乳腺上皮细胞,为后续乳腺功能的相关研究奠定坚实的基础。
1 材料与方法
1.1 试验材料
DMEM/F12培养基购自Hyclone公司,胎牛血清(FBS,fetal bovine serum)和0.25%胰蛋白酶消化液购自Gibco公司,二甲基亚砜(DMSO, Dimethyl sulfoxide)和10×吉姆萨染液购自Sigma-Aldrich公司,RNA提取试剂盒购自Omega公司(R6834-01),2×ChamQ Universal SYBR qPCR Master Mix(货号Q711-02)HiScript©Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)(货号R223-01)购自南京Vazyme公司,青霉素和链霉素购自Biosharp公司,角蛋白18 (CK18,Cytokeratin 18)抗体购自Abcam公司(ab668),酪蛋白ELISA试剂盒购自上海酶联公司,FITC山羊抗鼠二抗购自ABclonal公司(AS011),甘油三酯检测试剂盒购自南京建成生物工程研究所(A110-1),乳糖检测试剂盒Lactose/D-Galactose(Rapid) Assay Kit购自Megazyme公司,胶原酶Ⅰ、透明质酸酶、DNASe Ⅰ购自德国biofrox公司,中性蛋白酶购自上海源叶公司。
1.2 试验方法
1.2.1 奶牛乳腺上皮细胞的原代培养及纯化 从武汉屠宰场健康泌乳奶牛中采集大块的乳腺组织。采用含有5%双抗的磷酸盐缓冲液(phosphate buffered saline, PBS)清洗乳腺组织表面的血液后,置于DMEM/F12培养基中迅速带回实验室。将乳腺组织置于75%酒精中浸泡5 min,用手术剪剪除乳腺组织块中的结缔组织和脂肪组织后,将剩余组织块剪碎至肉糜状,移入离心管后,加入含有5%双抗的PBS溶液,800 r·min-1离心5 min,弃去上清,重复3次。在离心管中加入含有0.05%胶原酶I和0.05%透明质酸酶的DMEM/F12培养基,将其置于37 ℃、5% CO2培养箱中消化7~9 h,然后再用含有1%中性蛋白酶和DNA酶的胰酶消化30 min,加入含有10% FBS和1%双抗的完全培养基终止消化。随后,置于70 μm的细胞筛网过滤,将得到的滤液于1 000 r·min-1离心5 min,弃去上清,重悬后得到沉淀转移至细胞培养瓶中继续培养。培养2 ~3 d后,采用差速消化法对奶牛乳腺上皮细胞进行纯化,加入胰酶消化3 min后弃去含有成纤维细胞的消化液,随后加入培养基继续对细胞进行培养。
1.2.2 奶牛乳腺上皮细胞的形态观察 对体外培养至第6代的奶牛乳腺上皮细胞进行形态学观察,每天定时用显微镜观察细胞的形态和生长状况并拍照记录。
1.2.3 细胞免疫荧光 选取第6代的细胞制作细胞爬片,用4%多聚甲醛固定10 min后,用0.1%的Triton x-100透化10 min,清洗后用5% BSA封闭1 h,随后加入1∶100稀释的CK18一抗于4 ℃孵育过夜,之后用1∶200稀释的FITC标记的二抗避光孵育2 h,加入DAPI(4,6-二脒基-2-苯基吲哚, 4′,6-diamidino-2-phenylindole)染色液避光孵育10 min 后,用抗荧光淬灭封片剂进行封片。最后,在激光共聚焦荧光显微镜下观察CK18的表达并拍照。
1.2.4 染色体核型分析 选取第6代的细胞传至6孔细胞培养板中,贴壁后用含有0.2 μg·mL-1秋水仙素的培养液继续在37 ℃、5% CO2培养箱中培养6~8 h,之后用胰蛋白酶消化分离细胞,随后用0.075 mol·L-1的KCl低渗溶液于37 ℃处理25 min, 再用固定液固定8 min,800 r·min-1离心10 min,重复固定3次。将预冷的载玻片倾斜45°滴加细胞悬液,之后将载玻片在酒精灯上掠过,室温放干,用吉姆萨溶液进行染色,用封片剂进行封片,最后在100×油镜下观察染色体数量和形态变化。
1.2.5 细胞的生长曲线测定 将传代至第3、第6、第9代的细胞接种到24孔板中,传板后1、2、3、4、5、6、7、8和9 d后分别用血细胞计数板进行计数,并绘制细胞生长曲线。
1.2.6 细胞群体倍增曲线测定 将传代至第3、第6、第9代的细胞接种到24孔板中,传板后1、2、3、4、5、6、7、8和9 d后对细胞进行计数,按照公式T=t× [lg2/(lgNt-lgN0)][22]计算细胞在对数生长期间的群体倍增时间。其中,Nt是计算时细胞的最终数量,N0是细胞的初始数量,t是细胞的生长时间。
1.2.7 细胞冻存复苏活力测定 选取生长状态良好的第3、第6和第9代细胞,按照细胞传代的方法来获得细胞沉淀,同时采用血细胞计数方法对冻存的细胞进行计数。随后按照每个冻存管1 mL冻存液 (DMSO∶FBS=1∶9)分装细胞,将冻存细胞复苏24 h后进行细胞计数,按下列公式计算冻存复苏活力[23]。
冻存复苏活力=(复苏后24 h细胞贴壁数量/冻存前的细胞数量)×100%。
1.2.8 乳腺上皮细胞分泌功能的检测 用诱导培养基(成份为10% FBS,1%双抗,89%的DMEM/F12培养基和10 ng·mL-1催乳素、10 ng·mL-1表皮生长因子、5 mg·mL-1转铁蛋白、5 mg·mL-1牛胰岛素、1 mg·mL-1氢化可的松)对乳腺上皮细胞诱导培养2 d后,收取细胞上清液。参照ELISA试剂盒说明书测定上清液中α酪蛋白、β酪蛋白和κ酪蛋白的含量,板内变异系数小于10%,板间变异系数小于15%。同时,参照细胞甘油三酯试剂盒说明书测定上清液中甘油三酯的含量;参照Lactose/Galactose(Rapid)乳糖试剂盒说明书测定上清液中乳糖的含量。
1.2.9 荧光定量PCR检测 使用RNA提取试剂盒提取诱导培养后第3、第6、第9代乳腺上皮细胞的总RNA,根据HiScript©Ⅱ Q RT SuperMix for qPCR试剂盒说明书将RNA反转成cDNA,最后使用实时荧光定量PCR检测泌乳相关基因的表达,参考ChamQ Universal SYBR qPCR Master Mix荧光定量PCR试剂说明书检测泌乳相关基因的表达量。采用Primer 5 软件设计泌乳相关基因以及内参基因GAPDH的引物序列,由擎科创新生物科技有限公司合成,基因引物序列详见表1。实时荧光定量PCR的反应体系为10 μL:SYBR Green PCR Master Mix 5 μL,上、下游引物各0.5 μL,cDNA模板1 μL,ddH2O 3 μL;反应条件为95 ℃预变性1 min; 95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸30 s, 进行40个循环。以GAPDH作为内参基因,采用2-ΔΔCt的分析方法计算基因的相对表达量。
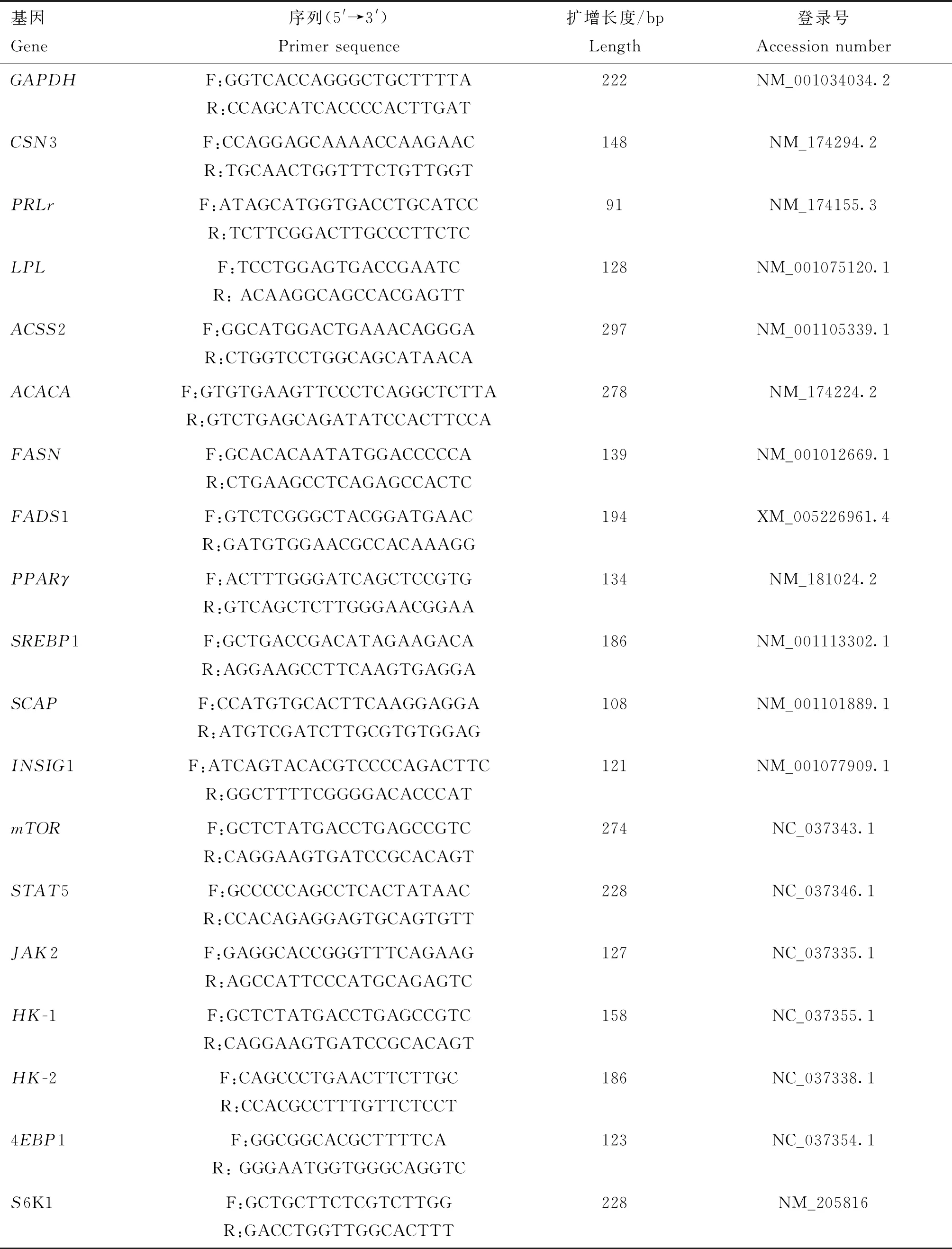
表1 引物序列
1.2.10 数据分析 每个试验至少重复3次,采用GraphPad Prism 8软件作图,多组之间样本采用单因素方差分析中的Turkey检验进行多重比较,试验结果采用“平均数±标准误”表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 乳腺上皮细胞原代培养及纯化
采用改进的酶消化法获得的细胞在消化后2 d基本上贴壁完全,可见乳腺上皮细胞与成纤维细胞混合生长,其中乳腺上皮细胞呈圆形,符合乳腺上皮细胞的基本形态;成纤维细胞呈梭形,符合成纤维细胞的基本形态 (图1A和1B)。用胰酶消化4 min后,可见培养瓶内成纤维细胞被消化,剩余细胞大多为乳腺上皮细胞,经过多次差时消化后,所获得细胞基本上全部是乳腺上皮细胞。

A. (10×); B. (20×)。乳腺上皮细胞中混有少量成纤维细胞,箭头所指为成纤维细胞A.(10×); B. (20×). Mammary epithelial cells mixed with a small amount of fibroblasts, the arrow points to fibroblasts图1 奶牛乳腺上皮细胞的原代培养Fig.1 Primary culture of bovine mammary epithelial cells
2.2 乳腺上皮细胞的形态观察
通过观察纯化后乳腺上皮细胞的形态,发现贴壁3 d后,细胞形态呈现出“鹅卵石”状 (图2A);贴壁5 d后,细胞相互聚集,出现类似于“拉网状”结构(图2B~C)。随着培养时间的延长,细胞逐渐出现空泡状结构(图2D~E),直至最后出现 “圆顶状”结构(图2F)。
2.3 乳腺上皮细胞的鉴定
由荧光共聚焦显微结果(图3)可以看出,分离纯化培养的奶牛乳腺上皮细胞大小清晰,且图中FITC染色的细胞质与DAPI染色的细胞核可以完全重合,表明CK18仅在细胞质中表达且该细胞为乳腺上皮细胞。阴性对照细胞质中没有绿色荧光,表明本研究所培养的乳腺上皮细胞具有很高的纯度。
2.4 乳腺上皮细胞染色体核型分析
对第6代乳腺上皮细胞进行染色体核型分析,由图4可以看出,所分离奶牛乳腺上皮细胞的染色体条数为60条,与奶牛的染色体条数一致,并且1对X染色体较为明显(箭头所指),表明分离到的乳腺上皮细胞的染色体没有发生变异(图4)。
2.5 乳腺上皮细胞生长曲线
分别取第3、第6和第9代奶牛乳腺上皮细胞,经过连续9 d的细胞计数后,根据细胞数量绘制生长曲线。结果表明,所取3代细胞的生长曲线都成“S型”,其中,3个代次之间细胞的生长速度差异不显著(图5)。
2.6 乳腺上皮细胞群体倍增时间
根据细胞计数的结果并按照公式计算出处于对数生长期细胞的群体倍增时间。由图6可知,随着培养代次的增加,群体倍增时间随之增加。其中,第3代细胞的倍增时间最短,第9代细胞的倍增时间极显著高于第3和第6代的倍增时间(P<0.01)。
2.7 乳腺上皮细胞冻存复苏活力
分别对3个代次细胞的冻存复苏活力进行计算,发现3个代次细胞复苏后24 h贴壁率相近。其中,第3代细胞的24 h贴壁率为92.59%,第6代细胞为88.99%,第9代细胞为90.37%(图7),3个代次细胞的冻存复苏活力间没有显著差异(P>0.05)。

A.细胞培养第3天,呈现出鹅卵石状(10×);B.培养第5天,细胞开始形成拉网状(10×);C.培养第7天,基本形成拉网状结构(10×);D.培养第10天,出现大量空泡状结构(10×);E.空泡状结构(20×);F.圆顶状结构(40×)A. After 3 days of culture, cells showed a typical cobblestone shape (10×); B. After 5 days of culture, the cells began to form a mesh structure (10×); C. After 7 days of culture, the cells formed the mesh structure (10×); D. After 10 days of culture, cells appeared a large number of alveoli-like structures (10×); E. Alveoli-like structures (20×); F. Dome-like structures (40×)图2 培养不同天数乳腺上皮细胞的形态结构Fig.2 Morphological structure of mammary epithelial cells cultured for different days
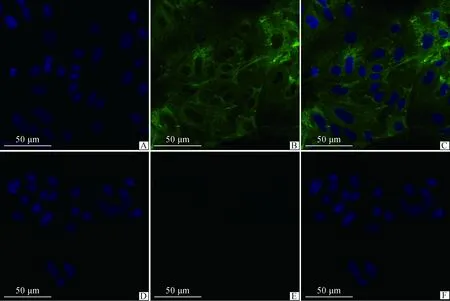
A.DAPI染色的细胞核(40×);B.CK18染色(40×);C.A、B图的组合图片 (40×);D.阴性对照的DAPI染色(40×);E.阴性对照的FITC染色(40×);F.阴性对照的组合图(40×)A. Nucleus stained with DAPI(40×); B. Cell stained with cytokeratin18(40×); C. Merge picture of figure A and B(40×); D. DAPI staining of negative control(40×); E. FITC staining of negative control(40×); F. Merge picture of negative control(40×)图3 乳腺上皮细胞的角蛋白18染色Fig.3 The CK18 staining of mammary epithelial cells

图4 奶牛乳腺上皮细胞的染色体核型分析Fig.4 Chromosome karyotype analysis of bovine mammary epithelial cells
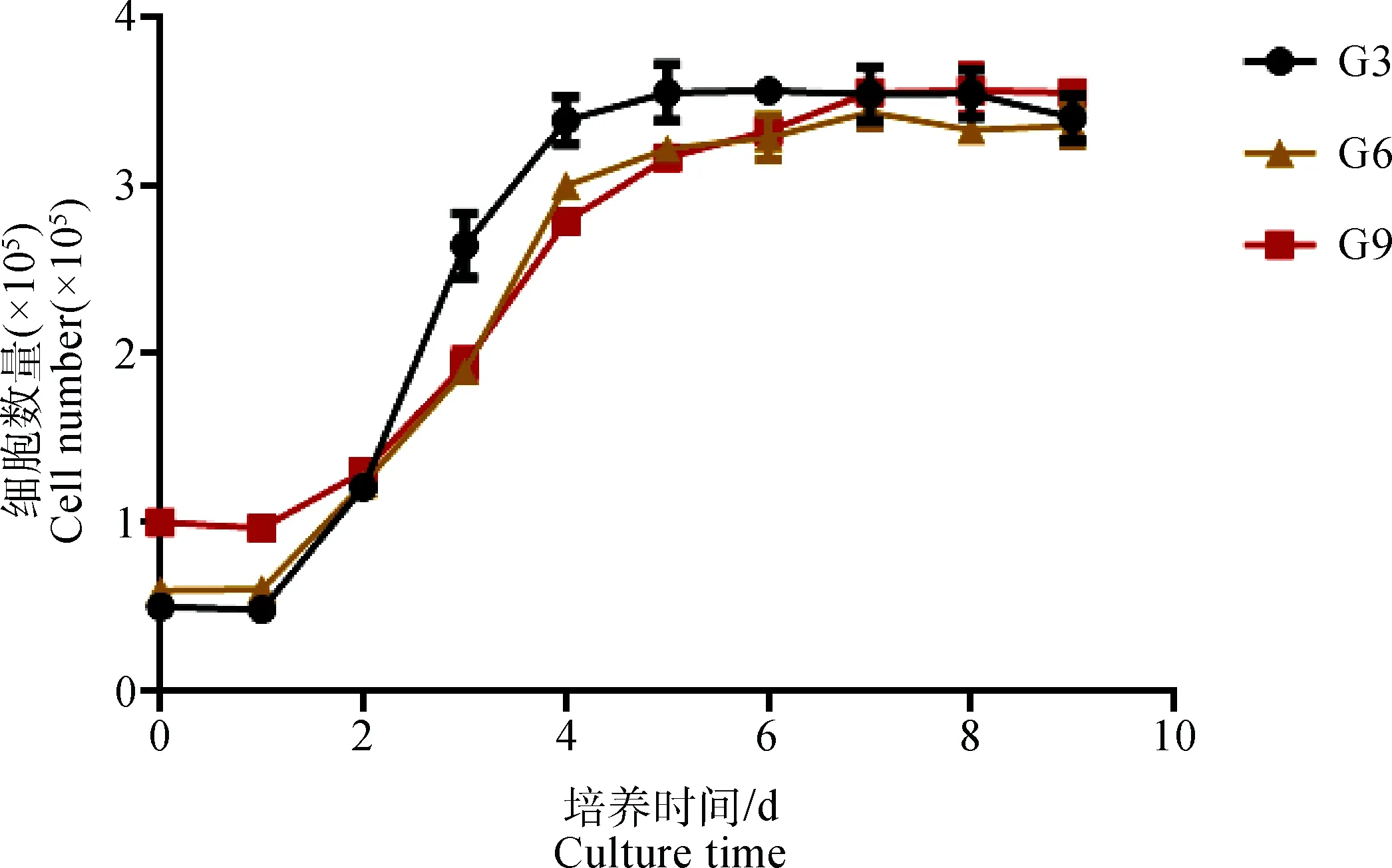
图5 不同代次细胞的生长曲线Fig.5 Cell growth curves of different generations

*. P<0.05, **. P<0.01,下同*. P<0.05, **. P<0.01, the same as below图6 细胞群体倍增时间Fig.6 Cell population doubling time

图7 不同代次细胞的冻存复苏活力Fig.7 Cell resuscitation rate of different generations
2.8 乳腺上皮细胞分泌功能的检测
采用诱导培养基培养不同代次乳腺上皮细胞48 h后,检测上清中乳蛋白、乳脂和乳糖的分泌。结果显示,所培养的奶牛乳腺上皮细胞均能诱导α酪蛋白、β酪蛋白、κ酪蛋白、甘油三酯和乳糖的合成与分泌,且3个代次细胞分泌α、β、κ酪蛋白的含量无显著性差异(P>0.05,图8A-C)。同样地,3个代次细胞所分泌的甘油三酯和乳糖的含量均无显著性差异(P>0.05,图8D和8E)。
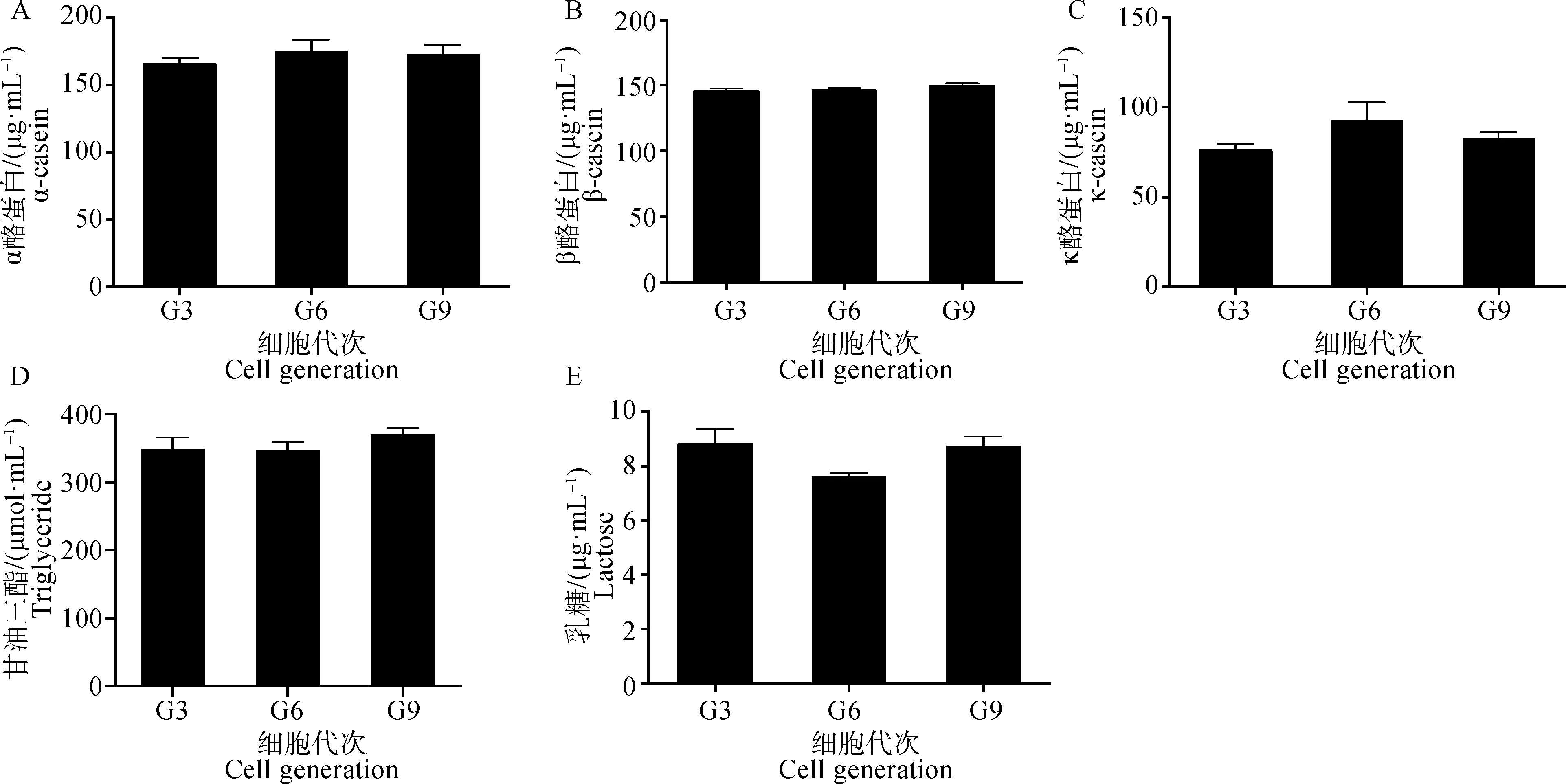
A. 3个代次细胞上清液中α酪蛋白的含量;B. 3个代次细胞上清液中β酪蛋白的含量;C. 3个代次细胞上清液中κ酪蛋白的含量;D. 3个代次细胞上清液中甘油三酯的含量;E. 3个代次细胞上清液中乳糖的含量A. The content of α-casein in the supernatant of 3 generations of cells; B. The content of β-casein in the supernatant of 3 generations of cells; C. The content of κ-casein in the supernatant of 3 generations of cells; D. The content of triglyceride in the supernatant of 3 generations of cells; E. The content of lactose in the supernatant of 3 generations of cells图8 上清液中酪蛋白、甘油三酯和乳糖的含量Fig.8 The contents of casein, triglyceride and lactose in the supernatant
2.9 泌乳相关基因的表达
通过RT-qPCR检测第3、第6、第9代细胞中与乳汁合成相关基因的表达量。结果如图9所示,所检测的与乳蛋白合成相关基因CSN3、PRLr的表达量、与乳脂合成相关基因ACACA、FASN、SCD、FADS1、LPL、PPARγ、ACSS2、INSIG1、SREBP1的表达量和与乳糖合成相关基因HK-1、HK-2的表达量均无显著性变化(P>0.05);在与乳蛋白合成相关的通路基因中,随着培养代次的增加,S6K1基因的表达呈现上升趋势,且第6代和第9代细胞中S6K1基因的表达均极显著高于第3代细胞(P<0.01),而JAK2、4EBP1、mTOR、STAT5基因的表达在各代次间并没有显著差异(P>0.05)。
3 讨 论
采用酶消化法培养原代细胞时,控制消化酶的浓度和时间是关键。为了能稳定高效地从组织块中消化分离出状态良好的细胞,本研究参考了Anand等[23]使用的方法,使用胶原酶Ⅰ和透明质酸酶进行第一步消化,而后使用中性蛋白酶和DNA酶进行第二步消化,但是在试验过程中发现按照此方法进行分离只能获得少量的细胞,推测可能是消化时间不足导致难以获得大量细胞。因此,本研究在消化时间上加以改进,将消化时间从3 h左右延长到8 h,从而稳定地获得了奶牛乳腺上皮细胞,并且细胞的形态完好,具有良好的生物学功能。同时发现,在分离时如果能够尽量在消化前将乳腺组织周围的结缔组织和脂肪组织去除,取中心带有腺泡的小组织块,获得的细胞中只有少量成纤维细胞,绝大多数都为乳腺上皮细胞。
本研究首先对纯化后的奶牛乳腺上皮细胞的形态进行了观察,所获得的细胞在刚贴壁时呈现出鹅卵石铺路状,贴壁一段时间后就会呈现出拉网状,结果与之前有关乳腺上皮细胞形态的报道相一致[24-28]。另外,本研究还发现了乳腺上皮细胞具有独特的空泡状和圆顶状结构,而这些结构在之前一些研究中也有报道[29-34]。原代乳腺上皮细胞贴壁后会相互聚集在一起,而类似空泡状的结构则是在培养10 d左右才会大量增多,推测这些特有结构是因细胞老化而产生,圆顶状结构则是多个空泡状结构聚集在一起所形成的。角蛋白18(CK18)作为上皮细胞的标志性蛋白被广泛用于鉴定乳腺上皮细胞[23,33],CK18的大量表达表明了所培养乳腺上皮细胞的纯度很高。此外,染色体核型分析的结果表明所获得的乳腺上皮细胞的染色体数目并没有发生改变,染色体形态也符合前人研究结果[28]。
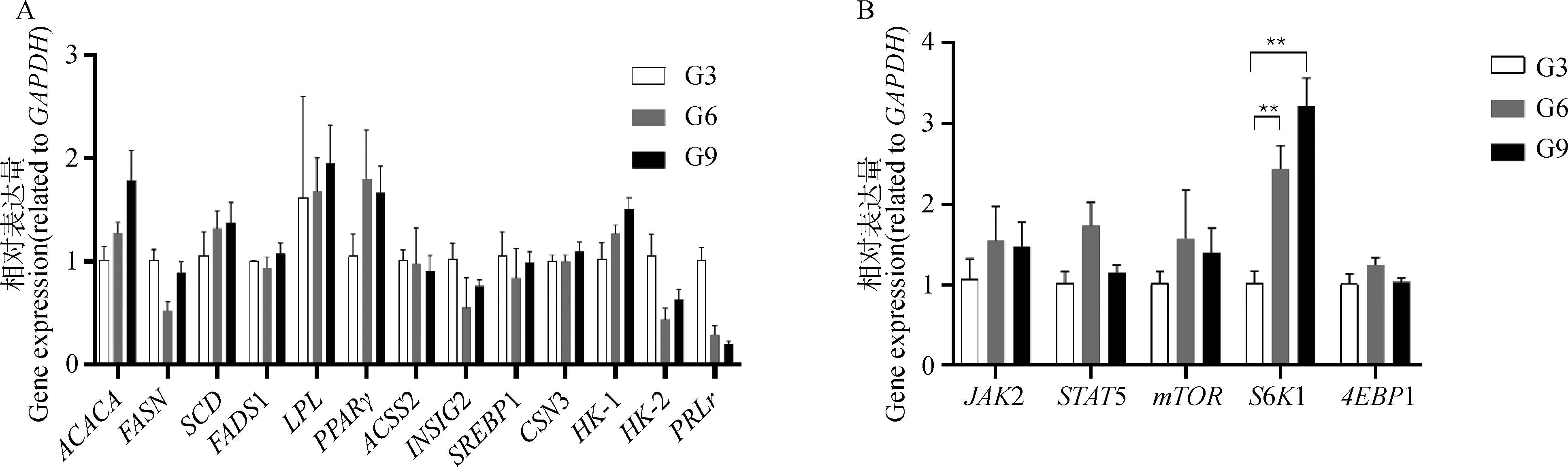
A. 与乳汁合成相关基因的表达;B. 与乳蛋白合成相关通路基因的表达A. Related genes expression of milk synthesis; B. Signaling pathway related genes expression of milk protein图9 乳汁合成相关基因的表达Fig.9 mRNA expression of milk synthesis related genes
本研究中,第9代细胞的生长速度与前人通过酶消化法所得4、5代细胞生长速度类似,而本研究所测量的第3、第6代细胞的生长速度则明显快于前人的结果[35],可能是因为本研究所用消化酶的浓度和时间对细胞的损伤比较少,细胞的状态完好。本次试验中的细胞群体倍增时间处于34 ~ 65 h之间,此前有试验分离的奶牛乳腺上皮细胞群体倍增时间处于38 ~44 h之间[32],而本次试验中的第3和第6代的奶牛乳腺上皮细胞的群体倍增时间分别为34.87和41.45 h,与前人所得结果一致。
酪蛋白是体外培养乳腺上皮细胞是否具有分化功能的重要标志,且随着培养代次的不断增加,乳腺上皮细胞会逐渐逆分化,形态会发生改变,分泌功能也会逐渐降低[36]。为此本研究只选取了9代及之前代次细胞鉴定其分泌功能。研究发现,3个代次的细胞均可分泌3种酪蛋白(α、β、κ)、甘油三酯以及乳糖,且在3个细胞代次之间无显著性差异,与前人所报道的奶牛乳腺上皮细胞在10代之前基本上分泌量没有明显差异的结果相一致[36-38]。通过分析与乳成分合成相关基因的表达,发现相关基因的表达在3个代次间没有显著差异,进一步支撑了乳成分在3个代次间没有变化的结果。
在对原代乳腺上皮细胞功能的鉴定中,鲜见有对乳汁合成相关通路基因的报道。在乳汁合成过程中,mTOR信号通路控制着乳蛋白相关基因的翻译,mTOR通过负调控4EBP1、正调控S6K1促进乳蛋白的合成[39-41]。本研究发现,mTOR和4EBP1基因的表达量在3个代次之间并没有明显的差异,但S6K1的表达量随着代次的增加呈现上升趋势。然而,S6K1表达量的上升并未引起α、β、κ酪蛋白的增加,推测可能是S6K1磷酸化水平没有变化或S6K1没有被激活。值得注意的是,与乳汁合成相关的JAK2-STAT5通路中的JAK2和STAT5的表达量在3个代次间均无显著性变化。
4 结 论
本试验通过改进的酶消化法成功获得了形态好、纯度高的原代奶牛乳腺上皮细胞,且细胞培养至第9代仍具有良好的生长特性与分泌功能,可为进一步研究乳腺的功能和泌乳机制提供强有力的支撑。
