铅、锌污染下蜀葵的生长生理响应和富集转运特性研究
2022-03-08段亚萍付丽童李雨倩
段亚萍, 赵 冰, 付丽童, 李雨倩, 张 瑛
(西北农林科技大学风景园林艺术学院, 陕西 杨陵 712100)
随着大面积的矿区开采和工业的发展,国内铅、锌污染问题日趋严重[1]。铅、锌毒性大、具有较强的累积性和流动迁移性,可通过食物链传递到动物和人体中[2],对生物多样性和人类健康构成严重威胁,因此,针对铅、锌等重金属污染的治理亟待解决。植物修复技术作为一种新兴的土壤修复技术,成本低廉、修复面积广、操作方便、二次污染易控制,并且具有保护土表,美化植被环境等优点[3-5],是现阶段最重要的土壤修复技术之一,具有广阔的发展前景。目前,对超积累或耐性植物修复重金属污染进行了较多筛选研究,但这些植物多因生物量小、生长速度慢,观赏价值较低且受地域的影响较强等问题在实际应用中受到限制,导致修复重金属污染效果不理想[6]。当前,寻找生物量大、适应性强、观赏价值高、耐重金属且生态幅更广的植物十分具有现实意义。
蜀葵(Alcearosea(Linn.)Cavan.)属锦葵科蜀葵属,是优良的园林观赏花卉品种,花期长、花瓣大且花型和花色众多,观赏价值极高。虽为草本但高可达2米,生物量大,生长适应性强健,在全国各地均有分布,不受地域限制,并且对土壤中单一重金属铅、锌胁迫有较强的耐受性[7-8]。在现实环境中,单一重金属污染比较少见,大多数情况下,往往是多种污染物复合对环境产生污染[9],且重金属间存在协同或拮抗作用[10],不仅抑制种子萌发和根系生长,影响植物光合速率,使植物叶片变黄,甚至导致植物死亡。超富集植物和耐性植物可以采取一些策略以进行自我保护,向日葵(HelianthusannuusL.)的根系能够吸收并积累土壤中的重金属[11],雪里蕻(Brassicajuncea(L.) Czern.)通过调节体内酶防御系统降低Pb-Cd胁迫[12],将Pb区隔在生物解毒组分(金属富集颗粒组分和热稳定蛋白组分)中是油菜(BrassicanapusL.)富集Pb的重要耐性机制[13]。然而目前对蜀葵铅、锌复合污染下的重金属富集特性和耐性解毒机制尚不明确。
本文以铅、锌复合污染土壤为研究对象,以蜀葵为研究材料,通过盆栽试验研究不同浓度铅、锌单一及复合污染下蜀葵的生长生理响应和富集转运特性,以期探明植物抵抗铅、锌复合污染毒性的机制,进而为选用蜀葵生态修复铅、锌等重金属污染土壤提供科学依据。
1 材料与方法
1.1 试验地概况及试验材料
1.1.1试验地概况 试验土壤取自陕西杨凌田间表层土壤(0~15 cm),其基本理化性质如下:pH值7.44;水解性氮112 mg·kg-1;有效磷7.80 mg·kg-1;速效钾219 mg·kg-1;铅26.5 mg·kg-1;锌149.85 mg·kg-1。试验于西北农林科技大学温室进行(北纬34°15′49″,东经108°3′42″)。
1.1.2试验材料 蜀葵种子采自陕西省咸阳市杨凌渭河湿地公园,在4℃黑暗干燥条件下保存。选择健康且一致的种子,在0.1%的NaClO溶液中浸泡15分钟。用蒸馏水清洗干净,将其播种于干净基质内,生长2个月后,将生长健壮、长势一致无病虫害的蜀葵幼苗移植至装有试验土壤的花盆中。
试验用Pb(NO3)2和ZnSO4·7H2O及其他化学试剂为分析纯,HNO3和H2O2均为优级纯。
1.2 试验设计
收集的土样去除大颗粒石块和植物残骸,在干燥通风的地方风干后过4 mm筛,按表1将不同剂量组合的Pb(NO3)2和ZnSO4·7H2O溶液加入土壤中,充分混匀后室外平衡一个月,作为模拟不同浓度的重金属污染土壤。试验土壤装入塑料盆(230 mm×170 mm)中,每盆装有6 kg风干土。每个浓度(组合)处理3棵植株,所有试验重复3次。

表1 试验设计Table 1 Experiment design
试验于2020年11月7日开始,试验期间定期浇水,保持70%的田间持水量。温室的平均温度保持在20℃至25℃之间,不添加其他光源,光照时间为每天10 h。定期调整各花盆的位置,以排除环境位置引起的误差。花盆底部放置塑料托盘,避免污染物的渗透损失。植株连续生长50 d后进行收获。
1.3 指标测定及方法
1.3.1形态观测 试验期间,对蜀葵植株的外部形态进行观测记录,包括植株高度、茎长、叶片的长度和宽度。
1.3.2生物量测定 植株收获后,所有样品用蒸馏水和超纯水进行彻底清洗,之后将植株分成根、茎、叶部分,沥去水分,于105℃下杀青20 min,然后在70℃下烘至恒重。用电子天平测定其干生物量。将其他植物鲜样保存在-80℃用于进一步的生理分析。
1.3.3生理指标测定 叶绿素含量和类胡萝卜素含量采取丙酮提取法进行测定,脯氨酸含量测定采用酸性茚三酮比色法测定[14-15],超氧化物歧化酶(Superoxide dismutase,SOD)活性采用氮蓝四唑光还原法测定,过氧化物酶(Peroxidase,POD)活性采用愈创木酚法测定,过氧化氢酶(Catalase,CAT)活性采用过氧化氢分解法测定[16]。
1.3.4铅、锌含量测定 将干燥的样品研磨成均匀的粉末并过2 mm的筛。精确称量0.2 g植物样品和0.1 g土壤样品,将其添加至装有6 mL浓HNO3的微波消解槽中,在微波消解仪(MA165-001,Italy)中进行消解。消解完成后,定容至50 mL容量瓶中,采用火焰原子吸收光谱仪(PinaACIIE,American PE900)测定金属的浓度。
计算蜀葵的富集系数、富集量和转移系数用于评价植株对Pb(Zn)的富集能力和转运能力,公式如下:
富集系数(Bioconcentration coefficient,BCF)=植株体富集的Pb(Zn)浓度/土壤中Pb(Zn)浓度×100%
转运系数(Translocation coefficient,TF)=植物地上部Pb(Zn)浓度/植物地下部Pb(Zn)浓度×100%
Pb(Zn)富集量=Pb(Zn)浓度×植株体生物量
1.4 数据统计与分析
试验所有结果表示为平均值±标准误。采用SPSS 26.0进行数据统计分析,使用LSD法以P<0.05的显著性水平进行差异显著性检验。使用Origin 2018进行数据绘图。
2 结果与分析
2.1 铅、锌胁迫下蜀葵的生长响应
铅浓度为1 000 mg·kg-1时,蜀葵叶片边缘稍稍卷曲,个别叶片枯黄凋落,表现出轻微伤害,但是仍能正常生长;在2 000 mg·kg-1的铅胁迫时,位于基部的整个叶片出现黄化卷曲现象。在单一锌污染浓度为600 mg·kg-1时,蜀葵的植株增高,大叶数量增多;而当锌浓度为1 200 mg·kg-1时,植株明显矮化。在铅锌复合胁迫下,铅500 mg·kg-1+锌300 mg·kg-1时,蜀葵植株生长良好,叶片浓密;与单一胁迫相比,在其他处理下植株变矮,叶片出现不同程度的萎蔫、黄化甚至干枯现象。
铅、锌胁迫对蜀葵生长形态的影响如表2所示。与对照组相比,不同浓度铅污染条件下,蜀葵植株的高度呈现先上升后下降的趋势。植株的最大高度为31.45 cm(Pb500+Zn300),较对照组提高了9.05%。植株的最小高度为17.75 cm (Zn300),是对照组植株高度的61.55%。当锌污染浓度为600 mg·kg-1时,蜀葵植株最长的茎长长度显著大于对照组(P<0.05),最长的茎长长度为26.18 cm(Zn600),与对照相比提高了38.48%,最短的茎长长度为15.55 cm(Pb2000+Zn1200),与对照相比减少了17.72%。不同浓度铅、锌污染下蜀葵最大叶片的宽度无显著差别。当铅污染浓度为500 mg·kg-1时,蜀葵叶片的长度最大(18.49 cm),是对照组的116.58%。蜀葵叶片的长度最小为14.45 cm(Pb2000+Zn1200),相比对照减少了8.89%。
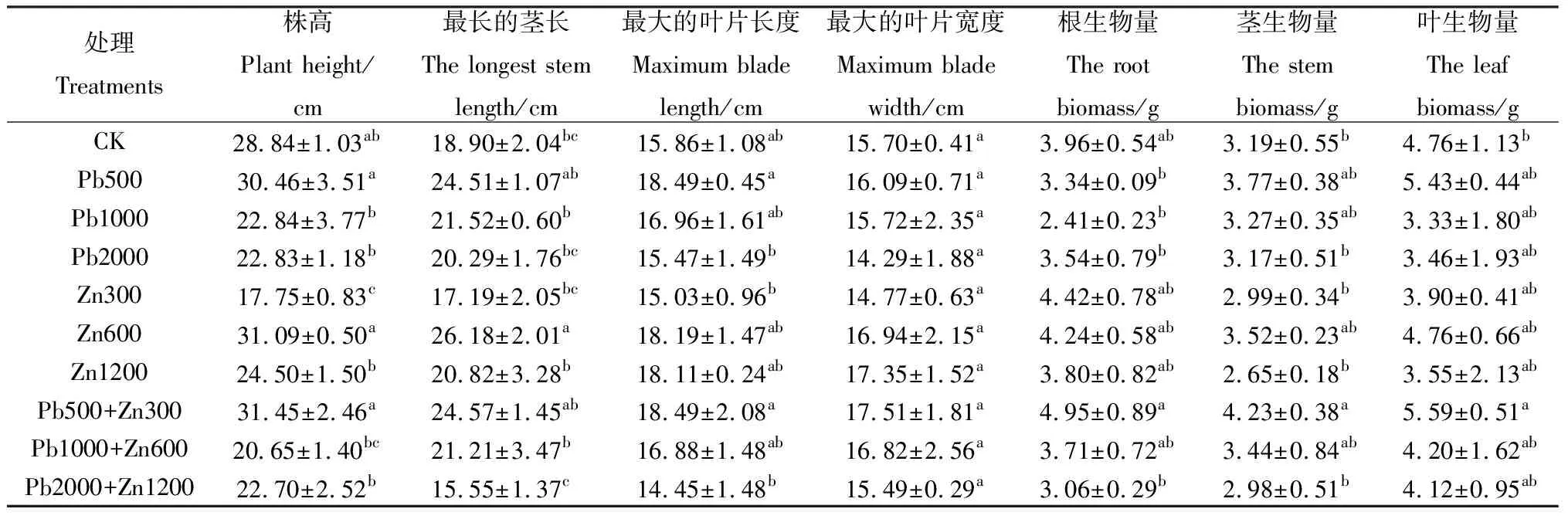
表2 不同处理下蜀葵的生长参数Table 2 The growth parameters of Alcea rosea under different treatments
在不同浓度单一铅污染条件下,各处理之间蜀葵植株的根、茎、叶生物量无显著差异,在铅污染浓度为500,1 000 mg·kg-1时,植株的叶生物量>茎生物量>根生物量。在铅污染浓度为500 mg·kg-1,锌污染浓度为300 mg·kg-1时,蜀葵植株根生物量达到最大值(4.95 g)。在复合污染条件下,植株表现为叶生物量>根生物量>茎生物量。
2.2 铅、锌胁迫下蜀葵的生理响应
蜀葵叶片中的叶绿素a、叶绿素b、类胡萝卜素含量如图1所示。在不同浓度的污染条件下,植株的叶绿素a和类胡萝卜素含量无显著差异,其中,叶绿素a含量最高为0.90 mg·g-1(Pb1000),是对照组的109.76%。同时,在不同浓度的单一污染及复合污染条件下,植株的叶绿素a和叶绿素b含量之比也呈现先上升后下降的趋势。

图1 不同处理下蜀葵叶片中光合色素含量的变化Fig.1 Photosynthetic pigment content changes in leaves of Alcea rosea under different treatments注:不同小写字母表示处理间差异显著(P<0.05);下图同Note:Different lowercase letters indicate significant differences between the different treatments at the 0.05 level;this is applicable for the figures below as well
蜀葵叶片中脯氨酸的含量如图2a所示。与对照相比,不同浓度铅污染下蜀葵的脯氨酸含量均存在显著差异(P<0.05),且呈现先上升后下降的趋势,其脯氨酸的含量分别是对照组的266.88%(Pb500),374.60%(Pb1000),350.10%(Pb2000)。单一锌污染以及复合污染条件下,蜀葵的脯氨酸含量也显著增加(P<0.05)且变化趋势一致。值得注意的是,复合污染条件下蜀葵的脯氨酸含量均显著低于其单一铅污染条件下的含量。蜀葵最高的脯氨酸含量出现在Pb1000组(1 657.55 μg·g-1),最低含量出现在Pb500+Zn300组(345.28 μg·g-1)。
由图2b可知,当单一铅污染浓度达到2 000 mg·kg-1时,蜀葵植株的SOD活性呈现下降的趋势,其最高值为2.24 U·g-1·h-1,是对照组的107.69%。在单一锌污染条件下,不同处理组之间的SOD值呈现逐渐上升的趋势。而铅锌复合污染下,蜀葵的SOD值则显著低于单一铅污染下的SOD值(Pb2000+Zn1200除外)(P<0.05)。如图2c所示,单一铅污染条件下,蜀葵植株中POD活性与对照组相比均有显著差异(P<0.05)。当土壤中单一锌污染浓度达到1 200 mg·kg-1时,植株中POD活性含量与对照相比显著增大(P<0.05),增幅为11.58倍,表明当土壤中锌浓度达到一定值时,植株中POD活性大大增加。在铅锌复合污染条件下,POD活性含量与单一铅污染相比存在显著差异(P<0.05)。如图2 d所示,与对照组相比,蜀葵植株中的CAT活性呈现显著差异(P<0.05),最高的CAT活性为6.24 U· g-1· h-1(CK),最低的CAT活性为1.8 U·g-1·h-1(Pb500+Zn300)。

图2 不同处理下蜀葵叶片中Pro含量及SOD,POD和CAT活性的变化Fig.2 Content of Pro and activities of SOD,POD and CAT changes in leaves of Alcea rosea under different treatments
2.3 铅、锌胁迫下蜀葵的富集转运特性研究
为了研究污染条件下蜀葵植株各组织对土壤中铅、锌的富集情况,本研究测定了不同浓度铅、锌污染土壤下蜀葵干燥组织中的铅、锌含量(图3)。由图3可知,蜀葵对铅、锌均有一定的富集能力。在单一铅污染以及复合污染条件下,蜀葵根、茎组织中的铅含量随铅胁迫的增加而随之升高。在铅污染浓度为1 000和2 000 mg·kg-1时,蜀葵植株不同组织中的铅含量表现为根部>茎部>叶部。在低浓度的铅锌复合污染条件下(Pb500+Zn300),植株叶部和茎部中的铅积累相比单一铅污染条件下显著降低(P<0.05),铅更多地富集在植株根部,随着铅浓度的提高,植株叶部和茎部中的铅积累呈现上升趋势。在锌污染条件下,随着锌污染浓度的提高,蜀葵地上部和地下部的锌含量也显著上升(P<0.05)。在低浓度锌污染条件下(Zn300),蜀葵根部富集更多的锌,随着锌污染浓度的提高,蜀葵植株不同组织中的锌含量表现为叶部>根部>茎部。在Pb1000+Zn600和Pb2000+Zn1200组,与单一锌处理相比,铅的加入减少了植株叶部和根部中的锌积累。
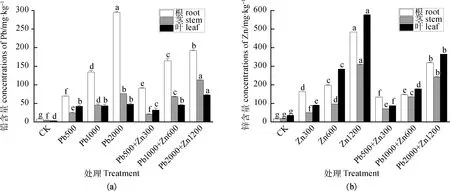
图3 不同处理下蜀葵不同部位的铅、锌含量Fig.3 The Pb and Zn concentration in different plant parts of Alcea rosea under different treatments
重金属的富集系数(BCF)反映植物富集土壤重金属的能力[17]。重金属的转移系数(TF)反映了植物从根部向地上部转移重金属的能力。由表3可以看出,蜀葵对土壤锌的富集系数显著大于铅(P<0.05),单一污染条件下,蜀葵对锌的富集系数均大于1,对铅的富集系数均小于1(对照组除外)。而在复合污染条件下,添加锌浓度为600 mg·kg-1时,蜀葵的BCFPb相比单一铅污染条件下有显著提高(P<0.05)。而对于锌而言,恰恰相反,复合污染条件下蜀葵的BCFZn相比单一锌污染条件下则有显均下降(P<0.05)。另外,蜀葵对锌的转移系数也远远大于铅,除Zn300组之外,蜀葵对锌的转运系数均大于1,对铅的转运系数均小于1(对照组除外)。单一铅污染条件下,随着铅浓度的增加,蜀葵对铅的转运系数逐渐降低,复合污染条件下TFPb值呈上升趋势,TFZn则呈下降趋势。蜀葵对铅的富集量如表3所示,最小值为0.19 mg(CK),当单一铅污染浓度达到2 000 mg·kg-1时,蜀葵铅富集量最大,为4.27 mg。当锌污染浓度为300 mg·kg-1和600 mg·kg-1时,土壤中铅的加入对蜀葵锌的富集量无显著影响,蜀葵对锌的最大富集量为13.72 mg(Zn1200),最小富集量为0.84 mg(CK)。

表3 不同处理下蜀葵的富集系数(BCF)、富集量和转运系数(TF)Table 3 Enrichment factor (BCF),accumulation and transport factor (TF) in Alcea rosea under different treatments
3 讨论
3.1 铅、锌胁迫对蜀葵生长的影响
生长状况是反映蜀葵对铅、锌胁迫耐受程度的直观指标[18-19]。曲豪杰等[20]指出,铅是对植物有害的元素,锌是人类和植物体中不可或缺的元素[21],当植株内重金属含量超过自身阈值时就会对其产生毒害作用,破坏植物细胞结构,抑制细胞的分裂和生长,影响植物的正常生长,甚至导致植物死亡。本研究发现,当铅浓度超过1 000 mg·kg-1,锌浓度超过600 mg·kg-1时,蜀葵植株开始出现黄叶和枯叶,植株变矮,生物量减少。同时,低浓度单一铅污染以及复合污染能够促进植株生长,表现出明显的“低促高抑”现象,这与朱秀红等[22]认为低浓度可刺激植株生长,低浓度下植物体内活性氧自由基含量升高,可刺激蛋白酶,调节合成以及诱导基因表达,进而促进细胞分裂和增殖,宏观表现为刺激生长的结论相同。在单一锌污染条件下,蜀葵的生长表现出一定的波动性,说明在设计的浓度范围内,锌对植物的生长作用不是有规律的变化,有待进一步研究才能总结出更为准确的规律,马娟霞[23]的研究也说明了这一点。高浓度复合污染处理下植株的生长发育受到更大影响,表明铅、锌复合污染对植株的毒性更大。
3.2 铅、锌胁迫对蜀葵生理生化的影响
叶绿素是植物进行光合作用的主要色素,其含量的变化直接影响植物的光合作用。不同处理下,蜀葵的叶绿素a含量无显著差异,表明试验设计的重金属浓度还未达到蜀葵耐受的阈值。对照国家土壤环境质量标准,本试验设计浓度已属于高浓度梯度,这说明蜀葵对铅、锌污染具有较强的耐受能力。叶绿素a与叶绿素b含量之比是评判植物衰老的参数,其下降幅度大小表明植物衰老的快慢。铅、锌污染条件下,蜀葵的叶绿素a与叶绿素b含量之比呈现先上升后下降的趋势,表明随着重金属污染浓度的增加,蜀葵植株的衰老速度也随之增快。
脯氨酸作为调节植物体内渗透平衡和维持水分平衡的物质,可对逆境胁迫产生响应,降低重金属对植物造成的毒害,同时作为抗氧化剂还具有清除活性氧和保护蛋白质结构的作用[24]。在本研究中,不同处理下蜀葵植株叶片中脯氨酸的含量相比对照组有显著增加(P<0.05),表明在重金属胁迫下,蜀葵植株有一定的忍耐机制,比如螯合作用和区室化作用。复合污染胁迫下,蜀葵叶片中的脯氨酸含量显著低于单一铅污染条件下的脯氨酸含量(P<0.05),可能是胁迫压力下,叶片中部分脯氨酸发生降解来维持植物体内的代谢平衡,此时由体内的可溶性糖和可溶性蛋白对细胞中的渗透压和水分进行调节,并提供所需要的能量。
过量铅、锌浓度的存在会影响植株的新陈代谢,诱导产生更多的活性氧,破坏植株体内复杂的抗氧化防御系统,从而影响蜀葵的正常生长[25]。本研究中,不同处理下蜀葵叶片中POD活性显著增加(P<0.05),表明其可能是蜀葵细胞内应对重金属胁迫的重要机制,可以保护植物免受重金属诱导的氧化损伤[26]。在不同浓度铅污染条件下,SOD活性呈现先上升后下降的趋势,表明低浓度污染条件下,蜀葵叶片的细胞膜系统被破坏,导致代谢紊乱,积累较多自由基,从而诱导SOD活性的增加,随着铅污染浓度的增加,蜀葵植株逐渐适应,自由基减少,从而降低了自由基活性。而铅胁迫下槐树(Styphnolobiumjaponicum(L.) Schott)则表现出SOD活性增加但POD活性不变[27],这表明抗氧化酶活性在不同的植物种类中表现不同。不同处理下,蜀葵植株中的CAT活性降低,可能是胁迫下植株生长下降和氧化胁迫增强的原因,前人研究也观察到一些逆境条件下植株的CAT活性下降[28],从而导致较高的氧化应激反应。
3.3 铅、锌胁迫对蜀葵积累特性的影响
植物对重金属的吸收富集主要包括两种方式:一种是植物将大部分的重金属积累在根部以避免植物的吸收转运,这为外排机制;另一种是植株主动吸收重金属,并将其转运至地上部,其体内存在某种特殊的解毒机制以避免重金属的毒害,这称为植物的积累和区室化作用[29]。本研究结果表明,单一铅污染及复合污染条件下,铅主要积累在蜀葵的根部,只有小部分转移到茎部和叶部,说明蜀葵对铅的解毒以外排机制为主。在锌污染条件下,蜀葵植株不同组织中的锌含量表现为叶部>根部>茎部,且蜀葵对锌的富集能力强于铅,说明蜀葵体内对锌的解毒以积累和区室化作用为主。
植物对重金属的富集和转运受到重金属种类、浓度和土壤等因素的影响。本研究发现,蜀葵对锌的富集能力强于铅,这可能是因为锌可以参与植物的光合作用[30],而铅的负电性较高,易与土壤中有机质、碳酸盐等物质结合生成难以利用的惰性结合物,且植物内皮层细胞上的凯氏带可能阻碍铅向其他植物组织中输送[31]。
富集系数和转移系数是衡量超富集植物的重要特征,为提高植物修复的效果,富集系数和转运系数都应大于1。而不同处理下蜀葵的BCFPb和TFPb皆小于1,在单一锌污染条件下,虽然蜀葵BCFZn和TFZn皆大于1,但有关超富集植物的界定目前采用最多的是Baker[32]和Brooks[33]在1983年提出的参考值,茎或叶富集铅的临界含量为1 000 mg·kg-1,锌的临界含量为10 000 mg·kg-1,显然蜀葵并未达到超富集植物的标准,所以不能认定为超富集植物。但是蜀葵生长速度快,适应性强,相比中华结缕草(ZoysiasinicaHance)、望江南(Sennaoccidentalis(Linnaeus) Link)和水蓼(PolygonumhydropiperL.)等生命力旺盛且富集转运能力强的草本植物[34],蜀葵属于低富集低转运型等,表现出对铅、锌较强的耐性。
另外,复合污染条件下,不同重金属间的相互作用会影响植株对其的富集与转运。已有研究显示,铅、锌复合污染对青杨(PopuluscathayanaRehd.)和北京杨(Populus×beijingensisW. Y. Hsu)的生物量和色素含量无显著影响,且铅、锌在吸收富集上表现出协同效应[35]。对油菜而言,铅、锌在共存条件下体现为拮抗作用,抑制油菜对铅、锌的吸收和富集[36]。本研究结果表明,铅、锌复合污染条件下,锌促进了铅的吸收,而铅的加入减少了植株对锌的吸收。这是因为根表面上的一些吸附位点可以被铅占据,相应地锌的吸附位点将减少。此外,铅不仅可以作为载体的二价阳离子进入,并且可以通过运输蛋白质的方式进入植物细胞[37-38]。当铅污染浓度大于1 000 mg·kg-1,锌污染浓度大于600 mg·kg-1时,铅、锌复合胁迫抑制了蜀葵的生长,且污染浓度越大,抑制作用越明显。可见,铅、锌复合污染时增强了重金属对蜀葵的毒害作用,两者具有协同效应[39]。
4 结论
蜀葵对铅、锌污染具有较强的耐性,在形态上植株表现出一定的“低促高抑”现象,低浓度的污染促进植株增高、叶片增大,随着铅、锌浓度的增加,蜀葵的生长逐渐受到抑制,植株变矮,部分叶片黄化干枯。在生理上,蜀葵的渗透调节物质增多,过氧化物酶(POD)活性增加的同时过氧化氢酶(CAT)活性减少,可更有效地应对重金属对植株的毒害作用。在重金属积累上,蜀葵对锌表现出更强的富集和转运能力。植株将铅主要累积在根部,将锌主要累积在叶部,从而使其具有更强的应对铅、锌污染的潜力。同时,铅、锌复合污染增强了重金属对蜀葵的毒害作用,两者表现出协同效应。综上,蜀葵具有修复铅、锌污染土壤的应用潜力。
