一株猫泛白细胞减少症病毒的分离鉴定
2022-03-08刘成倩刘惠莉梁洪宇孙凤萍易建中
刘成倩,李 红,刘惠莉,梁洪宇,孙凤萍,高 骏,易建中
(上海市农业科学院畜牧兽医研究所,上海 201106)
猫泛白细胞减少症(Feline panleukopenia,FP)也称猫瘟热、猫细小病毒病,是由猫泛白细胞减少症病毒(Feline panleukopenia virus,FPV)引起的一种高度接触性急性传染病。FPV 在1928年首次被发现,1935年正式命名为猫泛白细胞减少症病毒[1-2]。FPV 可引起患病动物高热、呕吐、腹泻和白细胞明显减少等症状,是目前肉食兽细小病毒中感染范围最宽、致病性最强的一种[3]。
FPV 属于细小病毒科、细小病毒属成员,病毒粒子在电子显微镜下呈圆形或六边形,无囊膜结构,核衣壳为轴对称的二十面体[4]。随着细小病毒的不断遗传进化,病毒DNA 基因组序列也随之发生变异,其宿主选择性、跨物种传播、自然重组等生物学特性存在改变的可能[5]。细小病毒基因组主要编码非结构蛋白NS1、NS2 和结构蛋白VP1、VP2。VP2 蛋白是构成衣壳蛋白的主要成分,是主要的抗原蛋白,决定病毒的血凝活性,具有介导细小病毒感染宿主细胞的作用[6-7]。本试验从上海某宠物医院采集疑似感染FPV 的猫粪便样品,接种F81 猫肾细胞进行病毒分离,并对分离株VP2 基因及全基因组进行遗传进化分析,以期有效预防和控制该病毒。
1 材料与方法
1.1 细胞与主要试剂
F81 猫肾传代细胞购自武汉普诺赛生命科技有限公司;2 ×taq mix、2 × Phanta Max Master Mix 购自南京诺唯赞生物科技股份有限公司;病毒核酸提取或纯化试剂购自上海星耀医学科技发展有限公司。FITC标记山羊抗小鼠IgG 二抗购自北京依珊汇通科技有限公司。Hoechst 33342 染色液购自北京索莱宝科技有限公司。
1.2 病料的采集与处理
猫粪便样品采集于上海某宠物医院,经FPV 试纸条检测为阳性。在采集的粪便样本中加入5 倍体积的PBS,充分混匀,反复冻融3 次后离心取上清,过0.22 μm 滤膜,备用。
1.3 病毒的分离与培养
采用同步接毒法将过滤后的样品上清按细胞培养液总体积的10%接种F81 细胞,置于CO2体积分数为5%的37 ℃恒温培养箱,盲传4 代时细胞病变达80%,此时收毒,反复冻融3 次后收集上清,备用。
1.4 分离毒株PCR 鉴定
参考丁轲等[8]的方法设计特异性引物, 引物预扩增片段大小559 bp。序列为FPV-F:GAATCTGCTACTCAGCCACCAAC,FPV-R:GTGCACTATAACCAACCTCAGC,由上海捷瑞生物工程有限公司合成。提取分离株第4 代F81 细胞培养物的DNA,病毒DNA 的提取根据病毒核酸提取或纯化试剂盒说明书进行。
1.5 间接免疫荧光试验
将培养瓶中单层F81 细胞消化传代并铺96 孔板,将分离病毒同步接种到F81 细胞中,72 h 后弃掉培养基,用4%多聚甲醛固定细胞30 min,PBST 缓冲液洗3 次,以小鼠抗FPV VP2 单克隆抗体为一抗,以FITC 标记山羊抗小鼠IgG 为二抗,分别进行孵育清洗后,每孔加入50 μL Hoechst 33342 染色液,进行细胞核的DAPI 染色,室温作用15 min,PBST 缓冲液洗3 次,使用荧光倒置显微镜观察荧光情况。
1.6 分离株全基因组序列测定
根据GenBank 已刊载的FPV 全基因组序列,利用Primer premier 5.0 软件设计5 对引物用于FPV 全基因分段扩增,引物序列见表1。PCR 反应体系:DNA 模板2 μL,2 × Phanta Max Master Mix 25 μL,上、下游引物各2 μL,ddH2O 19 μL。PCR 反应条件:95 ℃3 min;95 ℃30 s,55 ℃30 s,72 ℃60 s,循环35 次;72 ℃延伸10 min。PCR 产物经凝胶回收后送铂尚生物技术(上海)有限公司测序。将测序正确的5 段FPV基因序列拼接组装成全基因组序列。

表1 引物序列Table 1 Primer sequences
1.7 分离株VP2 基因的克隆
根据GenBank 已刊载的FPV 全基因组序列,利用primer premier 5.0 软件,设计l 对扩增VP2 基因的引物,引物序列为FPV-VP2-F:AGAGACAATCTTGCACCAAT,FPV-VP2-R:ATGTTAATATAATTTCTAGGTGCT。PCR 反应体系:DNA 模板2 μL,2× Phanta Max Master Mix 25 μL,FPV-VP2-F∕R(10 μmol∕L)各2 μL,ddH2O 19 μL。PCR 反应条件:95 ℃3 min;95 ℃30 s,55 ℃30 s,72 ℃60 s,循环35 次;72 ℃延伸10 min。
将PCR 扩增产物经1.2%琼脂糖凝胶电泳鉴定后,利用DNA 凝胶回收试剂盒回收片段,之后连接pEASY-T1 克隆载体,挑选阳性克隆进行测序鉴定。
1.8 全基因组及VP2 基因变异分析
用DNAstar 软件包中的SeqMan 软件对获得的基因序列进行校对和编辑,利用MegAlign 软件进行同源性分析并建构进化树。
2 结果与分析
2.1 病毒分离
经无菌处理过的粪便样品接种F81 细胞进行病毒分离。在盲传第2 代时出现20%的细胞病变(Cytopathic effect,CPE),细胞主要表现为圆缩、拉丝,第4 代时病变更明显,对照组细胞界限完整,形态均一(图1)。将其命名为FPV-SH05-2020。

图1 感染FPV-SH05-2020 株的F81 细胞CPE(200 ×)Fig.1 CPE in F81 cells infected by FPV-SH05-2020 strain(200 ×)
2.2 病毒的PCR 鉴定
用检测引物FPV-F∕R 对分离病毒基因组DNA 样品进行PCR 扩增,得到的扩增片段约559 bp(图2),与预期相符。
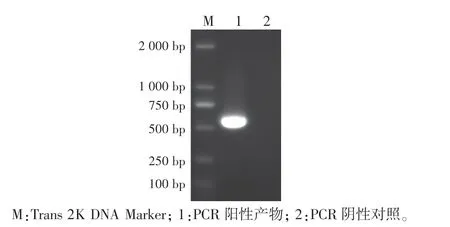
图2 分离病毒基因组的PCR 扩增鉴定Fig.2 PCR analysis of viral DNA genome
2.3 间接免疫荧光试验
将分离得到的FPV-SH05-2020 接种F81 细胞,培养48 h 后,进行间接免疫荧光试验,并利用细胞核的DAPI染色法进行观察。发现接毒细胞呈现绿色荧光,说明该分离毒株能与FPV VP2 抗体发生特异性反应(图3)。
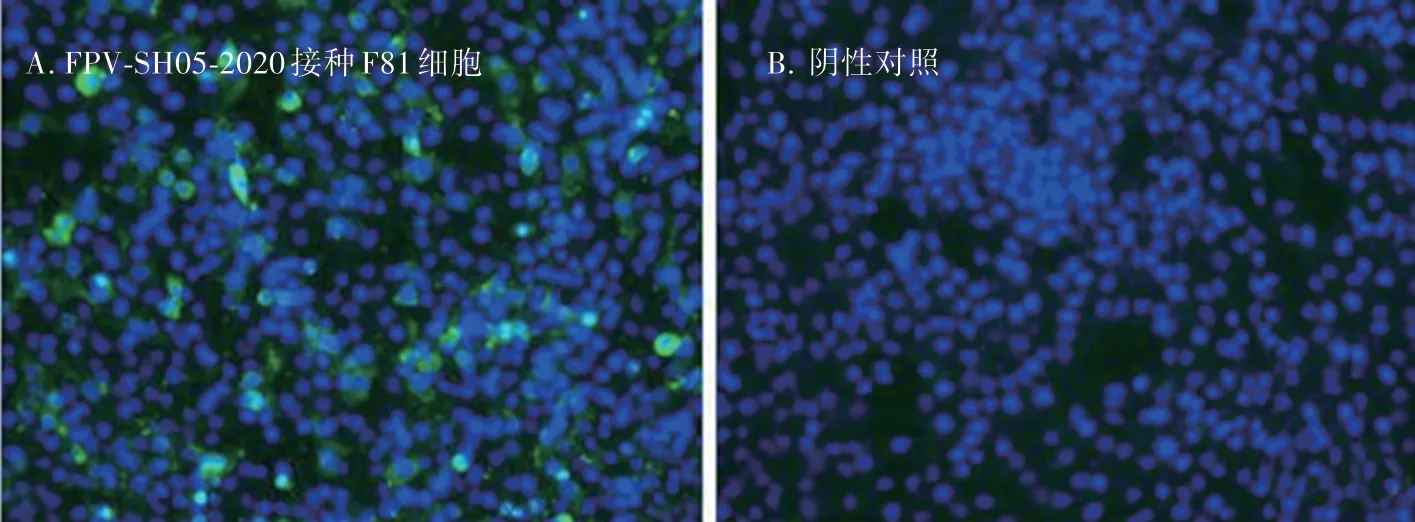
图3 间接免疫荧光检测F81 细胞感染分离株FPV-SH05-2020(400 ×)Fig.3 IFA for the detection of virus isolate FPV-SH05-2020 infection F81 cells(400 ×)
2.4 全基因组序列测定
分5 段进行分离株FPV-SH05-2020 全基因组序列的扩增,凝胶电泳结果显示,扩增条带分别为1 022 bp、937 bp、974 bp、1 056 bp、1 209 bp,与预期结果相符(图4)。对扩增的5 个片段进行测序拼接后,获得基因组片段全长为4 614 bp。

图4 分离株FPV-SH05-2020 全基因组分段扩增Fig.4 Segmental Amplification of complete genome of FPV-SH05-2020 isolate
2.5 VP2 基因扩增及测序
用引物FPV-VP2-F∕R 扩增VP2 全基因序列,凝胶结果显示,扩增条带约1 700 bp(图5)。测序结果使用DNAstar 软件拼接后,显示FPV-SH05-2020 株的VP2 基因全长1 755 bp,与预期相符。

图5 VP2 基因序列扩增Fig.5 Amplification sequence of VP2 gene
2.6 VP2 基因主要氨基酸位点分析
使用DNAstar MegAlign 软件将测序结果与GenBank 登录的FPVVP2 氨基酸序列进行比对,选取FPV-18LY0902 和FPV-JL03 作为参考毒株,重点分析决定宿主特异性的第80、93、103、323、564、568 位氨基酸位点,结果显示,本次分离的毒株VP2 基因上第80(K)、93(K)、103(V)、323(D)、564(N)、568(A)位氨基酸完全符合FPV 的序列特征(表2)。
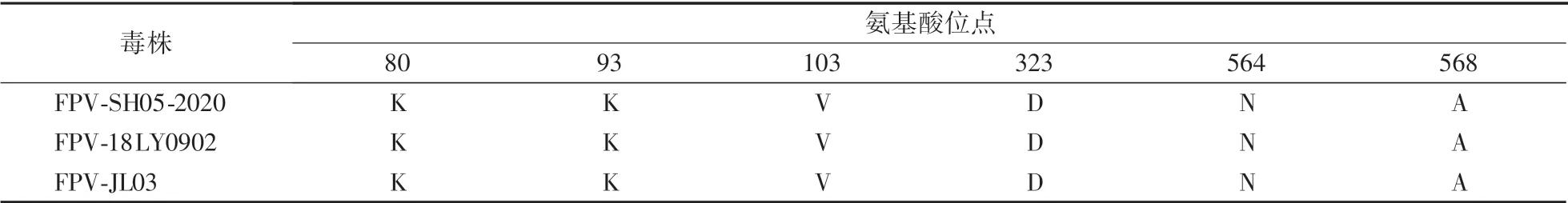
表2 VP2 基因中主要氨基酸位点分析Table 2 Analysis of major amino acid sites of the VP2 gene
2.7 VP2 基因及全基因组氨基酸同源性与遗传进化分析
使用MegAlign 软件将分离株的VP2 基因序列与GenBank 中的参考株序列进行氨基酸同源性分析,结果表明,分离株FPV-SH05-2020 的VP2 基因与参考毒株的VP2 氨基酸序列同源性为98.3%—99.9%。由图6 可知,本次分离的FPV-SH05-2020 毒株与中国株MN908257 和MT614366 亲缘关系较近。

图6 分离株FPV-SH05-2020VP2 基因系统进化树Fig.6 Phylogenetic tree of VP2 gene from FPV-SH05-2020 isolate
使用MegAlign 软件将分离株的全基因组序列与GenBank 中的参考株进行氨基酸同源性分析,结果表明,本次分离株FPV-SH05-2020 的全基因组与参考毒株的全基因组氨基酸同源性为94.2%—98.8%。由图7 可知,本次分离株FPV-SH05-2020 与中国株MN908257 和MT614366 亲缘关系较近。
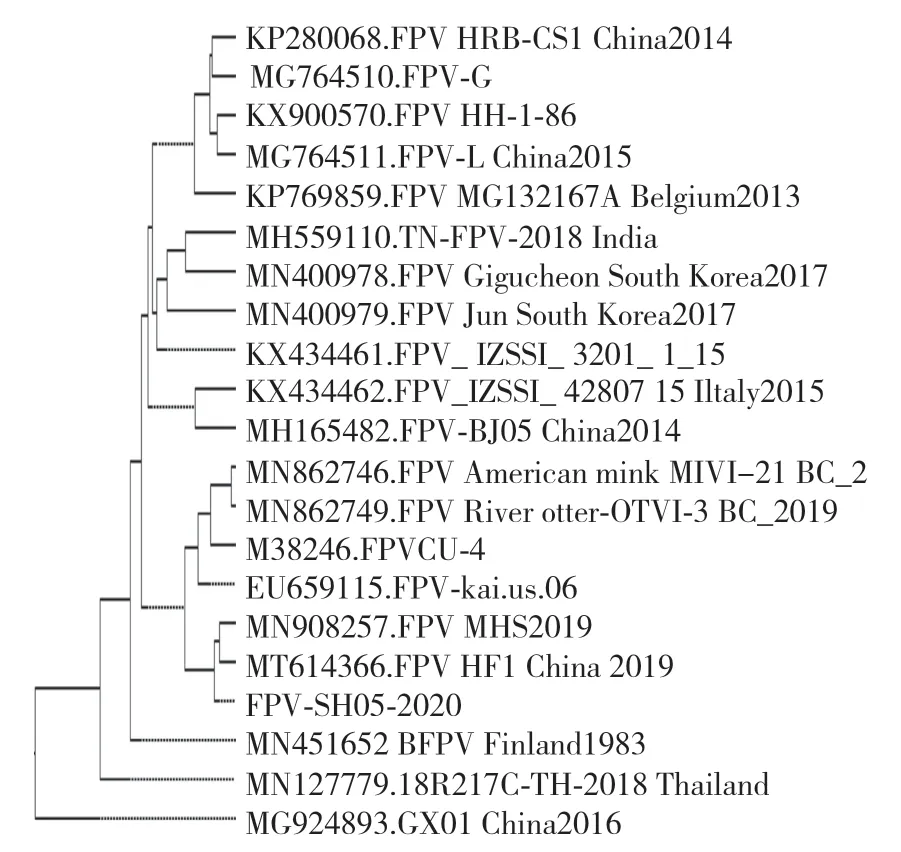
图7 分离株FPV-SH05-2020 全基因组系统进化树Fig.7 Phylogenetic tree of complete genome of FPV-SH05-2020 isolate
3 讨论与结论
FP 在猫群中的发病率相对较高,该病也在不断发生遗传进化,因此监测该病毒在我国的流行变异情况,对防治该病及研制有效疫苗具有重要意义。FPV 为单股线状DNA 病毒,在形态学和抗原性上与犬细小病毒(CPV)、貂肠炎病毒等都非常相似[9]。FPV 全长约5 000 bp,FPV 基因组包括2 个开放阅读框,目前研究最多的是VP2 结构蛋白,VP2 蛋白是主要免疫功能区,可刺激动物机体产生中和抗体,为FPV 的主要免疫保护性抗原蛋白,也是决定FPV 的血凝性和宿主范围的蛋白[10]。FPV VP2 蛋白的第80 位、93 位、103 位、323 位、564 位、568 位氨基酸位点是决定分离株抗原性和宿主性的关键位点,这几个关键位点的变化会改变其抗原特性和宿主范围[11]。
本试验从疑似感染FPV 的猫粪便样品中分离出1 株病毒,将其命名为FPV-SH05-2020。与对照组相比,分离株在第2 代时出现少量病变,在第4 代时出现80%以上的病变,主要表现为细胞圆缩、拉丝、脱落。通过分段扩增获得分离株FPV-SH05-2020 基因组全长,为4 614 bp;获得VP2 基因全长1 755 bp,编码584 个氨基酸。VP2 基因与参考毒株的VP2 基因氨基酸同源性为98.3%—99.9%,全基因组与参考毒株的全基因组氨基酸同源性为94.2%—98.8%。从氨基酸同源性来看,VP2 基因同源性高于全基因组的同源性,说明FPV 的VP2 基因遗传进化较为保守。犬猫细小病毒衣壳蛋白VP2 基因的突变已被证实会影响不同抗原变体的进化,其中第80 位、564 位、568 位氨基酸位点与FPV 能否在猫体内繁殖有关,而第93位、103 位、323 位氨基酸位点影响CPV 在犬内繁殖[12]。本试验对分离株的这6 个关键氨基酸位点进行比较分析,发现这6 个位点未发生突变,符合FPV 的序列特征。本研究有助于完善上海地区FPV 遗传进化情况,为FPV 毒株分子流行病学研究、疫苗研发等奠定基础。
