不同温度条件下淹水胁迫对不结球白菜植物激素的影响
2022-03-08李晓锋奚丹丹朱玉英朱红芳
高 璐,李晓锋,奚丹丹,朱玉英,朱红芳
(上海市农业科学院设施园艺研究所,上海 201403)
植物在生命周期内受诸多非生物胁迫因子的影响。中国南方地区以热带、亚热带季风气候为主,夏季高温多雨,洪涝灾害频繁,是湿涝最为严重的地区,对植物地上部分的物质分配和产量造成严重影响[1]。淹水胁迫对植物的植株形态、生理和代谢过程等均产生影响,如呼吸作用受到抑制,净光合速率等光合作用相关指标下降,抑制能量代谢,产生有毒有害物质,导致植物的生长发育变缓甚至引起死亡[2-3]。高温胁迫则通过植物内源激素的含量的变化,从而影响植物体生长代谢,改变植物对外界环境的抗逆性[4],因此,高温和淹水胁迫是植物生命周期的主要非生物胁迫。植物激素是植物体内自身代谢所产生的一类具有高度生物活性的有机小分子化合物,在植物生命发育的整个周期均有调控作用,还能对外界环境的刺激做出相应的反应。ABA(脱落酸)和ETH(乙烯)加速植物的衰老,IAA(生长素)、GA(赤霉素)、CTK(细胞分裂素)降低植物的衰老速度,推动PA(多胺)的生成[5]。此外,程维国[5]研究表明,PA 的积累能够使水稻尽快适应高温。徐江民等[6]研究表明,外源喷施GA 能通过某些途径抑制水稻叶片中MDA 的产生,从而延缓叶片衰老。
不结球白菜(Brassica campestrisssp.chinensisMakino)原产中国,又称青菜、小白菜、油菜等,属于十字花科芸薹属芸薹种白菜亚种,是生活中重要的叶菜类蔬菜。不结球白菜根系浅,喜冷凉气候,根际淹水条件下根系活力下降,与呼吸作用相关的酶活性下降,且夏季高温下,蒸腾作用大,生长缓慢,容易失水致死[7-8]。本研究针对不结球白菜生长发育中因环境因素导致的实际问题,考察高温和淹水胁迫下不结球白菜植物激素的变化规律,以期从植物激素变化规律角度探讨不结球白菜对高温和淹水胁迫的适应性,旨在为不结球白菜夏季设施及露地栽培、选育耐涝品种等提供理论依据。
1 材料与方法
1.1 试验材料
以耐涝性较弱的‘苏州青’和耐涝性较强的‘黑油冬’为材料。这2 个品种叶片深绿,直立性好,具有较强抗病性和耐寒性,商品性状优良,均由上海市农业科学院设施园艺研究所青菜课题组提供。
1.2 试验方法
种子播种于塑料营养钵中,选用蚯蚓土育苗,将幼苗放在塑料大棚内进行培养。待幼苗长到3 叶1 心时,取0 h 时样品,在人工气候培养箱内进行高温和淹水处理,以正常生长24 ℃为对照,将植株置于35 ℃、40 ℃的培养箱内,空气湿度为60%,光周期为12 h∕12 h。在24 ℃、35 ℃、40 ℃下,分别对2 个品种进行淹水处理。淹水处理即水面超过土层表面约1 cm,以浸没植株根部为宜,每天及时加水,确保淹水高度,对不淹水处理组进行常规的水分管理。在人工气候培养箱处理48 h 后,将幼苗解除胁迫移至塑料大棚内恢复5 d。分别在6 h、12 h、24 h、48 h 和恢复期进行取样,保存在-20 ℃冰箱,用于后续植物激素指标的测定。共6 个处理3 次重复,每盆作为1 次重复,每次重复取1 株。
1.3 植物激素含量测定
采用酶联免疫分析(ELISA)[9]对不结球白菜样品中的IAA、GA、ABA、ETH、CTK、PA 激素进行测定,应用双抗体夹心法测定样品中植物激素的水平。用纯化的植物激素捕获抗体包被微孔板,制成固相抗体,往包被的微孔中依次加入植物激素,再与HRP 标记的检测抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。TMB 在HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的植物激素呈正相关。用酶标仪在450 nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中植物激素的含量(试剂盒来自上海酶联生物科技有限公司)。
1.4 数据处理
采用Excel 2010 软件进行数据的整理和方差分析,用Origin 8.0 软件作图,运用Duncan's 新复极差法进行差异性检验,并对各数据进行相关性分析。
2 结果与分析
2.1 高温处理对激素含量的影响
2.1.1 高温处理对IAA 含量的影响
IAA 主要合成部位是幼嫩的芽、叶和发育中的种子,作用于细胞发育时期,促进植物形态发育。由图1A 可见,在24 ℃下,‘苏州青’幼苗中IAA 含量呈现先升高后下降的趋势,在6 h 时IAA 含量最高,达到0.149 ng∕g;在35 ℃和40 ℃高温胁迫下,IAA 均呈现先升高后下降再上升的趋势,在6 h 时IAA 含量均为最高,分别为0.172 ng∕g 和0.134 ng∕g,35 ℃时IAA 含量在48 h 时最低,达到0.107 ng∕g,当温度为40 ℃时,在24 h 时IAA 含量降至最低,为0.107 ng∕g。‘苏州青’中IAA 含量在24 ℃和40 ℃下差异并不显著,在35 ℃下有显著差异。由图1B 可见,在24 ℃下,‘黑油冬’幼苗中IAA 含量趋于平稳然后升高,在48 h 达到最高值0.172 ng∕g;在35 ℃高温胁迫下,IAA 呈现先升高后下降的趋势,在6 h 时IAA 含量最高为0.173 ng∕g;在40 ℃高温胁迫下,IAA 呈现先下降后上升的趋势,在24 h 时含量最低为0.112 ng∕g。‘黑油冬’中IAA 含量在24 ℃和35 ℃下差异不显著,在40 ℃下差异显著。

图1 高温胁迫对‘苏州青’和‘黑油冬’IAA 含量的影响Fig.1 Effects of high temperature stress on IAA content in‘Suzhouqing’and ‘Heiyoudong’
2.1.2 高温处理对GA 含量的影响
GA 合成主要部位是幼芽、幼根和未成熟的种子等,其主要生理功能为:促进细胞的伸长;解除种子、块茎的休眠并促进萌发的作用;参与调控种子的萌发和植物开花。由图2A 可见,在正常温度下,‘苏州青’幼苗中GA 含量变化整体呈现下降的趋势;在35 ℃高温胁迫下,GA 含量忽高忽低,在6 h 时,GA 含量最高,达到1.004 ng∕g,在48 h 时,GA 含量最低,达到0.821 ng∕g;在40 ℃高温胁迫下,GA 含量呈先下降后上升的趋势,在24 h 时,GA 含量最低,为0.748 ng∕g。在3 个温度处理条件下,‘苏州青’幼苗中的GA含量均有显著差异。由图2B 可见,在正常温度下,‘黑油冬’幼苗中GA 的含量在12 h 最低,达到0.986 ng∕g;在35 ℃和40 ℃高温胁迫下,GA 含量逐渐下降,分别在12 h 和24 h 达到最低值,分别为0.939 ng∕g和0.808 ng∕g,在恢复期有上升。在正常温度和35 ℃条件下,‘黑油冬’的GA 含量比‘苏州青’的略高,但在40 ℃条件下,这两者之间GA 含量相差不大。

图2 高温胁迫对‘苏州青’和‘黑油冬’GA 含量的影响Fig.2 Effects of high temperature stress on GA content in‘Suzhouqing’ and ‘Heiyoudong’
2.1.3 高温处理对ABA 含量的影响
ABA 的主要合成部位是根冠、萎焉的叶片等,其主要生理功能为:抑制植物细胞的分裂和种子的萌发;促进植物进入休眠;促进叶和果实的衰老、脱落。在热胁迫下,植物叶片中ABA 含量增加,气孔关闭[10]。由图3A 可见,在正常温度下,‘苏州青’幼苗中ABA 含量呈现先降低后上升的趋势,其最低值出现在6 h,为330.777 ng∕g。当受到35 ℃和40 ℃高温胁迫时,ABA 含量先上升后下降,最高值分别出现在24 h 和48 h,分别为550.152 ng∕g 和562.412 ng∕g。从图3B 中可以看出,在24 ℃下,‘黑油冬’幼苗中ABA 含量在6 h 达到最低值299.367 ng∕g,在12 h 达到最高值360.041 ng∕g;当受到35 ℃和40 ℃高温胁迫时,ABA 的含量大致呈现出和‘苏州青’相同的趋势,分别在48 h 和24 h 达到最高值,分别为464.831 ng∕g 和472.107 ng∕g。此外,随着温度的增加,这2 个品种之间的ABA 含量呈现逐渐上升的趋势;在相同的温度下,‘黑油冬’的ABA 含量比‘苏州青’略高;且ABA 含量在不同品种和温度下均有显著差异。
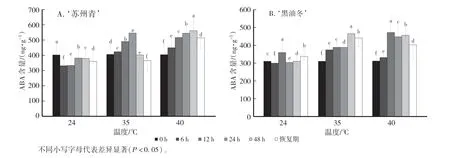
图3 高温胁迫对‘苏州青’和‘黑油冬’ABA 含量的影响Fig.3 Effects of high temperature stress on ABA content in ‘Suzhouqing’and‘Heiyoudong’
2.1.4 高温处理对ETH 含量的影响
ETH 是一种气态植物激素,植物体的各个部位均能产生,其主要生理功能是促进果实成熟、促进器官的脱落、刺激不定根的生成[11]。由图4A 可见,在24 ℃下,‘苏州青’幼苗中ETH 含量变化趋势相对平缓,最低值出现在24 h,为1 125 ng∕g,最高值出现在48 h,为1 234.015 ng∕g;当受到35 ℃高温胁迫时,ETH 含量呈现先上升后下降的趋势,在24 h 达到最高值,为1 348.006 ng∕g;当受到40 ℃高温胁迫时,ETH 含量逐渐升高在48 h 达到最高值,为1 610.094 ng∕g,在恢复期ETH 含量降低。由图4B 可见,在24 ℃下,‘黑油冬’幼苗中ETH 含量在12 h 达到最低值,为869.665 ng∕g,在24 h 达到最高值,为1 163.523 ng∕g;当受到35 ℃高温胁迫时,ETH 含量呈现复杂的变化趋势,在6 h 达到最低值,为935.339 ng∕g,在48 h 达到最高值,为1 243.917 ng∕g。当受到40 ℃高温胁迫时,ETH 含量逐渐上升,在48 h 达到最高值,为1 458.609 ng∕g,在恢复期ETH 含量下降。在高温处理下,‘黑油冬’和‘苏州青’ETH含量均有显著差异。

图4 高温胁迫对‘苏州青’和‘黑油冬’ETH 含量的影响Fig.4 Effects of high temperature stress on ETH content in‘Suzhouqing’and‘Heiyoudong’
2.1.5 高温处理对CTK 含量的影响
CTK 的合成部位是正在进行细胞分裂的幼嫩根尖,其主要生理功能为:促进细胞分裂;诱导芽的分化;防止植物衰老,延缓叶片衰老[12-13]。由图5A 可见,在正常温度下,‘苏州青’幼苗中CTK 含量比较稳定,在24 h 达到最低,为443.207 ng∕g;当受到35 ℃和40 ℃高温胁迫时,CTK 含量呈现下降的趋势,最低值均出现在48 h,分别为348.226 ng∕g 和378.814 ng∕g;进行恢复之后CTK 含量略有所上升。由图5B 可见,在正常温度下,‘黑油冬’幼苗中CTK 含量逐渐上升,在48 h 到达最高值,为535.393 ng∕g。当受到35 ℃高温胁迫时,CTK 含量在24 h 达到最高值,为480.252 ng∕g,当受到40 ℃高温胁迫时,CTK 含量先上升后下降再上升,其最高值出现在6 h,为490.793 ng∕g,最低值出现在24 h,为368.157 ng∕g。
2.1.6 高温处理对PA 含量的影响
PA 是生物体通过代谢过程中产生的一类含N 的生物活性比较高的次生物质,在提高植物抗逆性、延缓衰老等方面具有重要作用[5,14]。由图6A 可见,在正常温度下,‘苏州青’幼苗中PA 含量先升高后降低,在12 h 达到最高值,为155.916 ng∕g。当受到35 ℃高温胁迫时PA 含量呈现先下降后上升再下降的趋势,在6 h 达到最低值,为92.088 ng∕g,在48 h 达到最高值,为146.579 ng∕g,当受到40 ℃高温胁迫时PA含量呈现复杂的变化趋势。由图6B 可见,除在35 ℃、6 h 下PA 含量升高,在不同温度下,‘黑油冬’PA含量较0 h 时含量均有所下降。

图6 高温胁迫对‘苏州青’和‘黑油冬’PA 含量的影响Fig.6 Effects of high temperature stress on PA content in‘Suzhouqing’and‘Heiyoudong’
2.2 高温和淹水共同处理对激素含量的影响
2.2.1 高温和淹水共同处理对IAA 含量的影响
如表1 所示,‘黑油冬’幼苗中的IAA 含量在24 ℃和35 ℃下没有显著性差异,而在40 ℃下有显著性差异,IAA 含量的最高值出现在0 h,为0.165 ng∕g,IAA 含量的最低值出现在48 h,为0.105 ng∕g。‘苏州青’幼苗中的IAA 含量在24 ℃和40 ℃下没有显著性差异,而在35 ℃下有显著性差异,IAA 含量的最高值出现在6 h,为0.158 ng∕g,IAA 含量的最低值出现在24 h,为0.102 ng∕g。

表1 高温和淹水胁迫对‘黑油冬’和‘苏州青’IAA 含量的影响Table 1 Effects of high temperature stress and waterlogging on IAA content in‘Heiyoudong’and‘Suzhouqing’ ng·g -1
2.2.2 高温和淹水共同处理对GA 含量的影响
如表2 所示,‘黑油冬’幼苗中GA 含量在各个温度下差异显著,在24 ℃下,随着淹水时间的长短,‘黑油冬’幼苗中GA 含量呈现先下降后上升的趋势,在0 h 达到最高值,为0.141 ng∕g,在24 h 达到最低值,为0.899 ng∕g;在35 ℃和40 ℃高温胁迫下,GA 含量较0 h 相比有所降低,其最低值分别出现在24 h和48 h,分别为0.827 ng∕g 和0.775 ng∕g。‘苏州青’幼苗中GA 含量在各个温度下差异显著,在24 ℃下,‘苏州青’幼苗中GA 含量呈现先上升后下降再上升的趋势,在6 h 达到最高值,为1.304 ng∕g,在24 h 达到最低值,为0.795 ng∕g;在35 ℃和40 ℃高温胁迫下,GA 含量逐渐降低,最低值均出现在24 h,分别为0.746 ng∕g和0.740 ng∕g,对其进行恢复之后稍有上升。

表2 高温和淹水胁迫对‘黑油冬’和‘苏州青’GA 含量的影响Table 2 Effects of high temperature stress and waterlogging on GA content in ‘Heiyoudong’ and ‘Suzhouqing’ ng·g -1
2.2.3 高温和淹水共同处理对ABA 含量的影响
如表3 所示,在24 ℃和35 ℃下,随着淹水时间的长短,‘黑油冬’幼苗中ABA 呈现先上升后下降的趋势,并在24 h 达到最高值,分别为461.982 ng∕g 和510.997 ng∕g;在40 ℃高温胁迫下,ABA 含量在淹水0 h 最低,为310.949 ng∕g,在48 h 含量最高,为563.842 ng∕g。在24 ℃下,‘苏州青’幼苗中ABA 含量呈现先下降后上升再下降的趋势,在6 h 达到最低值,为290.162 ng∕g,在48 h 达到最高值,为539.974 ng∕g;在35 ℃高温胁迫下,ABA 含量先下降后升高再下降,恢复期间有所上升,在6 h 达到最低值,为290.032 ng∕g,在24 h 达到最高值,为526.788 ng∕g;在40 ℃高温胁迫下,ABA 含量逐渐上升,并在淹水48 h达到最高,为652.011 ng∕g,在恢复期间有所降低。‘黑油冬’和‘苏州青’中ABA 含量在各个温度下均有显著性差异。

表3 高温和淹水胁迫对‘黑油冬’和‘苏州青’ABA 含量的影响Table 3 Effects of high temperature stress and waterlogging on ABA content in‘Heiyoudong’ and ‘Suzhouqing’ ng·g -1
2.2.4 高温和淹水共同处理对ETH 含量的影响
如表4 所示,在24 ℃下,随着淹水时间的长短,‘黑油冬’幼苗中ETH 含量呈现先下降后上升再下降的趋势,并在24 h 达到最高值,为1 357.625 ng∕g;在35 ℃和40 ℃高温胁迫下,ETH 含量均呈现先升高后下降的趋势,在24 h 达到最高值,分别为1 587.215 ng∕g 和1 603.563 ng∕g。此外,随着温度的升高,ETH含量逐渐升高。在24 ℃下,随着淹水时间的变化,‘苏州青’幼苗中ETH 含量逐渐上升,在48 h达到最高,为1 562.900 ng∕g,在恢复期有所下降;在35 ℃高温胁迫下,ETH 含量逐渐升高后下降再升高最后下降,并在淹水48 h 达到最高值,为1 718.599 ng∕g;在40 ℃高温胁迫下,ETH 含量先升高后下降,在24 h 达到最高值,为1 790.023 ng∕g。‘黑油冬’和‘苏州青’中ETH 含量在各个温度下均有显著性差异。

表4 高温和淹水胁迫对‘黑油冬’和‘苏州青’ETH 含量的影响Table 4 Effects of high temperature stress and waterlogging on ETH content in Heiyoudong’ and‘Suzhouqing’ ng·g -1
2.2.5 高温和淹水共同处理对CTK 含量的影响
如表5 所示,在24 ℃条件下对‘黑油冬’幼苗进行淹水处理,其CTK 含量先升高然后逐渐降低,恢复正常的生长条件之后含量升高,在48 h 达到最低值,为438.453 ng∕g,在恢复期达到最高值534.163 ng∕g;在35 ℃和40 ℃高温胁迫下,CTK 含量随着淹水时间和温度的改变呈现不同的变化趋势,CTK 含量最低则分别出现在淹水24 h 和48 h,分别为353.810 ng∕g 和309.491 ng∕g。在24 ℃下,随着淹水时间的增长,‘苏州青’CTK 含量在0 h 最高,为507.558 ng∕g,在12 h 达到最低值,为375.142 ng∕g;在35 ℃和40 ℃高温胁迫下,与0 h 相比,CTK 含量下降分别在24 h 和48 h 达到最低值,分别为353.810 ng∕g 和309.491 ng∕g。‘黑油冬’和‘苏州青’中ETH 含量在各个温度下均有显著性差异。
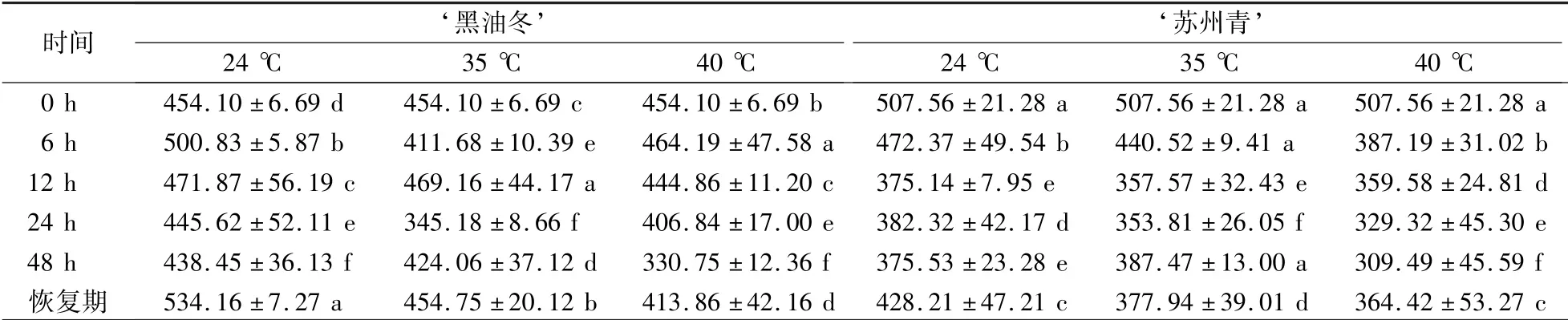
表5 高温和淹水胁迫对‘黑油冬’和‘苏州青’CTK 含量的影响Table 5 Effects of high temperature stress and waterlogging on CTK content in ‘Heiyoudong’and‘Suzhouqing’ ng·g -1
2.2.6 高温和淹水共同处理对PA 含量的影响
如表6 所示,在24 ℃下对‘黑油冬’幼苗进行淹水处理,PA 含量先下降后升高再逐渐降低,在恢复期略有升高,在0 h 达到最高值,为142.392 ng∕g,在6 h 达到最低值,为119.904 ng∕g;在35 ℃下,PA 含量在6 h 达到最低值,为92.566 ng∕g,在24 h 达到最高值,为162.228 ng∕g;在40 ℃的高温胁迫下,PA 含量呈现先下降后升高再下降的趋势,在恢复期PA 含量有所升高,在12 h 达到最低值,为109.462 ng∕g,在24 h达到最高值,为146.468 ng∕g。在24 ℃下,‘苏州青’PA 含量先升高后下降,在12 h 达到最高值,为134.243 ng∕g;在35 ℃下,PA 含量在12 h 达到最低值,为97.155 ng∕g,在24 h 最高,为147.281 ng∕g;在40 ℃的高温胁迫下,PA 含量呈现先升高后下降趋势,在48 h 达到最高值146.025 ng∕g。

表6 高温和淹水胁迫对‘黑油冬’和‘苏州青’PA 含量的影响Table 6 Effects of high temperature stress and waterlogging on PA content in‘Heiyoudong’ and ‘Suzhouqing’ ng·g -1
3 结论与讨论
在逆境胁迫下,植物通过提高ABA、ETH 等激素的含量来提高抗逆性[15]。ABA 常被称为胁迫激素,作为逆境胁迫过程中的信号物质。韩瑞宏等[16]研究表明,在干旱条件下,植物通过提高内源ABA 水平诱导气孔关闭、保护光抑制以及诱导或增强抗性基因的表达等生理机制来应对干旱胁迫;陈博雯等[17]研究了在淹水胁迫下,ABA 含量的增加,是通过与受体结合的方式来增强植物对淹水胁迫的抵抗能力,而在此之前也有研究指出,淹水胁迫下ABA 含量迅速下降[18]。本研究两个处理的ABA 含量迅速增加,这与陈博雯等[17]的研究结果一致。植物受到胁迫时产生ETH 有两种观点[19]:一是ETH 的产生是植物受害后的症状,因此可以通过降低ETH 含量来提高植物的抗逆性;二是ETH 的产生是植物对逆境环境的一种适应现象,因此可以通过启动和调节某些与逆境适应相关的生理生化过程来诱导抗逆性的形成。本研究中耐涝性较弱的‘苏州青’中ETH 含量要比耐涝性较强的‘黑油冬’中ETH 含量略高,这和逆境中ETH 含量升高结果一致,但造成这种原因究竟是哪一种观点仍待进一步研究。IAA 和CTK 通过促进细胞伸长和调节核酸与蛋白的合成,延缓植物衰老,从而提高植物抗逆性。GA 通过调节植物体内自由水和束缚水的含量从而提高植物的抗逆性。张艳军等[20]研究表明,GA 也参与影响了叶片的衰老,其活性成分的含量在叶片衰老过程中逐渐变低。PA 是生物体代谢过程中产生的一类次生物质,在调节植物生长发育、控制形态建成、提高植物抗逆性、延缓衰老等方面具有重要作用,程维国[5]曾将PA 称作是激素的第二信使。
总之,在植物生长、发育过程中,各种激素之间既相辅相成,又相互制约,植物对各种逆境的反应均需要各种激素之间的相互协调,而不是单个激素起作用。在逆境条件下,了解植物激素的规律变化是检验植物在逆境环境下生长能力的一个非常关键指标。本研究发现,在高温以及高温和淹水的处理条件下,‘苏州青’和‘黑油冬’中IAA、GA 和CTK 含量下降;ABA、ETH 含量升高;PA 含量在‘苏州青’中升高,而在‘黑油冬’中则出现复杂的变化规律,但其含量仍比‘苏州青’高。研究高温淹水胁迫下植物组织中内源激素含量的动态变化,对揭示不结球白菜植物的抗热机制和抗淹水机制及其修复具有重要意义。
