测量难溶电解质溶解平衡的电导率实验探究
2022-03-08顾仲良
顾仲良




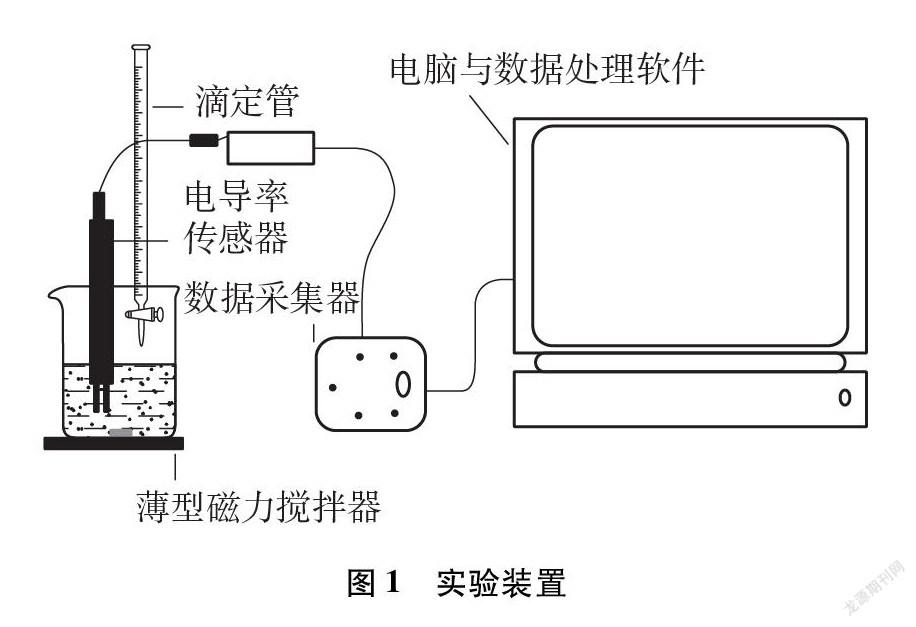
摘要: 难溶电解质在水中存在溶解平衡。利用电导率传感器测量难溶电解质PbI2悬浊液的稀释过程,论证溶解平衡的存在并获得溶度积常数。通过对比实验,测量溶液的电导率证明难溶电解质也存在溶解平衡的同离子效应和溶度积常数的温度效应。
关键词: 电导率; 难溶电解质; 溶度积常数; 实验探究
文章编号: 10056629(2022)02006705
中图分类号: G633.8
文献标识码: B
实验是化学教学的重要方法和途径,新课标[1]要求在内容选择上精心设计学生必做实验,同时适当增加数字化实验、定量实验和创新实践活动等,让学生在实验探究活动中学习科学方法,认识科学探究过程,体会、认识技术手段的创新对化学科学的重要价值。难溶电解质的溶解平衡及影响因素是高中化学教学的一个重要内容,在现行人教版[2]与鲁科版[3]教材中,分别以难溶电解质AgCl和PbI2为例,说明存在溶解平衡,指出溶度积常数只与难溶电解质的性质和温度有关,而与沉淀的量无关。化学同行们对此理論研究和实验方案有不少数字化方向的探索,如郑晓红老师利用氯离子传感器,通过氯离子的浓度变化来研究氯化银沉淀溶解平衡的存在和移动[4];杨玲老师利用pH传感器与电导率传感器探究碳酸钙的溶解平衡[5]。同行们对溶解平衡的实验研究思路新颖、数据精准、推理缜密,充分论证了平衡理论,但都尚未通过电导率进行离子浓度的测量和溶度积常数的计算,也没有研究温度效应对溶解平衡的影响。离子的实际浓度变化是溶解平衡发生变化最直接的表达,也是溶解平衡移动方向最有力的判据。基于以上原因,本研究改进实验方案,通过测量难溶电解质PbI2饱和溶液的电导率,获得各离子的实际浓度和溶度积常数;通过测量悬浊液稀释过程各离子的浓度变化,说明溶解平衡的存在与移动;滴加同离子溶液和升温过程的电导率变化,证明同离子效应和温度效应,加强了实验与理论结合的数据实证。
1 实验原理
将溶有1mol电解质的水溶液置于平行电极相距1m的电导池之间,测量得到的电导率称之为摩尔电导率Λm(S·m2·mol-1)。摩尔电导率Λm与测量电导率κ(S·m-1)、电解质溶液的浓度c(mol·L-1)的关系如下:
Λm=κ1000c(1.1)
将电解质溶液无限稀释得到的摩尔电导率称为极限摩尔电导率Λ∞m,难溶电解质多为强电解质且其溶解度极小,所以它的摩尔电导率近似等于极限摩尔电导率,即Λm≈Λ∞m。
根据科尔劳施的离子独立移动定律,电解质的极限摩尔电导率可以由组成电解质的阴离子与阳离子的极限摩尔电导率相加而得,例如25℃时碘化铅的极限摩尔电导率[6]:
Λ∞m12PbI2=Λ∞m12Pb2++Λ∞m(I-)
=7.100×10-3S·m2·mol-1+ 7.68×10-3S·m2·mol-1
=1.478×10-2S·m2·mol-1
依公式1.1,测得电导率后即可求得铅离子或碘离子的浓度(mol·L-1)及溶度积常数:
cI-=κ1000Λ∞m
cPb2+=12c(I-)=κ2000Λ∞m
Ksp=cPb2+×c2I-=κ2000Λ∞m×κ1000Λ∞m2=κ32×109(Λ∞m)3(1.2)
2 实验药品与仪器
(1) 药品: 硝酸铅、碘化钾、硫化钠、蒸馏水
(2) 仪器: 电导率传感器与数据采集系统(见图1)、温度传感器、磁力搅拌器、离心机及离心试管、恒温水浴锅、酸式滴定管、移液枪、烧杯、烧瓶、玻璃棒
3 实验操作与步骤
3.1 蒸馏水电导率测定
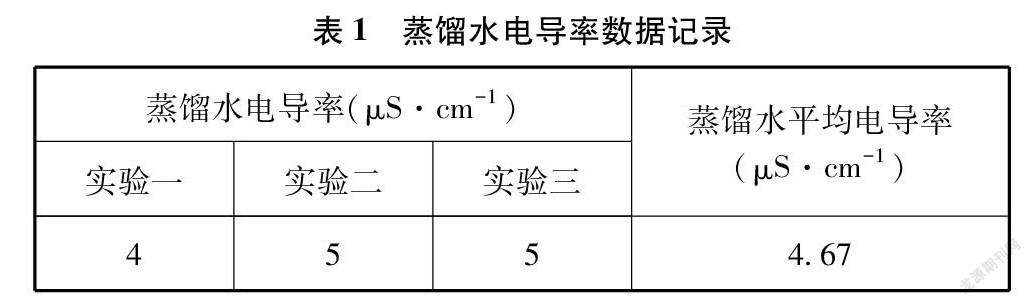
在三个小烧杯中分别盛入20mL蒸馏水,测量蒸馏水在室温时的电导率填入表1中。虽然蒸馏水的电导率非常小,但由于溶有少量的杂质,如二氧化碳等,这些溶质相对于难溶电解质来说,还是有比较大的影响,所以测定蒸馏水的电导率,在数据处理时,用扣除溶剂
电导率后的数据表示电解质的电导率较为精确。本实验操作于2021年6月18日下午进行,本地室内气温26.5℃。
如果实验有更高精度的要求,还可以对蒸馏水进行预处理,处理的方法是向蒸馏水中加入少量高锰酸钾,然后用硬质蒸馏烧瓶进行重蒸馏[7]得到“电导水”,“电导水”的电导率可以做到小于1μS·cm-1。
3.2 碘化铅沉淀的获得
取两个250mL规格的烧杯,分别加入0.50克硝酸铅和0.50克碘化钾,在两个烧杯中分别加入150mL 65℃热水,用玻璃棒搅拌加速溶解后将碘化钾溶液倒入到硝酸铅溶液中,立即产生金黄色的碘化铅沉淀,将悬浊液趁热过滤于烧瓶中,烧瓶中的滤液在冷却过程中不断地析出大小均一的碘化铅沉淀,在灯光的照射下形成闪着金光的“黄金雨”。
用离心机将碘化铅沉淀用蒸馏水清洗并离心提纯三次,离心后上层清液用硫化钠作无害化处理。多次清洗及离心操作,目的是除去多余的硝酸根、钾离子等可溶离子,确保碘化铅沉淀的纯度。
3.3 溶度积常数的获得
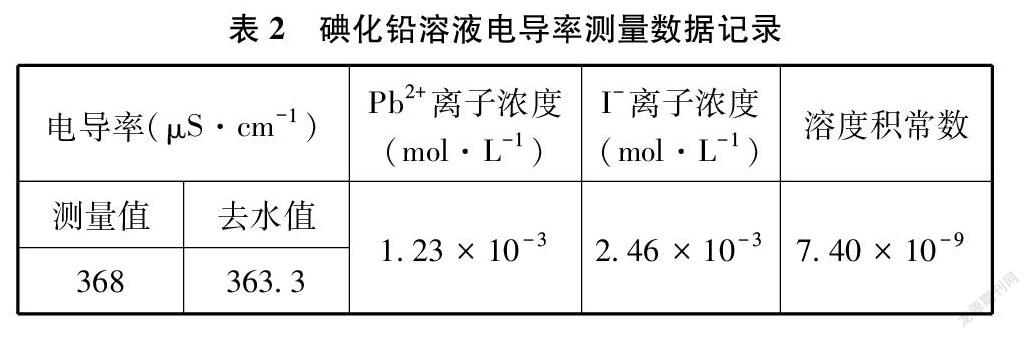
将纯净的碘化铅沉淀倒入盛有75mL蒸馏水的大烧杯中,放入电导率传感器开始测量电导率。用玻璃棒辅助磁力搅拌器进行搅拌,直至表现为电导率测量值不再升高变化,达到溶解饱和的悬浊液。本实验在26.5℃时搅拌约为7分30秒,记录获得数据并以公式1.2计算离子浓度与溶度积常数,数据见表2。
3.4 溶解平衡的存在
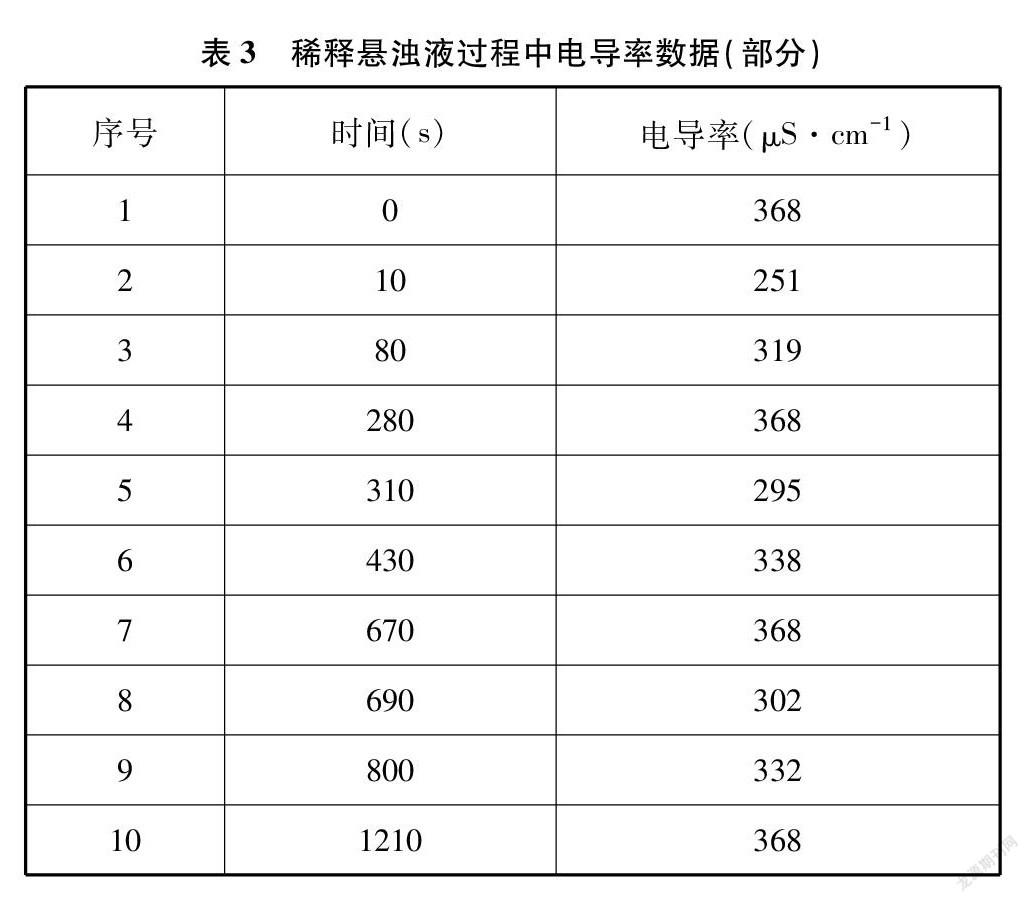
继续在上述悬浊液中测量电导率,数据采集系统设置为每隔5秒采集一次电导率,用滴定管在烧杯中添加蒸馏水(每次加25mL),用磁力搅拌器加上玻璃棒辅助搅拌,观察电导率回升到368μS·cm-1时添加蒸馏水,本实验共添加蒸馏水3次,记录获得的电导率部分数据(见表3)并绘制变化曲线(见图2)。
3.5 溶解平衡的同离子效应
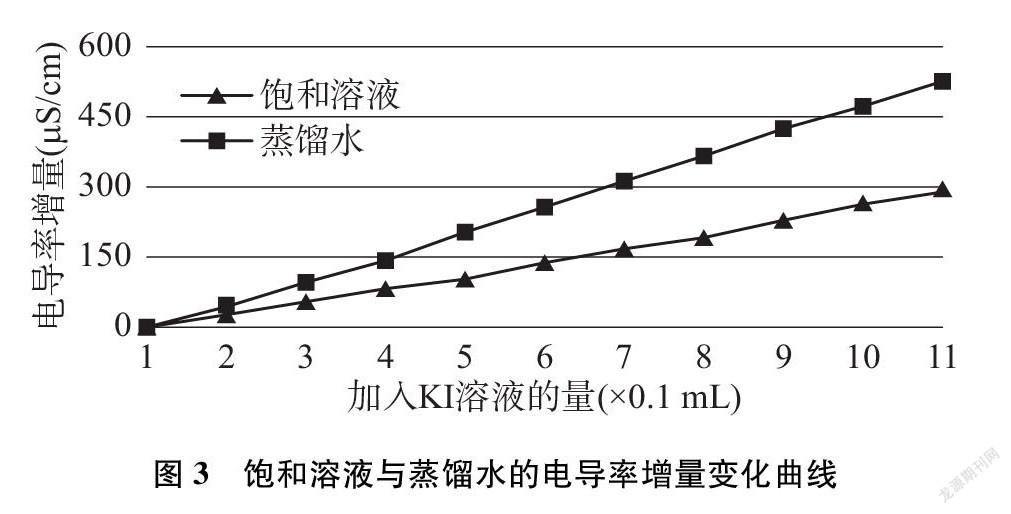
将碘化铅悬浊液加蒸馏水至750mL,用磁力搅拌器和玻璃棒共同搅拌至电导率368μS·cm-1,经沉积之后将上层澄清液中取250mL倒入另一烧杯。另取相同的烧杯,盛入250mL蒸馏水,将两个烧杯置于磁力搅拌器上,启动搅拌并用玻璃棒在两个烧杯中辅助搅拌。在两个烧杯中分别放入电导率传感器,用移液枪每次滴入0.100mL的1.0mol·L-1的KI溶液。选择该浓度是经计算获得的,可保证每次铅离子的沉淀量使电导率增量变化比较明显。采集电导率数据并记录(见表4)。
绘制电导率增量数据变化曲线(见图3)。
3.6 溶解平衡的温度效应
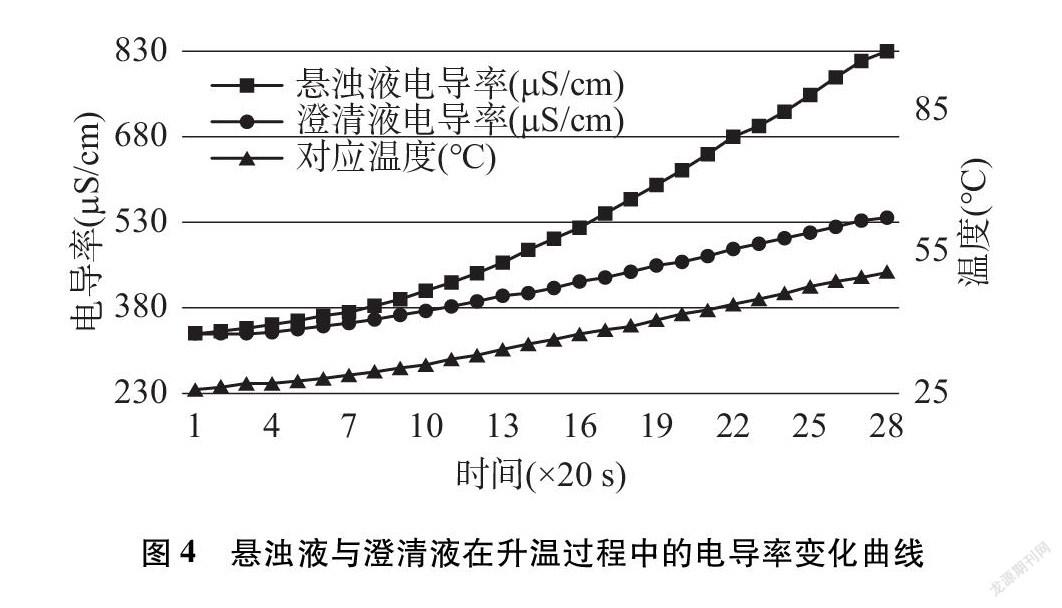
将上述碘化铅悬浊液经沉积之后的上层澄清液约250mL倒入一个相同的烧杯,余下的约250mL碘化铅悬浊液仍在原烧杯内。将两个烧杯置于双孔恒温水浴锅中,在两个烧杯中分别放入电导率传感器,在其中一个烧杯中放入温度传感器。设置水浴锅开始加热,并用玻璃棒同时在两个烧杯中搅拌,数据采集系统设置为每隔5秒记录一次测量数据。所测部分温度下的电导率数据见表5。
結合温度数据,绘制电导率数据变化曲线(见图4)。
4 结果与讨论
4.1 溶度积常数
根据碘化铅的极限摩尔电导率,结合实验测量溶解饱和的悬浊液电导率,本实验比较精确地求得溶度积常数Ksp=7.40×10-9(26.5℃),对照化学手册[8]提供的数据7.10×10-9(25℃),误差仅为+4.2%,故本实验测量值有非常高的参考价值。分析主要误差原因可能是本次实验的室内气温26.5℃比手册数据温度25℃略高,在真实的电导率测量中,即便温度只高1.5℃,也会造成测量数值有偏大误差。详细说明可见4.4温度效应一节的内容。
4.2 溶解平衡的存在
当悬浊液中加入蒸馏水后各离子浓度迅速下降,碘化铅离子积Qc<Ksp,溶液成为不饱和状态。根据溶度积规则,沉淀的溶解平衡向溶解方向发生移动,以达成Qc=Ksp平衡状态,这一过程中碘化铅沉淀在搅拌作用下会逐渐溶解,离子浓度逐渐上升,表现为电导率逐渐上升。
每次加入蒸馏水后溶液电导率下降,下降幅度受加入蒸馏水的量与原有溶液的量之比的影响,比值越大,下降越多。每次加入蒸馏水的量均为25mL,而溶液则逐步由75mL变为100mL、 125mL,这个比值在逐渐减小,所以电导率下降的幅度也逐渐减小。每次加入蒸馏水搅拌后电导率逐渐升高,但由于悬浊液中固体的量减小、溶液的总量增加,溶解沉淀达到饱和浓度逐渐困难,表现为电导率升高达到饱和(平衡)状态值所需的时间增加。
4.3 同离子效应
难溶电解质溶解平衡和弱电解质电离平衡一样也存在同离子效应,即加入相对较高浓度的对应离子后,平衡即向生成沉淀方向移动。在碘化铅饱和溶液或蒸馏水中滴入1.0mol·L-1的KI溶液后,增大的钾离子与碘离子浓度,使两者的电导率都增大,但饱和液中的高浓度碘离子与铅离子结合,使平衡向生成碘化铅沉淀方向移动,现象为产生亮黄色的浑浊。碘化铅沉淀的产生,使饱和液中离子浓度的增量比蒸馏水中要小,表现为饱和溶液中的电导率增量没有蒸馏水中的大,这就证明了难溶电解质也存在同离子效应。
4.4 温度效应
与其他化学平衡常数一样,难溶电解质的溶度积常数也是随温度改变而变化的,由于大多数难溶电解质溶解与电离的总反应是一个吸热过程,所以溶度积常数是随温度升高而增大的。
对比澄清液升温过程电导率上升的实验,我们知道温度升高时,溶液电导率上升,并不完全是由于溶液中离子浓度增加引起的。从图4变化曲线可看出,澄清液电导率变化曲线与温度变化曲线几乎平行,这是由于澄清液中水的电离、离子的活度、离子的电迁移率(淌度)都在随着温度的升高而增大,电导率也随之增大。与澄清液相比,悬浊液电导率变化曲线有明显的跃起,这是因为溶液中的离子浓度在增加,说明温度升高,沉淀溶解平衡向正向(溶解)移动,溶度积常数也在增大。
5 实验探索的意义
传统实验的数字化创新改进,可以将抽象的化学理论转化为直观的实验现象和可靠的数据实证,还让学生体验实验前的变量选择、实验中的过程操作、实验后的数据处理,这种对实验的亲历使学生对化学理论的信服力得到加强,又培养了学生的实证能力和批判性思维,发展学生的探究意识和科学精神。
本实验研究没有选用学生常见的硫酸钡、氯化银而采用碘化铅作为研究对象,是因为碘化铅的溶解性随温度变化较明显,更能呈现饱和溶液电导率的变化,同时利用碘化铅也可以让学生对非1∶1型的难溶电解质消除陌生感,构建不同类型沉淀的溶度积常数计算模型。
实验结束后我们须用硫化物妥善处理含铅废液,防止环境污染。一个既能完善化学理论,又具有科学性的无污染绿色方案,使实验的探究更趋完美。
参考文献:
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版2020年修订)[S]. 北京: 人民教育出版社, 2020: 82~83.
[2]王晶, 郑长龙主编. 普通高中教科书·化学反应原理(选择性必修1)[M]. 北京: 人民教育出版社, 2020: 78.
[3]王磊, 陈光巨主编. 普通高中教科书·化学反应原理(选择性必修1)[M]. 济南: 山东科学技术出版社, 2019: 109.
[4]郑晓红. 利用手持技术探究难溶电解质的溶解平衡[J]. 中学化学教学参考, 2016, (9): 56~57.
[5]杨玲, 吴晓红, 王亚涛. 借助传感器探究难溶电解质的溶解平衡[J]. 教育与装备研究, 2020, 36(7): 71~73.
[6][8]J.A. 迪安. 兰氏化学手册[M]. 北京: 科学技术出版社, 1991: 6~32, 5~8.
[7]孙文东, 陆嘉星. 物理化学实验(第三版)[M]. 北京: 高等教育出版社, 2014: 131.
