底栖螺酶活性对乐安河沉积物重金属含量生理响应研究
2022-03-07张力薇李学飞刘振环李欣蕊赵军利
张力薇,李学飞,刘振环,李欣蕊,赵军利,顾 鎏*
(1.江西水利职业学院,330013,南昌;2.江西省鄱阳湖水利枢纽建设办公室,330009,南昌;3.生态环境部海河流域北海海域生态环境监督管理局生态环境监测与科学研究中心,300170,天津)
0 引言
河流沉积物重金属污染己经成为我国当今严重威胁河流水生态环境的突出问题[1-3],重金属分布与富集作用对动物和植物危害巨大[4]。我国是一个矿产资源大国,矿产开发对当前经济持续增长提供了重要的保障。然而,由采场废水、废石场废水、选矿废水、矿物加工过程中产生的废水、尾矿库溢流水以及未达标排放选冶废水所组成的酸性矿山废水(Acid Mine Drainage,AMD)富含重金属元素,往往使得矿山附近的地表水体遭受污染。亚洲最大的露天铜矿——德兴铜矿位于乐安河上游,而乐安河是鄱阳湖的5条入湖河流——饶河的重要支流,因此乐安河重金属污染分布特征间接地影响着鄱阳湖。
德兴铜矿为国内最大的铜矿,开采过程中酸洗废水通过大坞河注入乐安河,严重地污染了乐安河中下游流域,尤其以重金属Cu、Zn、Pb、Cd的污染问题较为突出。重金属元素在水体中以各种形态分布在水相、沉积相及生物相中,表现出不同的环境地球化学行为和环境效应。其中,作为水生态系统中重要的组成部分沉积物在水体底部长期积存,是环境污染物在广泛空间和长期时间内的汇集处,能较好地反映流域内重金属污染状况[5-7]。因此,为了解掌握乐安河沉积物重金属污染分布及其生物响应特征,本文以乐安河为研究对象,主要研究内容为:1)沿河布点,采集沉积物进行重金属浓度分析及重金属风险评价;2)开展底栖生物——中华田园螺原位暴露酶活性响应实验研究。本研究成果将有助于乐安河重金属污染风险管控,指导乐安河构建重金属风险底栖生物风险评估体系,为河流水生态管理与评价提供重要理论支撑。
1 实验与方法
1.1 研究区域
本文以乐安河为研究对象,全长279 km,为饶河的主干,上游水质较好,下游多有工业、采砂以及开矿等活动。本次实验采样点位置如图1所示,将乐安河分为上中下3个河段,共布设采样点位11个,点位信息见表1。
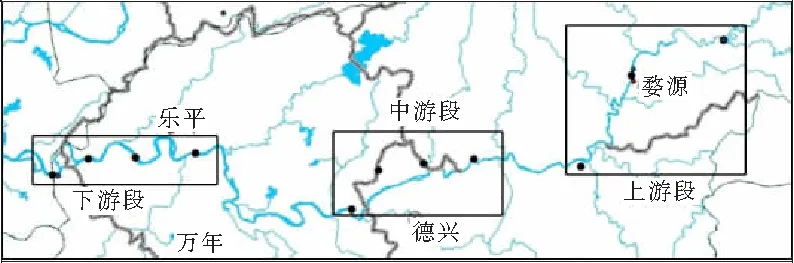
图1 乐安河重金属实验采样点位置示意图
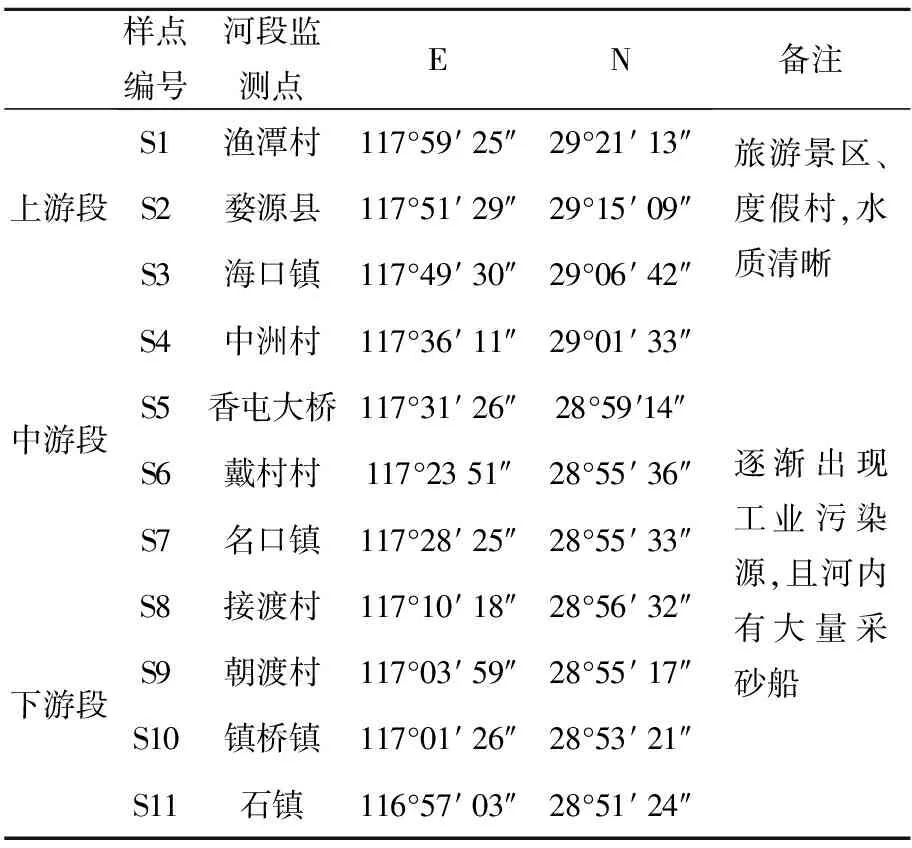
表1 乐安河重金属实验采样点位信息表
1.2 实验方法
重金属浓度分布:2019年11月在11个样点处采集水-土界面向下20 cm 的沉积物3~4个混合成一个样品,装入自封袋冷藏,供实验分析。将样品放于通风处自然风干后剔除杂物,研磨,称取 0.1 g样品置离心管中,加入少量超纯水(Millipore)润湿,在离心管中加入约2滴HNO3,轻微震荡离心管,使样品与HNO3均匀混合; 然后将离心管放于消解仪上1 000 °C时消解24 h,冷却后,取上清液进行分析测定[8]。实验室分析项目包括:Cu、Zn、Pb、Cd、Cr、As以及Ni等7种重金属元素。
底栖螺生物响应:中华圆田螺在我国分布较广,常以水生植物(低等藻类以及水体沉积物)为食。田螺作为水生底栖生物在水中的移动性很小,生活环境相对固定,因此本次生物响应试验选取中华圆田螺为生物标志物通过环境毒理试验来反映重金属污染情况对其生物性质的影响[9]。本次试验为原位实验,将田螺放养于预制渔网中,放养密度为5~10只/个,沿乐安河中游及下游(8个监测点)分布,自然条件下暴露7 d、14 d,以田螺组织中的酶活性来判断底泥或水中污染物的毒性。

图2 乐安河采样与室内实验照片
2 结果与讨论
2.1 沉积物重金属分布特征
沉积物中7种重金属的浓度统计结果如表2所示。7种重金属的平均含量从大到小依次为:Cu>As>Pb>Zn>Ni>Cr>Cd,从空间分布情况来看,Cu的含量空间差异性最大,上游S1~S3点位浓度在27.69~37.64 μg/g之间,到达S4后含量有所上升,S5以下点位位于德兴铜矿下游,沉积物中Gu含量明显上升,最高值出现在S7,含量为788.69 μg/g,S6~S11含量范围为341.66~788.69 μg/g之间;除Cd外,其余6种重金属在11个点位中仍表现出一定的空间分异特征。Zn含量最大值出现在S7,为89.74 μg/g,Cv值为0.6;Pb含量最大值出现在S5,为86.13 μg/g,Cv值为0.52;Cr含量最大值出现在S4,为48.56 μg/g,Cv值为0.37;As含量最大值出现在S7,为116.79 μg/g,Cv值为0.51;Ni含量最大值出现在S6,为52.79 μg/g,Cv值为0.22。由此可知,铜矿对乐安河中下游底泥沉积物中重金属含量有非常显著的影响。
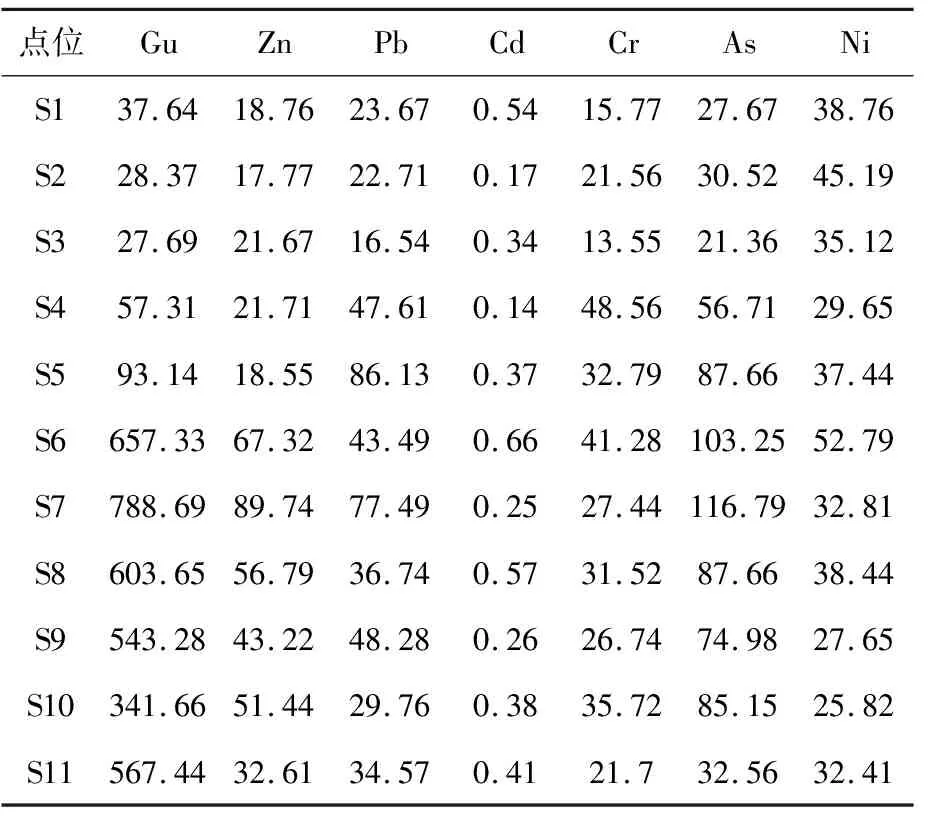
表2 乐安河重金属实验采样点位信息表/μg·g-1
2.2 重金属风险评价
本文采用地累积指数法对乐安河11个采样点沉积物重金属污染程度进行评价[10],该方法广泛应用于重金属的污染评价,污染等级划分参考[11]。其计算公式为:
其中:Igeo为地累积指数;Cn为沉积物中重金属含量;k为常数,通常取1.5;Bn为地球化学背景值,本文参考南宁市土壤重金属元素背景值[21]。
11个点位7种重金属地累积指数如图3。由于德兴铜矿的影响,中下游S6~S11点位为重度以上污染,其余6种重金属各点位未出现重度污染。其次为Cd有3个点位(S1、S6、S8)为偏重度污染,大部分点位均为轻度污染。其余5种重金属在11个沉积物样品中基本处于偏中度污染状态;从空间分布情况看,各种重金属地累积指数均表现出不同程度的自上游向下游污染程度逐渐加重的趋势,Gu无疑是变化最明显的,其次为Zn、As等。
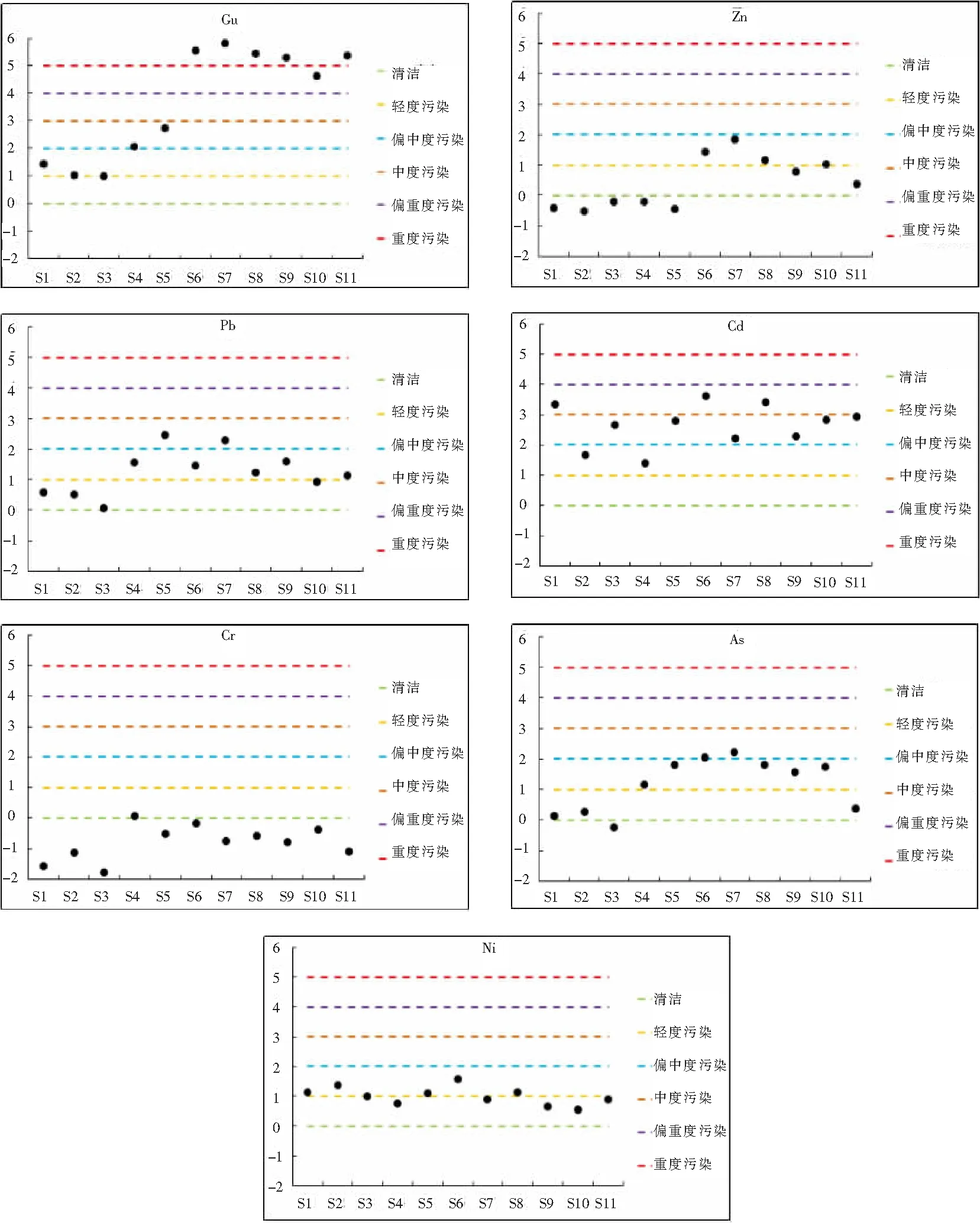
图3 7种重金属地累积指数分布图
2.3 生物酶活性响应机制
2020年4—5月,取乐安河上游段(S1~S3)田螺约300只,其中大部分田螺用于中下游放养实验(实地调查结果发现中下游并无田螺,且有大量采砂船及工厂分布),其中小部分带回实验室进行田螺的酶活性检测。中下游放养时间为2020年4月17日,第1次采样时间为2020年4月27日,第2次采样时间为2020年5月8日;由于持续降雨影响,乐安河河水暴涨,使得监测点S3、S11点位实验网被大水淹没、冲走或是人为破坏而丢失。样品带回实验室后去壳取出组织,按照实验操作规程立即进行匀浆处理,并用高速离心机取其上清液致于-20 ℃冰箱中待测。检测指标为TChE(总胆碱酯酶)、MDA(丙二醛)、GSH(谷胱甘肽过氧化物酶)、SOD(超氧化物歧化酶)、MT(金属硫蛋白)等。
2.3.1 TChE活性的响应 TChE(总胆碱酯酶,Acetyl cholinesterase)是生物神经传导中的一种关键性酶,在胆碱能突触间,该酶能降解乙酰胆碱,终止神经递质对突触后膜的兴奋作用,保证神经信号在生物体内的正常传递[12]。本研究野外暴露在整个试验过程中,田螺组织中TChE活性的变化范围连续暴露10 d TChE活性0.583~4.007 U/mgprot;连续暴露20 d TChE活性1.415~5.738 U/mgprot。总体上看,连续暴露10 d和20 d田螺组织中的TChE活性有所波动但幅度不大,但连续暴露10 d上游段、中游段以及下游段之间TChE活性都出现明显差异,中游段活性最强,其次为下游段;而连续暴露20 d TChE活性检测结果发现:中游段TChE活性有不同程度的下降,下游段TChE活性持续增强。这表明田螺组织中的TChE活性在乐安河污染物及环境因子胁迫作用下在暴露初期呈现诱导作用,随着暴露时间的延长TChE活性表现为抑制作用。
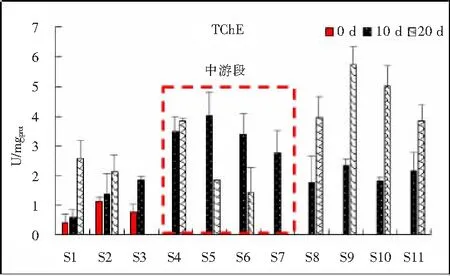
图4 野外连续暴露10 d、20 d沉积物重金属对中华圆田螺组织TChE活性的影响
2.3.2 MDA含量的响应 MDA含量变化情况如图5所示。MDA(丙二醛)是细胞氧化胁迫及损伤的标志[13],是反映生物膜脂质预氧化状态,本次试验中各监测点田螺体内MDA含量变化范围:5.921~13.645 nmol/mgprot,上游段监测点0 d、10 d、20 d连续暴露过程中检测结果差别并不明显。从空间上来看,中游段的S4~S7 MDA含量处于较高水平,这与重金属在沉积物中的含量分布规律保持一致;从时间上看,连续暴露10 d的田螺体内MDA含量最高,连续暴露20 d后MDA含量基本恢复到暴露前水平。由此可以看出田螺在此环境状况胁迫下,组织内MDA变化在对重金属含量情况做出响应,诱导作用明显,变化规律为田螺组织内MDA含量对重金属含量有正向响应机制,且响应迅速,随着诱导时间的延续,MDA含量则表现为回落并趋于稳定状态。
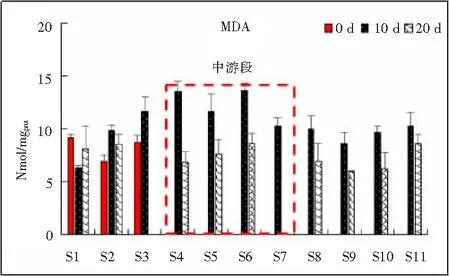
图5 野外连续暴露10 d、20 d沉积物重金属对中华圆田螺组织MDA含量的影响
2.3.3 GSH含量的响应 GSH(谷胱甘肽过氧化物酶)是机体分泌的一种特殊蛋白质[14],是机体内广泛存在的一种重要的过氧化物分解酶,使有毒的过氧化物还原成无毒的羟基化合物,从而保护细胞膜的结构及功能不受过氧化物的干扰及损害。本研究中不同暴露时间梯度下,各监测样点中华圆田螺组织GSH含量如图6所示。在上游段第一次采样时田螺组织中GSH含量为1.348~1.566 mg/gprot,均值为1 428 mg/gprot。经过10 d、20 d的2个时间梯度的放样发现上游段GSH含量均值分别为1.848 mg/gprot、0.885 mg/gprot。总体上看,上游监测点为河流源头,3次实验GSH含量波动不大,相对而言第2次采样实验GSH含量均值较高,分析其原因:GSH是一种参与多种外源性、内源性有毒物质结合生成减毒物质,生物体GSH变化的影响因素较多,可能由于期间持续降雨导致田螺生存环境改变使得机体敏感导致GSH变化。中游段10 d与20 d现场暴露实验GSH含量均值分别为5.195 mg/gprot、1.504 mg/gprot,比较2个时间段,GSH含量先急剧上升后明显下降,由于乐安河中游区域开始出现铜矿、采砂船等,水质开始浑浊,致使田螺出现应激反应,在此环境下GSH呈现显著的诱导现象。随着暴露过程的持续延长,田螺活性降低,甚至出现个别死亡现象,此时GSH敏感性降低。2次现场暴露实验下游段GSH呈现出同样的诱导规律,均值分别为3.368 mg/gprot、1.439 mg/gprot。从图6中可明显看出乐安河三段区域属中游段GSH含量变化明显,下游段相对而言变幅减小,由于上游未出现污染源且水质较好,在野外持续暴露实验中GSH含量并未出现较大波动。

图6 野外连续暴露10 d、20 d沉积物重金属对中华圆田螺组织GSH含量的影响
2.3.4 SOD活性的响应 超氧化物歧化酶(Superoxide dismutase,SOD)是生物体系中抗氧化酶系的重要组成成员[15]。从图7中可以看出,上游段0 d、10 d、20 d连续野外暴露实验田螺组织中的SOD活性无明显变化,而中游段及下游段各监测点田螺组织内SOD活性开始上升,由此可见,在无污染水质环境下田螺组织中SOD活性不受其他自然环境因素变化的影响。中游段受铜矿及采砂船的影响,SOD活性开始上升,而在下游段受铜矿、采砂船影响较小的范围内SOD活性总体上升趋势要高于中游段污染集中区,这可能由于轻度污染环境对SOD诱导作用较强,高浓度污染抑制了田螺组织中SOD的活性。从图7中值得注意的是中游段2个时间梯度间SOD活性并未出现明显差异,且在下游段连续暴露20 d的样品中SOD活性持续增大。分析原因可能由于中游受污染相对较重,且为污染源头,在一定浓度污染环境持续暴露中田螺组织中SOD活性达到某一阈值并维持稳态,而下游污染较轻的区域在低浓度污染因子诱导作用下SOD活性将持续上升。研究表明,田螺组织中的SOD活性在不同河段以及不同暴露时间段内均产生了一定的变化趋势,但总体来说变化并不显著,对污染因子反应不敏感。

图7 野外连续暴露10 d、20 d沉积物重金属对中华圆田螺组织SOD活性的影响
2.3.5 MT含量的响应 MT是一些低相对分子质量的、富含半胱氨酸和巯基、能够结合金属的蛋白或多肽[16]。MT具有很强的诱导性,当细胞内的Cu2+浓度增高时,机体组织内可诱导MT合成。本次研究中,乐安河野外暴露实验环境因子对田螺机体MT诱导作用如图8所示。此次研究中MT含量在1.461~10.215 μg/g变化,对MT的诱导作用非常显著,主要表现在乐安河中游及下游区域。上游区域在3次监测实验中MT含量较低,中游区域MT含量迅速上升,直至下游都呈现出诱导作用。由于在第4个监测点开始陆续出现排污口、采沙船等,且出现铜矿污染,中游监测点连续暴露10 d后螺体内MT含量最高,随着暴露时间的延续,中游与下游螺体内MT含量呈现出持续高水平;较中游相比,下游诱导作用一定程度上低于中游监测点。在接下来的持续暴露中(连续暴露20 d),污染物继续进入螺蛳体内,而中游监测点MT含量出现一个峰值后保持稳定;下游监测点螺蛳体内MT含量呈持续诱导作用。本次试验监测区域中游出现铜矿污染源且研究表明,MT具有调节微量元素(主要是Cu、Zn)储存、运输和代谢的作用,对重金属具有解毒作用。因此,此次野外暴露实验用螺蛳组织内MT含量的变化情况能够较好地反应出研究区域主要污染源的污染程度。
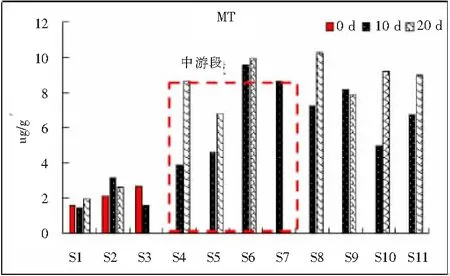
图8 野外连续暴露10d、20d沉积物重金属对中华圆田螺组织MT含量的影响
2.3.6 IBR指数分析 综合生物标志物响应指数(the biological response indices,IBR)是一种综合运用多种生物标志物定性评估生物对环境压迫的响应指标,模型能够综合地反映环境状况对生物的胁迫作用,同时又可直观地体现各环境因子对总胁迫作用的贡献率[17-18]。表示方法为:对生物标志物进行标准化处理,以各生物标志物标准化后数值绘制成星状图,通过将相邻标志物的Ai值所围成三角形的面积[(Ai+Ai+1)/2]依次相加即得到IBR值。由于IBR值与所选生物标志物指标数量(n)密切相关,将IBR值除以n以便于比较。
中下游8个点位田螺原位连续暴露10 d与20 d综合生物标志物响应指数范围分别为:6.092~15.922、6.226~8.19,其中较大的数值出现在连续暴露20 d后的S4~S7点位,且中游4个点位连续暴露20 d后IBR指数明显大于连续暴露10 d后,这可能与重金属分布有一定的关系,随着暴露时间的延续,较高的重金属含量对生物胁迫作用持续增强;而下游重金属含量较低的区域环境因素对生物胁迫作用效果缓慢显现。
第1次连续暴露10 d与第2次连续暴露20 d各标志物对IBR值贡献率有明显的不同,连续暴露10 d后各点位5个标志物对IBR值贡献率无明显差异,而连续暴露20 d后贡献率有明显差异。S4~S6点位中环境因素主要通过刺激螺体内MT含量与SOD活性反映其生物胁迫作用,MDA含量对IBR值贡献较低;S8~S11点位中环境因素主要通过刺激螺体内MT含量与tCHE活性反映其对生物的胁迫作用,MDA含量与GSH活性对IBR值贡献较低。IBR能整合系列标志物的响应值,反映监测区域的污染程度,并能作出早期预警。研究表明,IBR越大生物所受影响越大,在野外研究调查中可以直观地反映不同地点、不同采样时间的污染程度;在实验室研究中可用于定量评价某种污染物不同剂量对生物体的毒理效应。因此本次以中华圆田螺为指示生物进行野外暴露试验,其研究结果能够较好地反映乐安河中下游区域生物污染变化情况。

黑线为暴露10 d;红色为暴露20 d,其中S7点位暴露20 d样品已丢失
2.4 酶活性胁迫因子
7种重金属中除了Cd以外,均对底栖螺生物特性产生一定影响。从分析结果看,并非Gu对标志物胁迫作用最强,在连续暴露10 d和20 d后,沉积物中Cr和As对5种标志物的胁迫作用最明显。TChE前期受Pb和Cr的影响活性上升,随着暴露时间的延续,Ni元素对TChE活性产生抑制作用;MDA含量前期对Cr的响应明显,后期Ni元素对其含量有促进作用。相对而言,影响螺组织内GSH含量、SOD活性以及MT含量的重金属种类较多,GSH含量前期主要受Cr和As含量的影响,暴露后期受Gu、Zn和As的共同作用;SOD活性对Pb、Cr和As含量响应明显,且暴露前期和后期胁迫因子一致;MT含量暴露前期与后期均受Gu、Zn和As的影响(表3)。由此可见,底栖螺生物标志物对沉积物重金属含量的胁迫响应有较大差别,并非含量高就对标志物的胁迫作用强,每种生物标志物对生境的响应过程均是不同污染因子共同作用的结果。
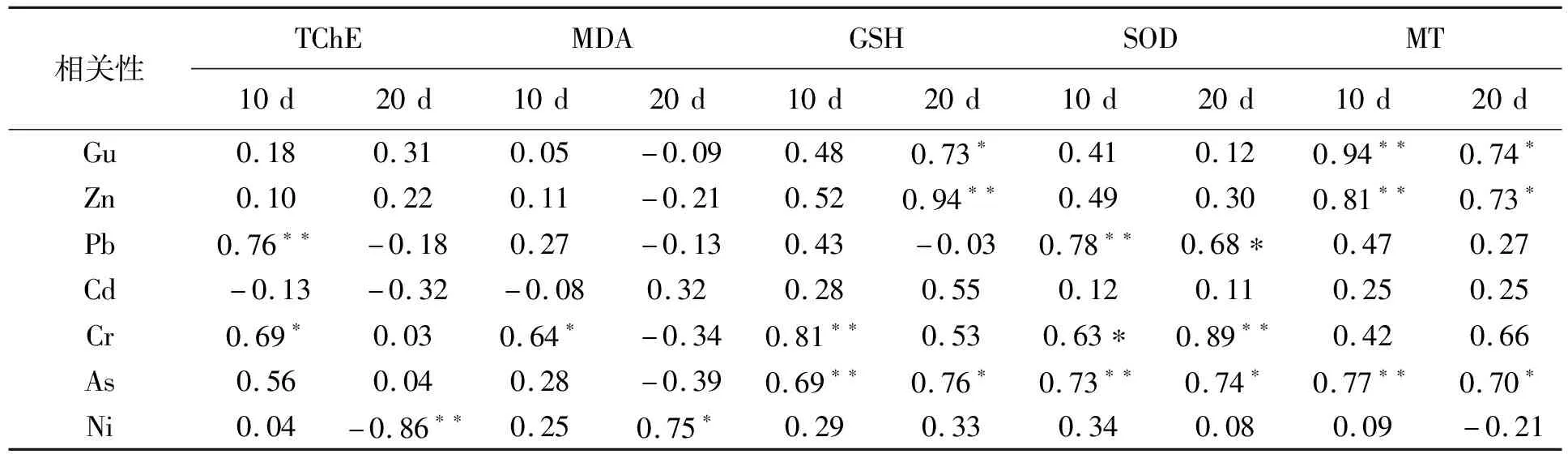
表3 底栖螺生物标志物与重金属含量相关性分析
3 结论
本文以乐安河沉积物重金属为研究对象,通过野外采样、原位实验、实验室分析等系统阐述了乐安河沉积物重金属含量分布特征及其对底栖螺生物标志物的影响,主要结论如下。
1)自上游至下游采集11个沉积物样品,重金属的平均含量从大到小依次为:Cu>As>Pb>Zn>Ni>Cr>Cd,其中,Cu的含量空间差异性最大,其余6种重金属中在11个点位中仍表现出一定的空间分异特征。
2)各种重金属地累积指数均表现出不同程度的自上游向下游污染程度逐渐加重的趋势。由于德兴铜矿的影响,Gu污染下游S6~S11点位地累积指数为重度以上污染;Cd有3个点位(S1、S6、S8)为偏重度污染,其余5种重金属在11个沉积物样品中基本处于偏中度污染状态。
3)原位暴露实验中TChE、MDA、GSH、SOD以及MT等指标对沉积物重金属的响应机制整体上为:中游>下游>上游;MT和TChE其活性(含量)随着暴露时间的延长持续上升,MDA和 GSH活性(含量)响应过程表现为连续暴露10 d大于连续暴露20 d,SOD活性连续10 d和20 d暴露后无明显差异。
4)7种重金属中除了Cd以外,均对底栖螺生物特性产生一定影响。沉积物中Cr和As对5种标志物的胁迫作用最明显。TChE主要受Pb、Cr以及Ni元素的影响;MDA含量前期对Cr的响应明显,后期Ni元素对其含量有促进作用。相对而言,影响螺组织内GSH含量、SOD活性以及MT含量的重金属种类较多。
