Klotho、ET-1 在新生血管性青光眼患者中表达及临床意义
2022-03-07郭九春吕静
郭九春,吕静
新生血管性青光眼(neovascular glaucoma,NVG)是房角纤维血管增生引起小梁网阻塞,进而导致虹膜粘连、房角关闭、房水循环障碍和眼内压升高,降眼压药物治疗效果差,往往需要手术治疗[1]。NVG 发病机制尚不清楚,可能与炎性反应、新生血管因子生成、细胞外基质作用、氧化应激等有关[2]。新生血管形成是NVG 发病的主要病理机制之一,探讨与新生血管相关的分子机制有助于早期诊断、指导临床治疗、评估病情进展。Klotho 是一种抗衰老相关蛋白,其表达缺失与动脉粥样硬化、器官萎缩、骨质疏松、认知功能障碍等老年性疾病有关,近年来研究发现Klotho 对维持血管正常功能有重要作用[3]。内皮素-1(endothelin-1,ET-1)是参与炎症反应过程的血管活性物质,具有收缩血管、调节血管内皮细胞生成、分化和迁移作用[4]。Klotho、ET-1 是否参与NVG 发病和疾病进展过程尚不清楚,其机制尚待探讨,本研究检测NVG 患者房水、血清中Klotho、ET-1 水平,分析其与血管内皮生长因子(vascular endothelial growth factor,VEGF)、炎性因子和疾病进展的关系,旨在为临床治疗、病情评估提供理论依据。
1 对象与方法
1.1 研究对象
选择2016 年8 月—2019 年10 月滨州市第二人民医院眼科住院病房收治的NVG 患者(NVG 组)62 例(62 只眼)。另选择同期眼科收治的年龄相关性白内障患者51 例(51 只眼)为对照组。NVG 组:男34 例,女28 例,年龄48~59 岁,平均(53.26±4.12)岁,左眼25 例,右眼37 例。Teich 分级:Ⅱ级13 例,Ⅲ级25 例,Ⅳ级24 例。原发病分布:视网膜静脉阻塞20 例,糖尿病性视网膜病变15 例,原发性青光眼9 例,视网膜母细胞瘤8 例,眼外伤6 例,其它4 例,其中视网膜静脉阻塞合并高血压病16 例,糖尿病性视网膜病变合并高血压病7 例,原发性青光眼合并高血压病5 例。手术治疗方式:全视网膜光凝手术24 例,青光眼滤过手术29 例,全视网膜光凝手术联合抗VEGF 药物治疗5 例,青光眼滤过手术联合抗VEGF 药物治疗4 例。对照组:男28 例,女23 例,年龄46~60 岁,平均(54.02±4.37)岁,左眼21 例,右眼30 例。2 组年龄、性别、患眼分布比较差异无统计学意义(P>0.05),本研究已获得医院伦理委员会批准(2018-12-045)。
1.2 诊断标准、纳入标准和排除标准
诊断标准:(1)有原发病的病史或体征;(2)眼压>21 mmHg(1 mm Hg=0.133 kPa),多数伴有眼痛、畏光、视力下降等症状;(3)虹膜表面及前房角可见到新生血管,瞳孔散大,瞳孔缘色素外翻[5]。
根据虹膜新生血管Teich 分级标准[6]分为,Ⅰ级:虹膜瞳孔缘新生血管0~1 个象限;Ⅱ级:虹膜瞳孔缘新生血管>2 个象限;Ⅲ级:虹膜瞳孔缘及睫状体存在新生血管和/或葡萄膜外翻1~3 个象限;Ⅳ级:虹膜瞳孔缘及睫状体存在新生血管和/或葡萄膜外翻>3 个象限。
纳入标准:(1)符合NVG 诊断标准;(2)单眼患NVG;(3)对照组经系统检查排除眼底疾病、青光眼、眼内感染、眼内肿瘤等疾病,亦无全身系统性疾病;(4)患者及其家属均知情同意并签署同意书。
排除标准:(1)合并葡萄膜炎、玻璃体炎、眼内肿瘤等眼科疾病;(2)妊娠期NVG 患者;(3)合并急慢性感染、免疫系统疾病、恶性肿瘤者;(4)合并有精神系统疾患或未成年患者。
1.3 方法
1.3.1 标本采集方法 入院后第2 d 清晨采集空腹静脉血标本5 ml,经离心(4℃,3,000 r/min,离心时间15 min,离心半径10 cm),取血清保存于-80℃超低温冰箱(Thermo Fisher 公司)待检。房水采集方法:开睑,常规消毒结膜囊,生理盐水冲洗后无菌纱布拭干,于眼球切口前采用1 ml 无菌注射器抽取约0.15 ml房水,注入无菌试管中-80℃保存待检。
1.3.2 Klotho、ET-1、炎性细胞因子指标检测 ALISEI 全自动酶标仪(意大利SEAC 公司)采用酶联免疫吸附试验检测血清、房水中Klotho、ET-1、VEGF、白细胞介素6(interleukin-6,IL-6)、白细胞介素8(interleukin-8,IL-8)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平,试剂为美国Epitope Diagnostics 公司。
1.4 统计学方法
采用SPSS 25.0 进行数据的处理和分析,计量资料采用均数±标准差()进行描述,Student t 检验或One-Way 方差分析组间差异。计数资料以率(%)表示,采用χ2检验。采用Pearson 相关系数(r)描述Klotho、ET-1 与炎性因子、VEGF 之间相关性,采用Spearman 秩相关系数(r)描述Klotho、ET-1 与Teich 分级之间相关性,所有统计均采用双侧检验,检验水准α=0.05,以P<0.05 表示差异有统计学意义。
2 结果
2.1 血清、房水中Klotho、ET-1 水平比较
NVG 组房水、血清中Klotho 水平低于对照组,t房水=14.486,t血清=10.000,均P=0.000。ET-1 水平高于对照组,t房水=42.086,t血清=30.066,均P=0.000,均有统计学意义(P<0.05)(表1)。
表1 2 组血清、房水中Klotho、ET-1 水平差异()
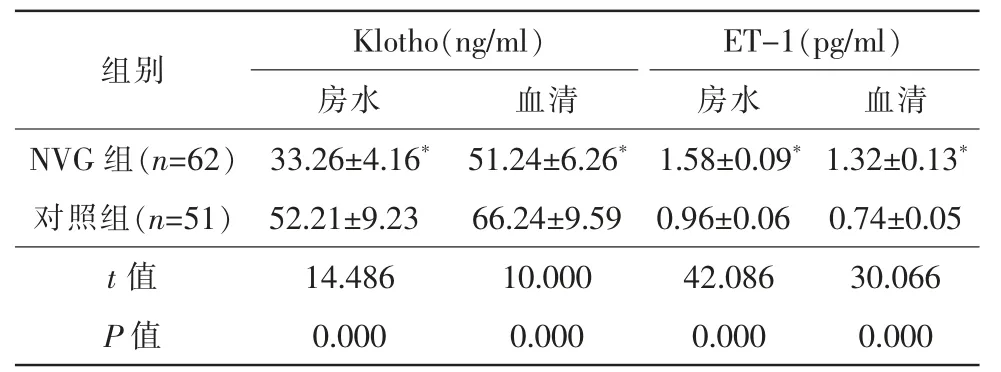
表1 2 组血清、房水中Klotho、ET-1 水平差异()
注:* 与对照组同亚组比较,P<0.05。ET-1 内皮素-1;NVG 新生血管性青光眼
2.2 患者血清、房水中VEGF 及炎性细胞因子比较
VEGF:NVG 组房水、血清中VEGF 水平高于对照组,t房水=78.161,t血清=34.949,均P=0.000,均有统计学意义(P<0.05)(表2)。
IL-6:NVG 组房水、血清中IL-6 水平高于对照组,t房水=56.977,t血清=18.686,均P=0.000,均有统计学意义(表2)。
IL-8:NVG 组房水、血清中IL-8 水平高于对照组,t房水=44.505,t血清=23.069,均P=0.000,均有统计学意义(表2)。
TNF-α:NVG 组房水、血清中TNF-α 水平高于对照组,t房水=15.659,t血清=11.096,均P=0.000,均有统计学意义(表2)。
表2 2 组血清、房水中VEGF、IL-6、IL-8、TNF-α 水平差异()

表2 2 组血清、房水中VEGF、IL-6、IL-8、TNF-α 水平差异()
注:* 与对照组同亚组比较,P<0.05。NVG 新生血管性青光眼;VEGF 血管内皮生长因子;IL-6 白细胞介素6;IL-8 白细胞介素8;TNF-α 肿瘤坏死因子α
2.3 不同Teich 分级患者血清、房水Klotho、ET-1水平比较
NVG 患者血清、房水Klotho 水平随着Teich 分级的增加而降低(F房水=16.352,F血清=8.569,均P=0.000),ET-1 水平随着Teich 分级的增加而升高(F房水=23.651,F血清=12.351,均P=0.000),各亚组间差异均具有统计学意义(P<0.05)(表3)。
表3 不同Teich 分级患者血清、房水中Klotho、ET-1水平差异()

表3 不同Teich 分级患者血清、房水中Klotho、ET-1水平差异()
注:a 与Ⅱ级组同亚组比较,P<0.05;b 与Ⅲ级组同亚组比较,P<0.05。ET-1 内皮素-1
2.4 不同Teich 分级血清、房水VEGF 及炎性细胞因子比较
VEGF:NVG 组房水、血清中VEGF 水平随着Teich 分级的增加而升高,F房水=23.165,F血清=19.354,均P=0.000,均有统计学意义(表4)。
IL-6:NVG 组房水、血清中IL-6 水平随着Teich分级的增加而升高,F房水=18.241,F血清=21.054,均P=0.000,均有统计学意义(表4)。
IL-8:NVG 组房水、血清中IL-8 水平随着Teich分级的增加而升高,F房水=13.264,F血清=16.342,均P=0.000,均有统计学意义(表4)。
TNF-α:NVG 组房水、血清中TNF-α 水平随着Teich 分级的增加而升高,F房水=14.243,F血清=16.351,均P=0.000,均有统计学意义(表4)。
表4 不同Teich 分级患者血清、房水中VEGF、IL-6、IL-8、TNF-α 水平差异()
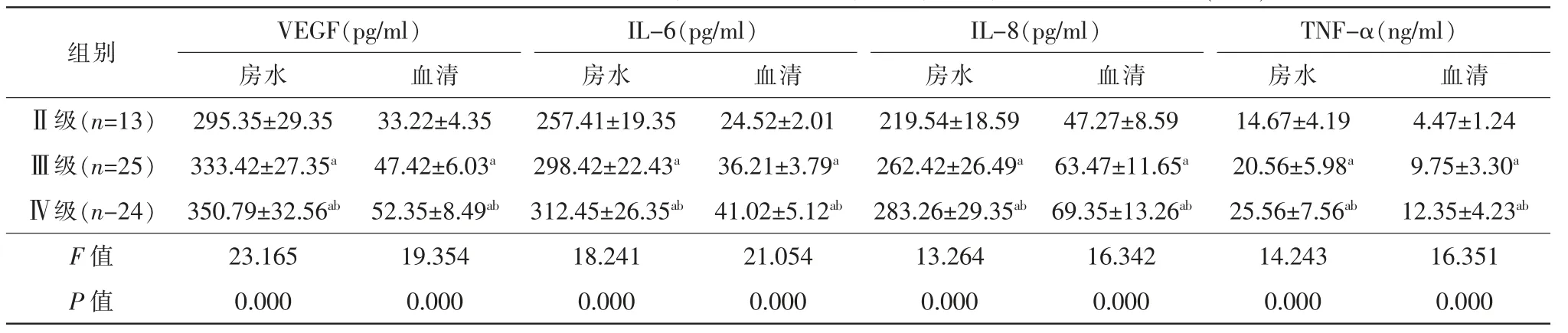
表4 不同Teich 分级患者血清、房水中VEGF、IL-6、IL-8、TNF-α 水平差异()
注:a 与Ⅱ级组同亚组比较,P<0.05;b 与Ⅲ级组同亚组比较,P<0.05。VEGF 血管内皮生长因子;IL-6 白细胞介素6;IL-8 白细胞介素8;TNF-α 肿瘤坏死因子α
2.5 NVG 患者Klotho、ET-1 水平与炎性细胞因子、VEGF、Teich 分级相关性
NVG 患 者Klotho 水 平 与VEGF、IL-6、IL-8、TNF-α、Teich 分级均呈负相关(P<0.05),ET-1 与VEGF、IL-6、IL-8、TNF-α、Teich分级均呈正相关(P<0.05)(表5)。

表5 NVG 患者Klotho、ET-1 水平与炎性细胞因子、VEGF、Teich 分级相关系数
3 讨论
NVG 是以虹膜、角膜新生血管形成引起的眼压升高为特征的眼内疾病,该病主要发病机制是视网膜毛细血管网闭塞造成的视网膜缺血缺氧,进而诱导新生血管生长相关细胞因子释放,导致视网膜新生血管[7]。VEGF 是作用较强的促内皮细胞增殖和血管生成的细胞因子,正常人视网膜色素上皮细胞低度表达VEGF,发挥维持视网膜血管系统稳定性和正常功能作用[8]。VEGF 通过与其受体结合激活磷脂酰胆碱特异性磷脂酶C 和蛋白酶C,促使内皮细胞增生、迁移,血管通透性增加,促使新生血管形成[9]。本研究NVG 组房水、血清VEGF 水平均高于对照组,这与多数研究结果一致[10-11],提示VEGF 过表达可能是导致NVG 发病和病情进展的主要机制之一。VEGF 合成、表达受多种炎性细胞因子、表皮生长因子、胰岛素样生长因子等细胞因子调节,上述因子共同作用下促使了NVG 新生血管形成[12]。探讨与VEGF 密切相关的生物学指标有助于明确NVG 发病机制,为临床治疗提供参考。
Klotho 是由5 个外显子和4 个内含子组成的膜结合或可溶性抗衰老基因,在肾、脑、血管、上皮组织、视网膜、神经组织等有广泛的分布,具有调节钙磷代谢、保护心血管系统、抗炎、抗氧化、抗细胞凋亡等作用[13]。Klotho 缺乏可导致血管钙化、内皮功能损害,血管正常功能异常[14]。Klotho 是否参与NVG 新生血管形成尚不清楚,本研究发现NVG 患者房水、血清中Klotho 水平均低于对照组,Klotho 水平随着虹膜新生血管分级的增加而降低,Klotho 水平与Teich 分级呈负相关,说明Klotho 缺失可能是NVG发病和病情进展的主要因素,检测血清Klotho 水平可为临床NVG 病情严重程度判断提供参考。推测Klotho 参与NVG 的发病和病情进展的可能机制为:Klotho 基因表达缺失状态下,血管内皮细胞凋亡增加,血管完整性受损,收缩功能障碍[15],导致视网膜血流灌注不足,局部组织在缺血缺氧刺激下进一步诱导VEGF 表达,进而促使新生血管形成。Klotho 合成越少,新生血管生成越多,NVG 患者Teich 分级越高,Klotho 可作为NVG 病情评估的辅助生物学指标。本研究相关性分析显示Klotho 水平与VEGF 呈负相关,说明Klotho 在NVG 新生血管形成中可能与VEGF 存在相互调节、抑制作用,Klotho 缺失,VEGF 过表达可能促使了新生血管形成,加重病情进展。
ET-1 是具有强烈收缩血管和促血管平滑肌细胞增殖作用的血管活性物质,由内皮素前体在内皮素转化酶作用下转化而成,在血管内皮细胞、平滑肌细胞、虹膜、睫状体非色素上皮细胞、视网膜色素上皮细胞均有广泛的表达。ET-1 具有多种生物学活性,参与炎性疾病、高血压病、动脉粥样硬化发生和发展[16]。近年来研究[17]发现ET-1 具有诱导血管生成、分化作用,高水平ET-1 可能诱导眼球后血流动力学异常,导致视网膜血管血流灌注减少,与青光眼发病密切相关。本研究结果显示NVG 患者房水、血清中ET-1 水平高于对照组,ET-1 水平与Teich 分级呈正相关,提示ET-1 高表达可能促使了NVG 的发病和进展。ET-1 参与NVG 发病和病情进展的可能机制为:首先,ET-1 高表达可直接提高内皮细胞增殖、迁移、侵袭能力,诱导血管新生[17]。其次,ET-1过度表达可导致小梁细胞氧化损伤,引起血流灌注不足和组织缺血缺氧[18],并刺激中性粒细胞过氧化物产生介导氧化应激反应[19],促使新生血管形成。本研究中ET-1 水平与VEGF 呈高度正相关,提示ET-1 与VEGF 相互作用参与NVG 新生血管形成过程,ET-1 作为一种促血管生成因子参与了NVG 新生血管形成的各个阶段。相关报道[20]指出瘢痕组织中ET-1 呈高度表达,ET-1 与VEGF 发挥协同作用机制共同促使新生血管形成。因此,ET-1 水平能反映NVG 患者病情严重程度,可为临床病情评估提供参考。
IL-6 是前炎性细胞因子,通过诱导T 细胞、B 细胞增殖、刺激免疫球蛋白分泌参与免疫调节过程[21]。IL-8 是促炎细胞因子,其表达升高可破坏视网膜血管屏障,导致视网膜毛细血管损伤过程[22]。TNF-α 可诱导视网膜色素上皮细胞和血管内皮细胞连接,破坏血-视网膜屏障,促使视网膜从非增殖状态向新生血管转变[23]。本研究发现房水、血清中Klotho 水平均与IL-6、IL-8、TNF-α 呈负相关,ET-1 与IL-6、IL-8、TNF-α 呈正相关,提示Klotho、ET-1 可能通过参与调控炎症反应参与NVG 发病和病情进展。Klotho可调节组织炎症反应,抑制NLRP3 炎症小体,降低TNF-α、IL-1β、IL-18 等炎性细胞因子水平[24]。ET-1是重要的促炎性介质,能促使TNF-α、IL-6 等炎性细胞因子释放,细胞黏附分子表达[25],因此Klotho 低表达,ET-1 高表达可能导致NVG 局部炎症反应扩大,进而诱导VEGF 表达,促使新生血管形成。
综上,NVG 患者房水、血清中Klotho 水平降低,ET-1 水平增高,Klotho 缺失、ET-1 过度表达可能诱导VEGF 表达,进而刺激房角、虹膜等局部组织新生血管形成。Klotho、ET-1 可能通过调节局部炎性反应参与NVG 新生血管形成过程。Klotho、ET-1 可为NVG 发生和病情进展评估提供有效信息。
