5 株植物根际促生菌功能特性及培养条件
2022-03-05杨晓蕾李建宏梅丽娜朱青青赵晓倩赵树栋
杨晓蕾,李建宏,姚 拓,梅丽娜,李 琦,白 洁,朱青青,赵晓倩,赵树栋
(1.甘肃农业大学草业学院/ 草业生态系统教育部重点实验室,甘肃 兰州 730070;2.凉州区畜牧兽医技术推广,甘肃 武威 733000)
植物根际促生菌(plant growth promoting rhizobacteria,PGPR)是指能够在植物根际大量定殖,有效促进植物生长发育,并抑制病原菌生长的微生物[1]。长期探索已发现诸多优质菌种资源[2-4],利用优质PGPR 菌株研制微生物菌剂,与化肥配施,能有效降低化肥使用,提高作物产量[3-5]。
植物根际促生菌作为战略性微生物资源,利用其进行微生物菌剂开发目前已得到广泛应用。菌剂促生效果明显,能够通过改善植株生长的环境条件,对植物生长和产量的提高有非常明显的作用[6]。为了响应国家双减政策[7],应全面考虑发展绿色农业和保护生态环境,以微生物菌剂代替部分化肥,既改善了生态环境,促进了植物的生长,提高植物抗逆性,同时又改良土壤,提高土壤微生物多样性、透气性和对水的吸收能力,有效保护土壤肥力等,成为提高农业产品产量和质量以及保护生态环境的关键[8]。
微生物菌剂中活菌数是决定菌剂质量的关键,但工业化发酵工艺与技术发展存在一定弊端。生物发酵是指应用某种技术、培养装置、现代化技术和设施,大大提高微生物细胞的密度,使其有共同的良好生长状况,从而缩短微生物生长时间,减少培养所需区域的面积和体积,提高产品的产量和有效利用率,利用现代技术提高产品的未来增长量和增长率。利用发酵技术,可达到降低成本、提升质量的目的[9]。例如,对枯草芽孢杆菌(Bacillus subtilis) HS5B5进行发酵培养,针对该菌株进行培养基和发酵条件优化后,该菌株的细菌总数为9.2×108CFU·g-1,有效提高了菌液中有效活菌数[10];但目前对于植物根际促生菌菌株工业发酵运用研究报道较少,系统性对菌株生长特性研究不全面。因此,利用工业发酵技术,提高菌剂中活菌数量势在必行。
本研究以从武威天祝藏族自治县采集的珠芽蓼(Polygonum viviparum)、洽草(Koeleria glauca)、草地早熟禾(Poa pratensis)及兰州市七里河区采集的红三叶(Trifolium pratense)根际分离的菌株为对象,对其促生特性进行测定,同时进行生长特性指标测定,探究菌株对温度、pH 的耐受性以及生长过程中产气产酸特性,利用16S rDNA 确定菌株分类学地位,为后期利用高密度发酵技术,工业化生产菌剂奠定基础。
1 材料与方法
1.1 供试菌株
将研究前期从植物根际分离获得的保藏于安瓿瓶中的细菌活化,接种于LB 培养基,将菌株于4 ℃下保存备用。菌株信息如表1 所列。
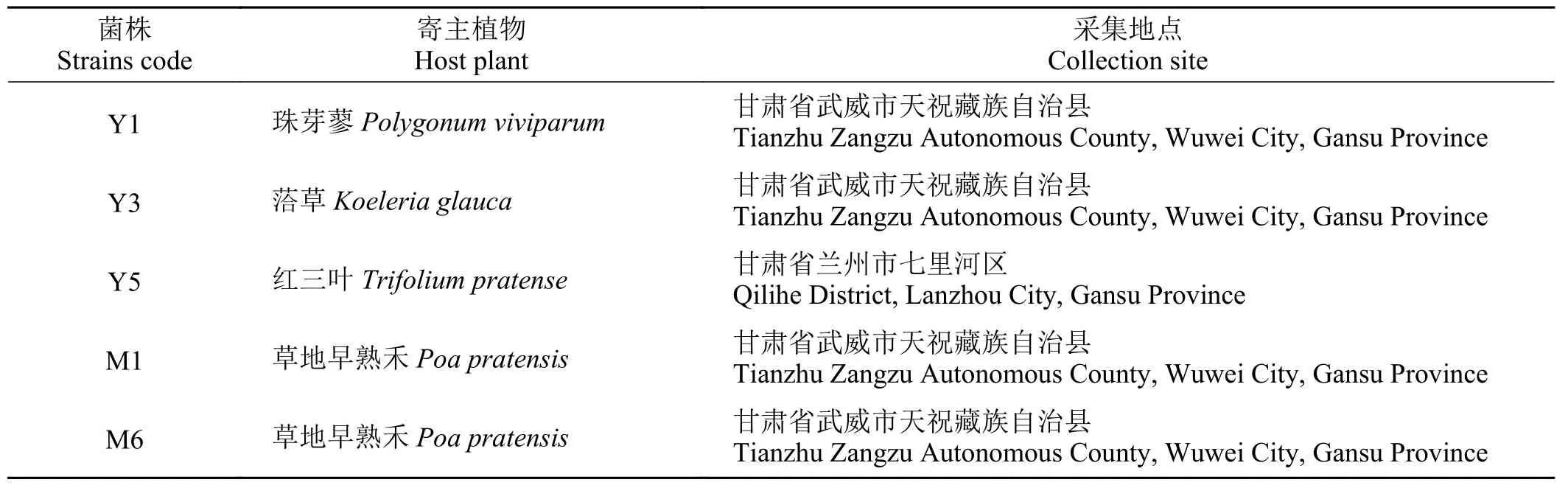
表1 供试菌株Table 1 Tested strains
1.2 培养基
LB 培养基[11]:蛋白胨10 g,酵母粉5 g,氯化钠(NaCl) 2 g,蒸馏水 1 000 mL,pH 7.0 (固体培养基添加琼脂粉 18.0 g)。
无机磷NBRIP (national botanical research institute’s phosphate)培养基[12]:葡萄糖10 g,磷酸钙[Ca3(PO4)2]5 g,六水合氯化镁(MgCl2·6H2O) 5 g,七水合硫酸镁(Mg SO4·7H2O) 0.25 g,氯化钾(KCl) 0.2 g;硫酸铵[(NH4)2SO4] 0.1 g,蒸馏水1 000 mL;pH 7.0。
有机磷蒙金娜培养基[13]:四水合硫酸锰(MnSO4·4H2O) 0.03 g,七水合硫酸亚铁(FeSO4·7H2O) 0.03 g,碳酸钙(CaCO3) 5.0 g,葡萄糖(C6H12O6) 10.0 g,硫酸铵[(NH4)2SO4] 0.5 g,大豆卵磷脂 0.2 g,氯化钠(NaCl)0.3 g,氯化钾(KCl) 0.3 g,酵母粉 0.4 g,琼脂粉 18.0 g,蒸馏水 1 000 mL;pH 7.0。
固氮NFM (nitrogen free medium)培养基[14]:二水合氯化钙(CaCl2·2H2O) 0.02 g,七水合硫酸镁(MgSO4·7H2O) 0.2 g,磷酸氢二钾(K2HPO4) 0.5 g,二水合钼酸钠(NaMoO4·2H2O) 0.002 g,氯化钠(NaCl) 0.1 g,苹果酸 5.0 g,氢氧化钾(KOH) 4.5 g,0.5% 溴百里香酚蓝5 mL,琼脂粉 2 g,蒸馏水1 000 mL;pH 7.0。
King 培养基[15]:蛋白胨20 g,磷酸氢二钾(K2HPO4)1.15 g,七 水合硫酸镁(MgSO4·7H2O)1.5 g,丙 三醇(C3H8O3) 15 mL。
1.3 菌株的促生特性测定
在无菌条件下,分别将菌株单菌落接种至盛有25.0 mL NBRIP 和蒙金娜液体培养基的50 mL 三角瓶中,在 28 ℃、180 r·min-1条件下振荡培养12 d,采用钼蓝比色法(molybdenum blues colorimetry,MBC),通过制作的磷标准曲线计算每株菌的溶磷量[12]。
采用乙炔还原法对菌株固氮酶活性进行定量测定[16]。用100 μL 平口微量进样器,从血清瓶中分别抽取混合气体100 μL 快速注入到气相色谱仪气体进样柱内,记录并观察C2H4出峰时间及峰面积百分比,计算出菌株固氮酶活性。
挑取菌株单菌落接种于盛有已灭菌的 25 mL King液体培养基的 50 mL 三角瓶中,在 28 ℃、180 r·min-1条件下振荡培养12 d。采用Salkowski 比色法,在黑暗下静置 30 min 后迅速用分光光度计在波长 530 nm下测定各待测液的吸光值,在标准曲线上查出待测液的 IAA 浓度(μg·mL-1)[17-18]。
1.4 菌株生长特性指标测定
1.4.1 菌株生长曲线测定
将选取的菌株活化培养24 h 后,以2%的接种量LB 培养液中,每4 h 测定菌液D600nm,连续测至72 h,绘制生长曲线。
1.4.2 菌株对温度的耐受性
在LB 培养基(pH 7)中接入2%的菌液,分别将其置于16、19、22、25、28、31、34、37、40、43、46 ℃的温度,180 r·min-1条件下培养,在培养48 h 时取样,测定菌群生长量(D600nm)。
1.4.3 菌株对pH 的耐受性
配制pH 分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0 的 LB 培养液,将待测菌株培养液2%接种于不同pH 的培养液中,置于28 ℃,180 r·min-1条件下培养48 h,测定菌群生长量(D600nm)。
1.4.4 菌株产气特性
将菌液以2%的接种量分别接种于装有杜氏小管的 LB 液体培养基中,过程中排尽杜氏小管中的空气,确保试验准确性。在 28 ℃的条件下静置培养,在12、24、36、48 h 时,进行观察并记录杜氏小管中的产气情况[19]。
1.4.5 菌株产酸特性
将选取的菌株活化培养24 h 后,以2%的接种量加入LB 培养液中,每4 h 用pH 计测定菌液pH,连续测至72 h。
1.5 菌株分类地位确定
采用细菌基因组提取试剂盒(TIANamp Bacteria DNA Kit-50),参考试剂盒说明书提取菌株总DNA,运用通用引物27F (5′-GAGTTTGATCCTGGCTCA G-3′)和1492R (5′-TACGGCTACCTTGTTACGACT T-3′) 对16S rDNA 片段进行PCR 扩增[20];4 ℃条件下进行保存,扩增产物委托甘肃奥科生物科技有限公司测序,将16S rDNA 序列在EZBioCloud 网站进行同源序列比较分析并使用MEGA 7.0 软件进行系统进化分析。
1.6 数据分析
采用Excel 2016 软件进行数据整理和作图,SPSS 25.0 进行数据单因素方差分析,用Duncan 法进行数据多重比较(P<0.05)。
2 结果与分析
2.1 菌株的促生能力
供试菌株中,M1 的有机磷溶磷量最高,为170.37 μg·mL-1,相比其他几株菌株,溶解有机磷效果显著;而Y3 与Y1 溶解无机磷能力较强,分别为308.50、102.41 μg·mL-1(表2)。综上,不同菌株溶解有机磷能力较弱,溶解无机磷能力强于溶解有机磷。菌株中只有Y1 及Y3 具有固氮能力,固氮酶活性分别为175.30、255.55 nmol (C2H4)·(h·mL)-1。供试菌株均具有分泌IAA 的能力,其中菌株Y1 分泌IAA 的能力最高,为164.74 μg·mL-1,菌株Y3 分泌IAA 的能力最低,为24.23 μg·mL-1。

表2 不同菌株促生能力Table 2 Growth-promoting ability of different strains
2.2 菌株的生长特性
2.2.1 菌株生长曲线测定
供试菌株的生长曲线如图1 所示。转接入LB 液体培养基后,0~6 h 菌株处于生长延滞期,生长速度缓慢。菌株Y3 与Y5 自6 h 起至12 h 的D600nm值呈指数增长,表明菌株处于生长对数期,继续培养,至48 h 菌株处于稳定生长期,48 h 后逐渐进入衰亡期。菌株Y1、M1、M6 自6 h 至16 h 为生长对数期,16 h 至40 h 曲线斜率减小,增殖速度变慢,40 h进入生长稳定期,在56 h 时,D600nm值减小,表示进入菌株衰亡期。
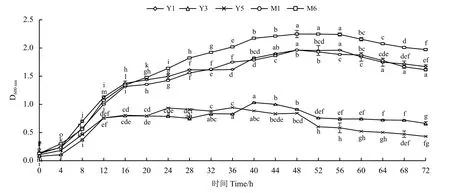
图1 菌株的生长曲线Figure 1 Growth curves of the bacterial strains
2.2.2 温度对菌株生长的影响
温度变化对供试菌株生长的影响表现不同(图2)。在16 ℃时,枯草芽孢杆菌Y3 和Y5 都停止生长,而到19 ℃,开始有微弱的生长,但生长速率不同。其余3 株菌株在16 ℃时,生长较为明显。19~25 ℃时,5 株菌株随着所处生长环境的温度升高,D600nm值逐渐增长,生长加快。25~31 ℃,菌株M1 生长受到抑制,其余菌株生长趋于平稳,但超过31 ℃,D600nm值均减小,菌株生长受到了抑制。到40 ℃以上,所有菌株的生长都明显受到了抑制。本研究的供试菌株对温度具有较好的耐受性,19~37 ℃都能生长,但适宜的生长温度在 25~31 ℃。
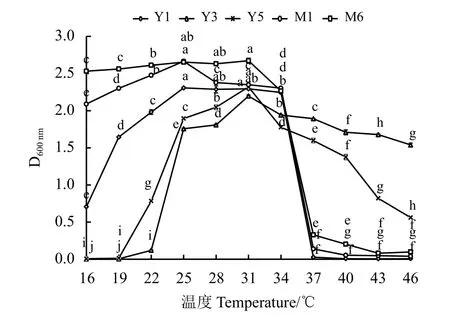
图2 菌株对温度的响应Figure 2 Temperature curves of the bacterial strains
2.2.3 pH 对菌株生长的影响
随着pH 的改变,菌株生长速率不断变化(图3)。pH 4.0 时,所有菌株生长微弱,D600nm在0.005~0.141,在pH 4.5~5.0,菌株开始快速生长,但不同菌株之间存在差异;在pH 4.5 时,菌株Y1 D600nm值为0.014,而菌株M6 在此时D600nm值为2.898;pH 7.0 时,各菌株的生长速率趋于平稳。而各菌株在pH 7.5 时的生长速率和pH 6.5 时生长速率相近,从而推测其最适生长pH 6.5~7.5。当pH 继续增大,到9.0 以上时,所有菌株D600nm值减小,生长都受到了严重的抑制,pH 10.0 时,除M6 以外,所有菌株基本停止生长。供试菌株对pH 具有相对较好的耐受性,pH 4.5~9.5都能生长,但最适的生长pH为6.5~7.5。
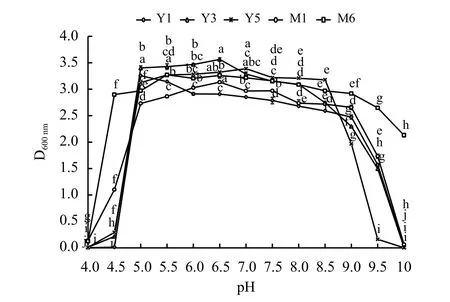
图3 菌株对pH 的响应Figure 3 pH curves of the bacterial strains
2.2.4 菌株生长过程中产气及产酸现象
利用杜氏小管,将菌液静置培养72 h,每12 h进行观察,在菌液生长过程中并无气泡产生,在后期发酵过程中,菌株自身产气并不会影响整体溶氧情况,阻碍发酵过程中菌体生长。而在整个菌株生长过程中,pH 稳定在6.23~7.52,Y3 与Y5 pH 维持在7.0 左右,而M1、M6 的pH 维持在6.7 左右。而Y1 的pH 变化较为明显,在16 h 时为6.23,而在后期生长过程中,pH 逐渐平稳,64 h 达到6.78 (图4)。
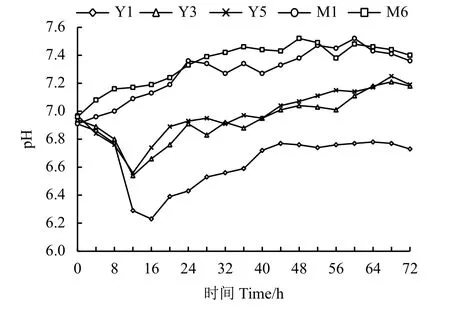
图4 菌株生长过程中pH 变化Figure 4 Changes in pH during bacterial growth
2.3 供试菌株分类地位确定
通过对供试菌株DNA 的提取及PCR 扩增检测,并测序获得的序列在EZBioCloud 网站(www.ezbio cloud.net)与进行比对分析(图5)。结果表明,Y5与Y3 相似,鉴定为枯草芽孢杆菌(Bacillussubtilis),Y1 为蕈状芽孢杆菌(Bacillus mycoides),M1 为产黄假单胞菌(Pseudomonas synxantha),M6 为猴假单胞菌(Pseudomonas simiae)。
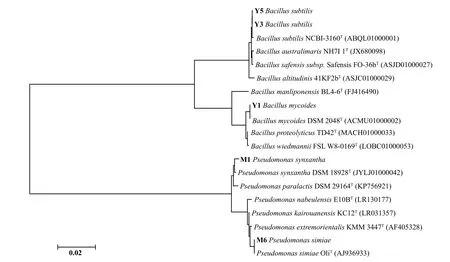
图5 代表菌株 16SrDNA 基因序列同源性构建的系统发育树Figure 5 Phylogenetic tree constructed by the homology of the 16S rDNA gene sequence
3 讨论与结论
本研究发现,供试菌株促生特性存在差异,多数菌株同时具有溶磷、固氮、分泌激素等多种功能特性。马文彬等[21]对豆科植物根际促生菌进行分离并研究发现多株菌株具有固氮、溶磷等多种功能特性。本研究发现,菌株溶解有机磷能力普遍比溶解无机磷能力弱,这一结果与马骢毓等[22]和蒋永梅[12]的研究结果相一致:由于细菌溶磷的过程复杂,自然环境中的碳源物质、氮源物质和微量元素的种类对菌株的溶磷量都有影响。5 株供试菌株中,M1 溶解有机磷量能力最强;Y3 和Y1 溶无机磷能力较高。由于部分细菌在代谢过程中分泌草酸、乙酸、乳酸等有机酸,同时与金属离子进行结合。因此,测定溶磷能力的过程中,这部分的溶磷能力难以被测定出来[23-24]。不同类型PGPR 固氮能力存在差异,本研究中涉及菌株仅有Y1 及Y3 具有固氮能力。其余菌株的固氮酶活性较低,其原因可能由于同一地区采集的寄主植物种类不同,而不同地区采集地的土壤质量存在差异,高寒地区与较低海拔城市中植株生长时当地的温度、光照[25]等条件差异较大,导致对菌株固氮酶活性有较大影响,后期有待深入研究其相关机理。IAA 作为植物的生长素物质[26],调控植物生长和发育过程,参与细胞分裂、组织分化等过程,由PGPR 菌株产生的IAA可直接影响根系与土壤接触的表面积,从而有效促进植物生长。5 株供试菌株中,均具有分泌IAA 的能力。
PGPR 菌株的发酵过程复杂,受到诸多条件的影响,因此将其培养环境加以优化十分关键[27],生物菌剂的工业化生产是菌剂应用推广过程中面临的最大问题。在工业生产中,有一类微生物对于某方面具有特殊功效或者是产生的代谢产物具有应用价值,同时可运用于工业生产开发,这类微生物就被称为工业微生物[28-29]。所以,鉴别工业微生物最主要的特征是需要满足工业化生产的需求,比如培养条件的满足度、生长速度、生长稳定性和生物安全性等为重要评判准则[29]。因此,决定菌株进入规模化工业开发的阶段的直接前提是菌株性能的稳定性。目前,实验室对于微生物的研究还着重于菌株的功能特性及功能基因挖掘,利用常规条件进行培养,对菌株的培养条件研究欠缺,从而导致某些试验中研究筛选的菌株在实验室条件下表现的功能特性非常突出,而在工业化生产过程中并不适用。本研究发现,菌株对温度具有相对较好的耐受性,19~37 ℃都能生长,但适宜的生长温度在25~31 ℃;菌株在pH 4.5~9.5 都能生长,但最适的生长pH 为6.5~7.5,对pH 具有相对较好的耐受性。由此表明菌株生长并不局限于常用的生长温度28 ℃、pH 7.0 的实验室条件。因此,在微生物的筛选工作中,应充分认识其生物学特性,研究并明确培养条件。
通过分子生物学鉴定发现,Y1、Y3、Y5 均为芽孢杆菌属,其繁殖能力强、易存活且具有多种促生功能,常作为生防功能菌被报道[30],从而在后期将对供试菌株的生防功能进行验证。M1、M6 为假单胞菌属,而假单胞菌是生防微生物的一个重要种类,也是自然界广泛分布的微生物之一,由于它繁殖迅速、定殖能力强、营养要求简单,可以抑制多种植物病害,同时具有促进植物生长的作用,被广泛研究[31],从而由此可以推断菌株应具有抑制病原菌的能力,在后期研究中对此应加以验证。
综上,5 株供试菌株中,M1 溶解有机磷量能力最强;Y1 和Y3 溶无机磷能力较高;Y1 和Y3 具有固氮能力;5 株菌均具有分泌IAA 的能力。通过对菌株生长特性测定,菌株延滞期为0~6 h,在40 h已进入生长稳定期,适宜的生长温度在25~31 ℃,适宜的生长pH 范围在6.5~7.5,生长过程中无产气现象,生长过程中pH 稳定在6.23~7.52。对5 株PGPR菌株进行分子生物学鉴定,Y3 和Y5 为枯草芽孢杆菌(Bacillussubtilis),Y1 为蕈状芽孢杆菌(Bacillus mycoides),M1为产黄假单胞菌(Pseudomonas synxantha),M6 为猴假单胞菌(Pseudomonas simiae)。为后期PGPR 菌株工业化开发奠定基础。
