神经母细胞瘤并骨转移患儿临床特征及预后相关因素的单中心分析
2022-03-05马越王珊李长春杨超赵珍珍杜小瑜邓晓斌孔祥如吕麟亚章均彭亮杜逸飞周建武孙建
马越 王珊 李长春 杨超 赵珍珍 杜小瑜 邓晓斌 孔祥如 吕麟亚 章均 彭亮 杜逸飞 周建武 孙建
重庆医科大学附属儿童医院肿瘤外科,儿童发育疾病研究教育部重点实验室,国家儿童健康与疾病临床医学研究中心,儿童医疗大数据智能应用重庆市高校工程研究中心,儿童发育重大疾病国家国际科技合作基地,重庆 400010
神经母细胞瘤(neuroblastoma,NB)是儿童常见的颅外恶性实体肿瘤,好发于肾上腺髓质或分布有交感神经系统的任何部位。该病起病隐匿,早期难以发现,恶性程度高,病情进展快,病死率较高。NB最常见的转移部位是骨髓(>50%)和骨骼,患儿主要表现为肢体疼痛、跛行或病理性骨折等,其次为肝脏及皮肤病变[1]。低中危患儿5年生存率可达75%~98%,但高危患儿5年生存率不足50%[2]。如何改善高危NB患儿预后是各儿童肿瘤治疗中心面临的重要课题。本研究旨在总结重庆医科大学附属儿童医院肿瘤外科收治的伴骨转移NB患儿的临床特征、预后以及诊疗经验,以指导临床工作并提高伴骨转移NB患儿的生存率。
材料与方法
一、研究对象
以2013年12月至2020年12月本院收治的伴骨转移NB患儿为研究对象。病例纳入标准:首诊时X线、CT、超声、MRI、ECT、PET-CT等至少一项影像学检查提示存在骨质破坏;确诊后于本院进行正规化疗至少2个疗程。本研究经重庆医科大学附属儿童医院医学伦理委员会批准[(2019)年伦审(研)第(235)号],患儿家属知情并签署同意书。
二、治疗方案
根据国际神经母细胞瘤分期系统(International Neuroblastoma Staging System,INSS)及美国儿童肿瘤协会(Children’s Oncology Group,COG)的分危系统对确诊的NB患儿进行分期及危险度分组,中危组患儿化疗方案参考COG方案和中国抗癌协会小儿肿瘤专业委员会神经母细胞瘤诊疗方案(Chinese Children’s Cancer Group-Neuroblastoma,CCCG-NB)方案;高危及难治复发患儿化疗方案参考COG方案和CCCG-NB方案,并结合患儿化疗药物敏感检测结果及治疗过程中化疗反应、副作用以及治疗效果及时调整;高危及难治复发组治疗方案为以化疗、手术、放疗、扶正祛瘤中药维持等为主的综合治疗模式。
三、随访方法
于每一次化疗过程中复查患儿病灶区超声、淋巴结超声、尿香草杏仁酸(vanillylmandelic acid,VMA)、血神经元特异性烯醇化酶(neuron-specific enolase,NSE)、乳酸脱氢酶(lactate dehydrogenase,LDH)等指标。对伴有骨髓转移患儿间隔1~2月复查骨髓涂片,伴骨转移患儿间隔6个月复查骨扫描或PET-CT。患儿治疗完成后半年内,每个月门诊复查1次;治疗完成后半年至2年,每3个月门诊复查1次;治疗完成超过2年,每6个月门诊复查1次。门诊复查项目包括病灶区超声、淋巴结超声以及尿VMA、NSE、LDH等指标,间隔6个月以上复查1次CT。患儿生存时间为诊断日期至随访截止日期(2021年3月31日)、患儿死亡或终止治疗日期。失访患儿生存状态的评估以末次随访结果为准。
四、疗效评估方法
完全缓解(complete response,CR):影像学检查显示原发瘤灶及转移灶均无残留,维持时间在4周以上;部分缓解(partial response,PR):原发瘤灶及转移瘤灶体积缩小50%以上,且维持时间超过4周;无缓解(no response,NR):未出现新发瘤灶,原有瘤灶体积缩小50%以下或体积增大超过25%;进展(progressive disease,PD):出现新发瘤灶或原有瘤灶增大超过25%。伴骨转移NB患儿每隔6个月复查骨扫描或经PET-CT评估骨转移病灶缓解情况。
五、统计学处理
采用SPSS 24.0软件进行统计学分析。采用Kaplan-Meier生存分析法对患儿性别、年龄、肿瘤生长特点、有无骨髓转移、是否多类骨转移、实验室检查指标、Shimada分型、NMYC基因是否扩增、手术切除范围等变量资料进行单因素生存分析;利用Cox回归分析法对有意义的单因素进行多因素分析,各组间差异的比较采用Log-rank检验。P<0.05为差异有统计学意义。
结 果
一、一般资料
2013年12月至2020年12月本院共确诊神经母细胞瘤403例,其中113例(27.5%)发生骨转移,INSS分期均为Ⅳ期。在发生骨转移的患儿中,有97例在本院首诊且接受2个及以上疗程的规范化疗,其中男68例(70.1%),女29例(29.9%),男女比例为2.4∶1;就诊年龄4~141个月,中位年龄49.4个月,首诊时年龄大于1岁者有83例(83/97,85.6%);合并骨髓转移71例(73.2%),无骨髓转移26例(26.8%);高危组95例(97.9%),中危组2例(2.1%)。
二、临床特征
97例患儿首诊时临床表现包括:发热47例(48.5%)、骨痛38例(39.2%)、腹痛或腹胀29例(29.9%)、咳嗽15例(15.5%)、体表包块14例(14.4%)、腹部包块13例(13.4%)等。原发瘤灶位于腹膜后或肾上腺区72例(74.4%),纵隔20例(20.6%),腹膜后以及纵隔3例(3.1%),骶尾部2例(2.1%)。首诊影像学检查提示瘤灶最大直径为1.3~19.8 cm,其中瘤灶最大直径>10 cm者37例(38.1%),肿瘤跨中线生长者69例(71.1%),肿瘤包绕重要血管生长者61例(62.9%)。骨转移部位包括椎体57例(59.8%)、骨盆骨48例(49.5%)、四肢长骨42例(43.5%)、肋骨22例(22.7%)以及颅骨15例(15.5%)等。61例(62.9%)存在2种及2种以上骨转移灶。97例中,首诊LDH测定值大于660 U/L(正常值≤330 U/L)者43例(44.3%),尿VMA测定值超出正常范围者65例(67.0%)。79例行NMYC基因检测,NMYC基因扩增26例(32.9%)。77例行Shimada分型检测,UFH型58例(75.3%)。71例行Ki67检测,Ki67阳性率大于50%者30例(42.3%)。53例行NSE检测,NSE测定值大于50μg/L者46例(86.8%)。
三、手术情况
97例确诊后于本院行2个及以上疗程规范化疗,其中有82例予手术治疗,对位于纵隔的肿瘤视情况采取开放手术或腔镜手术,位于腹部的肿瘤均行开放手术,术中保留肾脏。82例中,于肉眼下完全切除肿瘤56例,肉眼下见肿瘤残留26例。
四、生存情况
根据COG危险度分组,97例中仅有2例为中危组,其余95例为高危组。截止随访日期,中危组2例均无病存活,随访时间分别为14个月及16个月;高危组死亡52例,存活43例;其中复发及进展57例。52例死亡患儿中,2例死于并发症,50例死于肿瘤进展或复发。97例生存时间2~88个月,中位生存时间22.1个月;采用Kaplan-Meier法进行生存曲线分析,预计1年生存率为93.6%,5年生存率为20.2%(图1)。
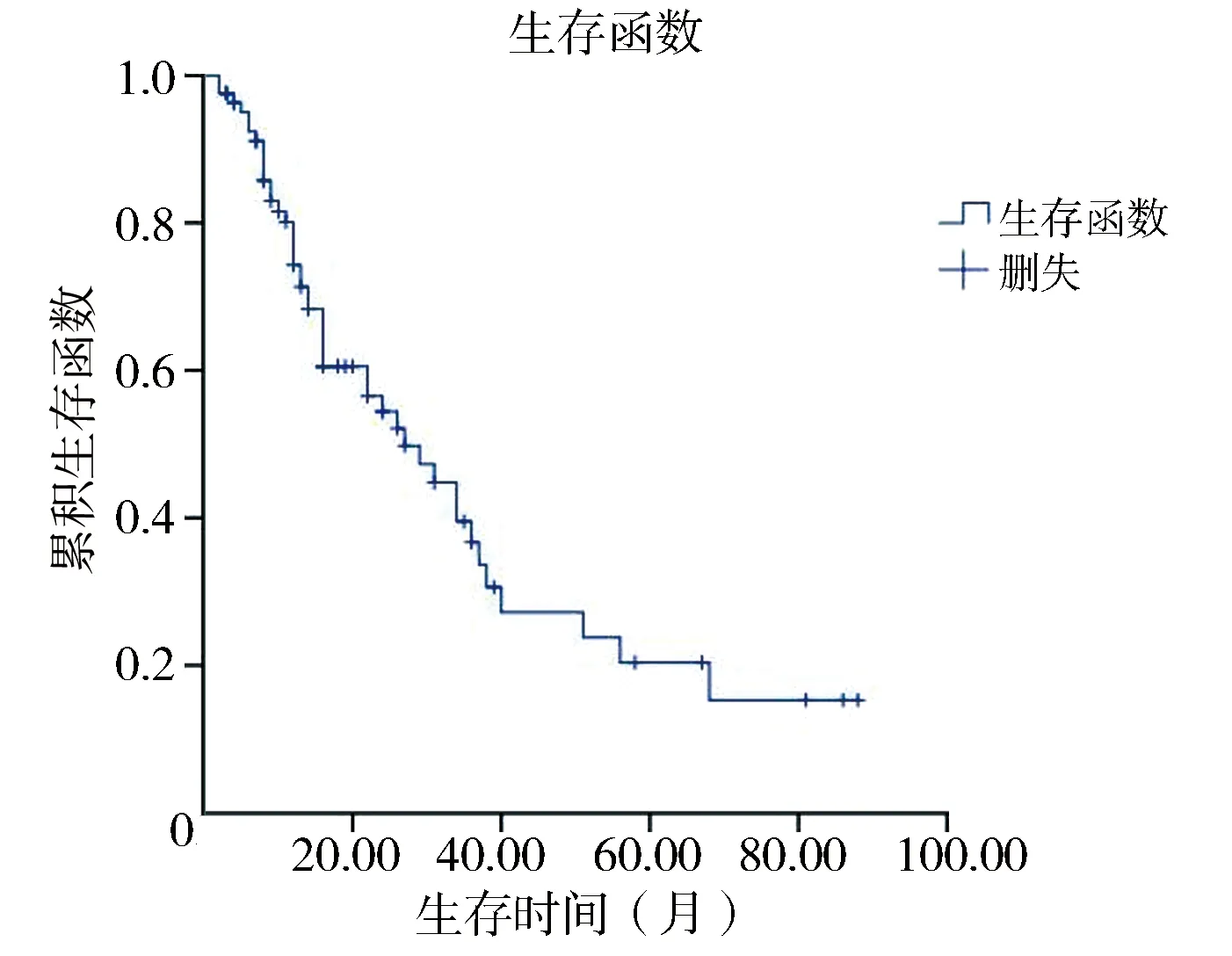
图1 97例伴骨转移神经母细胞瘤患儿生存曲线
五、伴骨转移NB患儿预后相关因素分析
(一)单因素分析
利用Kaplan-Meier生存分析法对患儿性别、年龄、肿瘤生长特点、有无骨髓转移、是否多类骨转移、实验室检查指标、Shimada分型、NMYC基因是否扩增、手术切除范围等进行单因素生存分析,结果显示,女性、肿瘤非纵隔来源、存在多类骨转移、首诊时LDH测定值大于660 U/L以及术中肿瘤残留是伴骨转移神经母细胞瘤患儿预后不良的危险因素(P<0.05)。详见表1。
(二)多因素分析
将对预后有显著影响的5个单因素进行Cox回归分析后发现,术中肿瘤切除范围是伴骨转移NB患儿预后的独立影响因素。详见表2。
讨 论
一、NB患儿临床特征及其与预后的关系
NB是儿童常见的颅外恶性实体肿瘤之一,发病率为0.3/10万~1.5/10万[3-4];NB起源于肾上腺髓质及交感神经节的原始神经嵴细胞,其原发瘤灶最常见于腹部,源于肾上腺或腹膜后交感神经节,其次为纵隔、盆腔及颈部交感神经节。本研究中有72例(74.2%)患儿原发瘤灶位于腹膜后或肾上腺区域,其次为纵隔(20.6%),提示腹膜后肿瘤更易发生骨转移,且肿瘤来源于腹膜后的患儿预后较肿瘤来源于纵隔者差(P=0.043)。NB最常见的转移部位为骨髓及骨骼,本研究收集的403例NB患儿中发生骨转移113例(27.5%),转移率较高,男性更易发生骨转移,但发生骨转移的男性患儿预后较女性好(P=0.005)。
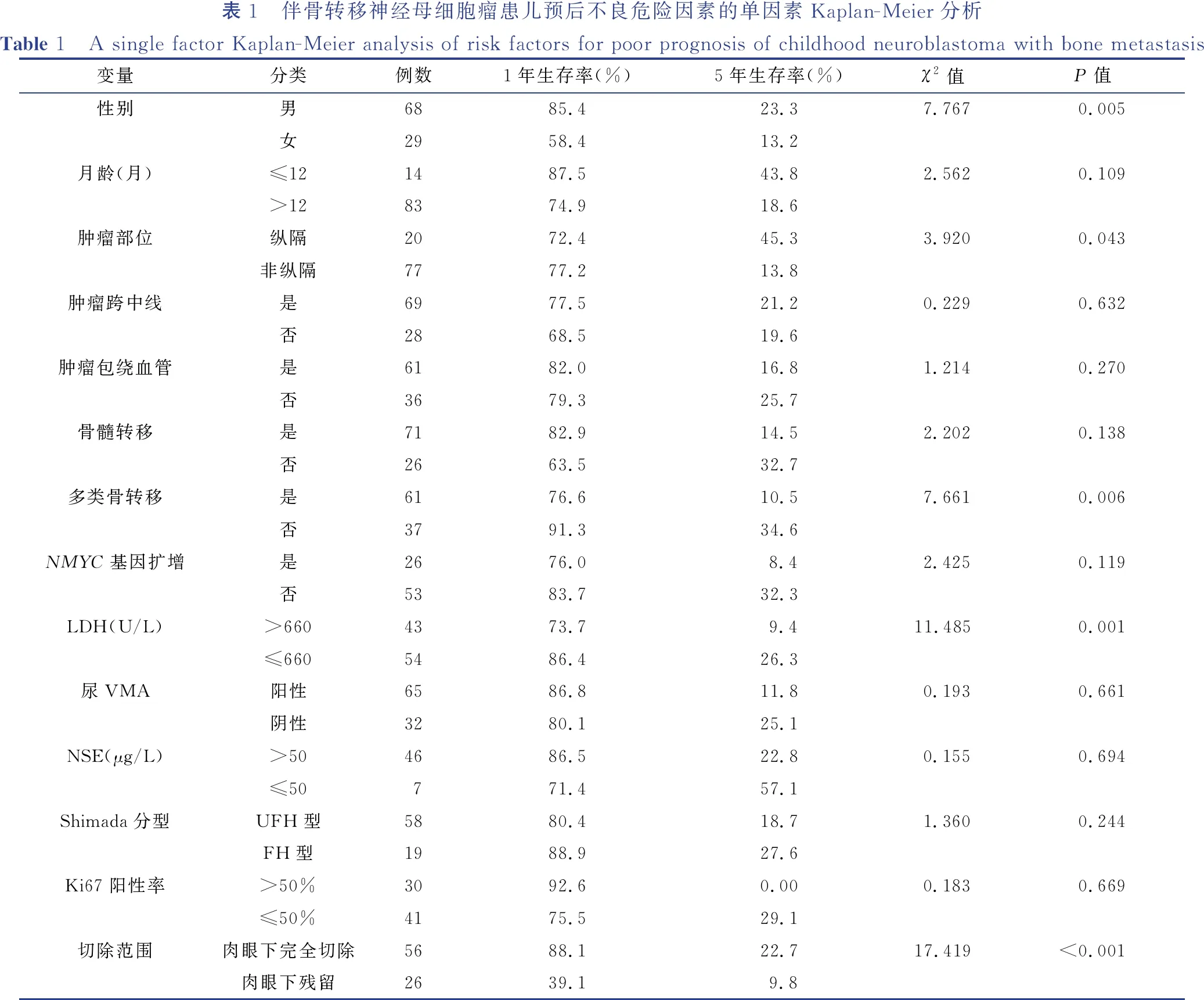
表1 伴骨转移神经母细胞瘤患儿预后不良危险因素的单因素Kaplan-Meier分析Table 1 A single factor Kaplan-Meier analysis of risk factors for poor prognosis of childhood neuroblastoma with bone metastasis变量分类例数1年生存率(%)5年生存率(%)χ2值P值性别男6885.423.37.767 0.005女2958.413.2月龄(月)≤121487.543.82.562 0.109>128374.918.6肿瘤部位纵隔2072.445.33.920 0.043非纵隔7777.213.8肿瘤跨中线是6977.521.20.229 0.632否2868.519.6肿瘤包绕血管是6182.016.81.214 0.270否3679.325.7骨髓转移是7182.914.52.202 0.138否2663.532.7多类骨转移是6176.610.57.661 0.006否3791.334.6NMYC基因扩增是2676.08.42.425 0.119否5383.732.3LDH(U/L)>6604373.79.411.485 0.001≤6605486.426.3尿VMA阳性6586.811.80.193 0.661阴性3280.125.1NSE(μg/L)>504686.522.80.155 0.694≤50771.457.1Shimada分型UFH型5880.418.71.360 0.244FH型1988.927.6Ki67阳性率>50%3092.60.000.183 0.669≤50%4175.529.1切除范围肉眼下完全切除5688.122.717.419<0.001肉眼下残留2639.19.8

表2 伴骨转移NB患儿预后不良危险因素的Cox回归分析Table 2 Intraoperative tumor residual is a risk factor for poor prognosis of childhood neuroblastoma with bone metastasis:a multivariate Cox s regression analysis变量B值SE值Wald χ2值自由度P值Exp(B)值Exp(B)值 95%CI下限上限切除范围-1.2370.32514.4681<0.0010.2900.1530.549性别-0.1140.3840.0891 0.7660.8920.4201.893肿瘤部位 0.4640.4840.9201 0.3371.5900.6164.104多类骨转移 0.5520.3852.0501 0.1521.7360.8163.693LDH值-0.6700.3932.9001 0.0890.5120.2371.106 注 切除范围(完全切除=1,不完全切除=0),性别(男=1,女=0),肿瘤部位(非纵隔=1,纵隔=0),多类骨转移(是=1,否=0),LDH值(>660 U/L=1,≤660 U/L=0)
NB起病隐匿,临床表现与肿瘤原发部位、转移情况以及瘤体大小有关,部分患儿以重症肌无力、顽固性水样便、共济失调等副肿瘤综合征为首发表现,但伴副肿瘤综合征的NB患儿预后较单纯NB患儿好[5]。因NB缺乏特异性临床表现,早期误诊率较高,因此当患儿出现不明原因发热、骨痛、腹痛、腹胀时,应提高警惕,同时接诊医生应对可疑病例及时进行超声筛查,以降低误诊率[6-7]。NB肿瘤细胞增殖活跃、生长快,本组病例中,首诊时影像学检查提示肿瘤最大直径≥10 cm者有37例(38.2%),且肿瘤侵袭性高,易跨中线(71.1%)和包绕重要血管(62.9%)生长。文献报道多数NB患儿就诊时年龄超过1岁,且已伴有远处转移[8]。在本研究中,就诊时年龄超过1岁的患儿83例,占比达85.6%,可见年龄超过1岁的患儿更易发生骨转移。骨骼是NB常见转移部位之一,常表现为全身多处骨转移,目前观点认为NB通过血行转移至骨或骨髓,并通过激活破骨细胞引发一系列溶骨性病变[9-11]。本研究结果与上述文献报道相似,存在多类骨转移患儿预后较差(P=0.006)。
二、实验室检查结果及其与预后的关系
NB常用的肿瘤标志物为尿VMA/高香草酸(homovanillic acid,HVA)、NSE、LDH、血清铁蛋白(serum ferritin,SF)等,这些指标通常用来指导NB的诊断与鉴别。尿VMA是NB 较特异的肿瘤标志物之一,可间接体现瘤体大小及代谢活跃程度,而存在远处转移的晚期患儿尿VMA阳性率更高[12],本研究中尿VMA阳性患儿65例(67.0%)。NSE由神经母细胞合成,是神经元和神经内分泌细胞所特有的一种酸性蛋白酶,可反应肿瘤负荷;NSE特异性较差,在正常人群或者良性疾病患儿中也可升高,但升高幅度较小;此外在小细胞肺癌、视网膜母细胞瘤等恶性肿瘤中NSE也有升高。本研究中,NSE大于50 μg/L者46例(86.8%),提示伴骨转移的NB患儿NSE异常率高。LDH为参与糖酵解的重要酶之一,也是反映全身肿瘤负荷的一项重要指标,LDH值越高,患儿预后越差[13]。
MYC基因的主要功能是促进细胞增殖、抑制细胞分化和凋亡[14]。NMYC基因扩增与NB的发生关系密切,且NMYC扩增为NB患儿预后不良的独立危险因素,因此寻找抑制NMYC基因表达的方法有望为NB的治疗提供新思路[15-16]。Ki67是一种与细胞增殖密切相关的抗原,Ki67阳性率越高,肿瘤增殖活跃能力越强,更易发生远处转移。本研究中有79例行NMYC基因检测,其中NMYC基因扩增者26例(32.9%);71例行Ki67检测,其中30例Ki67阳性率超过50%(42.3%)。行生存分析后发现,NMYC基因扩增、Ki67阳性率超过50%对伴骨转移神经母细胞瘤患儿的预后无影响(P>0.05)。
三、手术切除范围对预后的影响
目前NB的治疗采用手术联合放化疗为主的综合治疗模式,但在手术切除范围对患儿预后的影响这一问题上,有学者认为,手术切除原发灶对改善NB患儿预后有积极意义[17],亦有研究报道,肿瘤完全切除或部分切除并不会影响患儿生存率[18]。除了手术治疗,NB的预后还受到诸多因素的影响,临床上需要采取手术配合化疗、放疗、免疫治疗、骨髓移植等多种治疗方式,这可能也是对手术切除范围存在争议的原因。本研究97例中共82例行手术治疗,其中肉眼下完全切除肿瘤56例,肉眼下可见肿瘤残留26例。行生存分析后发现,肿瘤完全切除的患儿5年生存率为22.7%,而肿瘤未完全切除的患儿5年生存率仅9.8%,提示手术切除范围对预后有影响(P<0.05)。多因素生存分析发现,术中肿瘤残留是独立的预后影响因素。因此,对于存在骨转移的NB患儿,我们仍建议术中尽可能完全切除肿瘤,以提高其生存率。
四、总结
既往有研究指出NB伴骨转移多见于18月龄以上儿童,以发热、骨痛和贫血为常见表现,原发瘤灶多位于腹膜后及肾上腺区,且易伴骨髓转移,而伴骨转移的NB患儿5年总生存率为41.3%[19]。本研究显示,1岁以上、男性可能与骨转移的发生有关,伴骨转移者常存在多类骨转移且合并骨髓转移,肿瘤多见于腹部,且易跨中线和包绕重要血管生长,与上述文献报道基本相符。
目前高危NB患儿的治疗方案不断完善,形成了包含手术、化疗、放疗和免疫治疗等的多学科联合治疗模式[20],但国内关于高危NB的治疗方式仍有所欠缺。此外,对于合并骨转移的NB患儿,目前尚无针对骨转移病灶的治疗,未来仍需进一步明确NB骨转移的机制,并探索针对骨转移灶的新治疗手段,以改善患儿预后,提高总体生存率。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明文献检索为马越,论文调查设计为马越、王珊,数据收集与分析为王珊、马越、李长春、杨超、赵珍珍、杜小瑜、邓晓斌、孔祥如、吕麟亚、章均、彭亮、杜逸飞、周建武、孙建,论文结果撰写为马越、王珊,论文讨论分析为马越、王珊
