柳叶蜡梅真菌病害分离鉴定及生物学特性
2022-03-05魏日凤彭成彬陈美霞张政雄阮俊峰
魏日凤,彭成彬,2,陈美霞,张政雄,阮俊峰,刘 伟,
(1福建农林大学园艺学院,福建 福州 350002;2宁德师范学院生命科学学院,福建 宁德 352100;3福建省科技厅产学研合作示范基地,福建 宁德 352100)
0 引言
柳叶蜡梅(Chimonanthus salicifoliusS.Y.Hu)是中国特有的树种,属于樟目蜡梅科蜡梅属的木兰类植物,多年生半常绿灌木,在森林群落生态系统中属于优势灌木树种[1],生长于福建省寿宁县、安徽省黄山市、江西省修水县、浙江省丽水市等地的山区[2]。柳叶蜡梅作为传统畲药制剂的应用比较广泛,具有抗氧化、消炎、增强免疫调节等药理作用[3-4],其需求量在急剧增长,野生的柳叶腊梅资源被不断的开发利用,人工引种仿野生式的种植模式大面积推广。种植环境的改变,导致次要病害在规模化栽培发展后成为主要病害,威胁着柳叶腊梅种植业,制约产业发展的重要因素。只有明确柳叶腊梅叶斑病的病原菌生物学特性,才能针对性措施去防控病害。
国内学者对柳叶蜡梅的植物学特性和药理作用等有系列研究和报道[1-3],但对柳叶腊梅病害的深入系统研究较少,相关可以参考柳叶腊梅病害资料不多,刘静鹤[5]观察发现腊梅叶斑病,其发生规律在高温多雨季节,病斑呈褐色,致使叶片枯萎脱落。文献资料没有明确提出由哪种致病菌株引起该病害。弯孢霉是重要的植物病原真菌,在19世纪30年代被报道侵染水稻[6-7],在后续发现其能侵染画眉草[8]、高粱[8]、甘蔗[8]、香蕉[9]、番木瓜[10]、玉米[12]等植物,并引起叶斑等症状,对侵染植物病原菌分离鉴定。要精准鉴定菌株,还需分析菌株基因型和表现型,以达到鉴定快速、结果准确。利用核糖体DNA非转录区(18sRNA、28sRNA、5.8sRNA)的基因序列开发ITS(Internal Transcribed Spacer,ITS)标记[13-14]和β-微管蛋白由β-tubulin 基因所编码基因序列开发成β-tubulin 标记[15],二者的序列相识度较高且生物进化具有高度保守基因片段,这2 种标记已被诸多研究者进行菌类鉴定的报道[16-17]。
由于侵染植物的病原菌种类繁多,本研究在结合传统鉴定方法和分子方法ITS 序列和β-tub 序列对柳叶腊梅的病原菌进行分离鉴定的同时,并对其生物学特性进行了初步研究。本试验对引起柳叶腊梅叶斑病病原菌分离,明确其病原菌种类,探究其生物学特性,旨在为科学有效防治柳叶腊梅叶斑病、抗性种质资源筛选和抗病品种选育提供理论参考。
1 材料与方法
1.1 供试材料
本研究所用致病菌来源分离自柳叶蜡梅叶部病斑,于2018年7月采集自宁德寿宁县福瑞泰生物技术有限责任公司的种植基地。经室内无菌条件下分离纯化得到供试菌株1018-2。试验在宁德师范学院生命科学院分子研究实验室411,于2018 年7 月—2020 年12月份进行病原菌分离纯化后续实验。
1.2 试剂
供试3 种培养基,包括PDA 琼脂培养基,PD 液体培养基和查氏琼脂培养基(Czapek Agar)。上述培养基参照植病研究方法配置[18],置于115℃高压灭菌20 min后备用。
1.3 方法
1.3.1 柳叶腊梅病斑致病菌分离纯化 参照植病研究方法[18],采用常规组织分离法进行柳叶腊梅叶斑病病原菌的分离纯化,分离纯化5代后,即得到病原菌菌株。
1.3.2 致病性鉴定 将分离自柳叶腊梅病原菌株分别接种至PDA平板上,置于培养5天后,用无菌的5 mm的打孔器分别打取菌饼和空白琼脂平板分别接入进行离体柳叶腊梅叶片回接侵染。26℃保湿培养,逐日观察叶片的发病情况,若发病,则对柳叶腊梅叶片发病部位再重新组织分离,得到与原始接种菌株真菌形态一致的菌株,则可确定为该病的病原菌。
1.3.3 致病菌鉴定
(1)形态学鉴定
接种纯化的1018-2菌株至PDA培养基中央,28℃黑暗条件下培养,定期观察记录菌落培养特征,通过显微镜观察分生孢子形态特征并拍照保存。根据菌落形态特征和分生孢子特征,查阅真菌鉴定手册等相关资料确定病原菌种类[19]。
(2)分子鉴定
1018-2 病原菌基因组DNA 按照试剂盒提取的方法进行(天根生化科技有限公司,北京),分别扩增rDNA-ITS 序列和微管蛋白延伸因子(β-Tub)片段。2对引物序列分别为ITS1(5'- TCCGTAGGTGAA CCTGCGC-3')/ITS4(5'-TCCTCCGCTTATTGATATGC-3')和β-TubF(5'-GACCCTTGGCCCAGTTGTTTCCAG-3')/β- TubR(5'- CAGAAAGCAGCACCGTTTTTGGTT-3'),引物合成委托福州铂尚生物技术有限公司完成。PCR 反应体系扩增程序见表1,分别取5 μL 上述PCR扩增产物于1%琼脂糖凝胶电泳检测(120 V 15 min),分析ITS 和Tub 的PCR 产物片段大小,PCR 扩增产物送到福州铂尚生物技术有限公司委托进行测序。所测序列结果提交到NCBI 的GenBank 进行BLAST 搜索比对,采用软件MEGA 5.0 的Neighbour-Joining 法(简称:NJ)分别构建ITS和Tub序列的系统发育树分析。
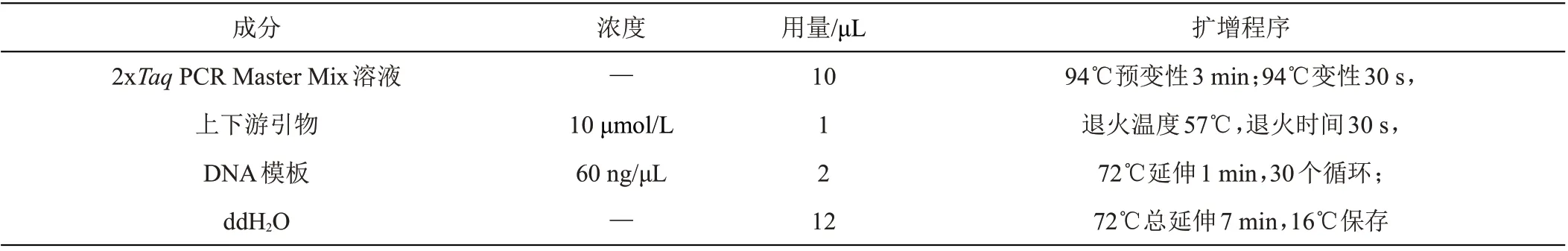
表1 ITS和β-Tub PCR扩增反应程序
1.3.4 不同条件下菌丝生长影响
(1)温度对菌丝生长的影响
用无菌5 mm 直径打孔器打取培养5 天的1018-2菌落边缘菌饼备用,分别将菌饼接种置于PDA培养基中央(皿的直径为9 cm,下同),分别置于5~40℃条件下(每5℃为一个梯度,共8 个不同温度条件)恒温培养,7 天后用十字交叉法分别测定1018-2 病原菌的菌落直径。每处理重复3次。
(2)pH对菌丝生长的影响
用0.1 mol/L HCl和0.1 mol/L NaOH调配pH 3~12的PDA 培养基。菌饼获取及接种方法同1.3.4(1),置于28℃恒温培养,7 天后用十字交叉法测定分别测定1018-2病原菌的菌落直径。每处理重复3次。
(3)光照对菌丝生长的影响
菌饼获取及接种方法同1.3.4(1),分别置于连续光照、12 h 明暗交替、完全黑暗3 种光照条件下,28℃恒温培养,7 天后用十字交叉法测定1018-2 病原菌的菌落直径,每处理3次重复。
(4)不同碳源对菌丝生长的影响
以查式培养基为基础培养基,将其中的蔗糖以葡萄糖、果糖、甘露醇、木糖、蔗糖、乳糖、麦芽糖、可溶性淀粉、山梨醇、肌醇、木糖醇等量替换,即成含糖量相同而碳源不同的培养基,灭菌后接入5 mm菌饼,菌饼获取及接种方法同1.3.4(1),置于28℃恒温培养,7 天后用十字交叉法测定1018-2病原菌的菌落直径,每处理3次重复。
(5)不同氮源对菌丝生长的影响
以查式培养基为基础培养基,将其中的硝酸钠以硝酸钾、酵母粉、蛋白胨、硝酸钠、尿素、氯化氨、甘氨酸和硫酸铵等量替换,即成含氮量相同而氮源不同的培养基,菌饼获取及接种方法同1.3.4(1),置于28℃恒温培养,7 天后用十字交叉法测定1018-2 病原菌的菌落直径,每处理3次重复。
(6)菌丝体的致死温度测定
将5 mm 菌饼置于无菌试管中,加入2 mL 灭菌ddH2O。分别在40℃、45℃、50℃、55℃、60℃水浴锅中处理10 min 后,将试管内菌丝块置于PDA 培养基中央,置于28℃下培养,5天后观察其生长情况。每处理重复3次。
(7)数据统计与分析
数据统计与分析采用SPSS 17.0 软件对菌落直径数据进行统计分析处理,并利用Duncan氏新复极差法进行多重比较。
2 结果与分析
2.1 柳叶腊梅田间病斑和致病性测定
田间柳叶腊梅的叶片发病症状:表现为褐色病斑,略凹陷。多呈椭圆形,病斑部位略薄,病健界限明显,边缘有黄色圆圈,发病后期叶片脱落,田间采集病叶见图1。采用常规组织法分离得到1株致病分离物,编号为1018-2,分别取5 mm 纯化后的菌饼接种离体柳叶腊梅叶片,4 天开始发病,形成褐化病健界限明显,结果见图1。重新分离纯化可得到相同的病原菌,完成科赫法则,进行后续试验。
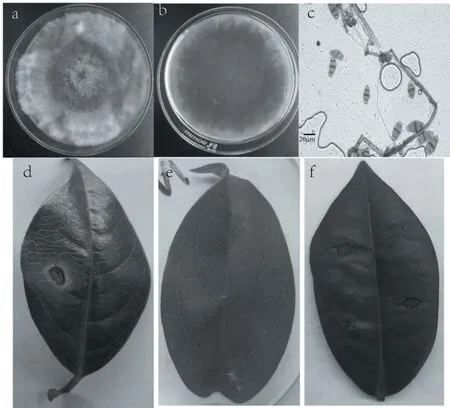
图1 菌落形态和致病性鉴定
2.2 形态特征观察
1018-2分离物在PDA培养基上培养7天正面菌落灰色、褐色至黑色;中部扁平,气生菌丝不致密,棉絮状、绒毛状;边缘不整齐。背面黑褐色。倒卵形、接近宽纺锤状形,大多4胞,具有3个硬质隔膜,中间隔膜呈黄褐色的条带,两边细胞膨大可见两个黄褐色晶体,23~29(24)×12~17(15)μm,通过形态学观察,比对相关文献形态学描述结果相吻合[6-19],初步判断为弯孢霉。
2.3 PCR克隆及测序分析序列分析
分别提取病原菌株的基因组DNA 进行特异性引物ITS和β-tub扩增1%琼脂糖凝胶电泳检测(120 V电压下15~20 min),结果如图2 可知扩增的ITS 和β-tub条带单一、清晰明亮、分子量分别在500~750 bp 和250~500 bp 与预期大小一致,由于另外一对引物扩增与预期结果不一致,不再做分析。测序分析结果经NCBI 比对,1018-2 菌株的ITS 序列与登录号GU073102 为C.intermedia相似度达100%,β-tub 序列与登录号KT021244.1 为C.hawaiiensis相似度达97.24%,下载同种属序列,分别构建NJ 进化树分别为图3和图4,结合形态学文献资料判定1018-2为间型弯胞霉C.intermedia[12]。

图2 PCR结果图

图3 基于ITS序列分析构建NJ-系统树
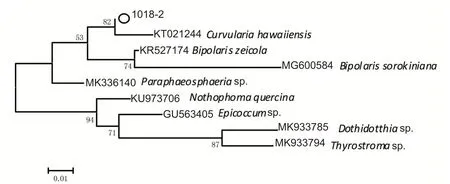
图4 基于β-Tub序列分析构建NJ-系统树
2.4 不同条件下菌丝生长影响
2.4.1 温度对菌丝生长的影响 培养7天后测量菌落直径,由图6可知,病原菌在10~35℃均可生长,当温度在5℃菌丝体生长受到抑制,无法正常生长;在10~30℃下,随着温度升高,病原菌菌落直径增大;其中30℃时,1018-2 菌落直径最大,为8 cm,显著高于其他温度下的菌落直径;30℃后下随着温度升高,病原菌菌落直径减小,菌丝体生长受到抑制;且当温度达到40℃时,病原菌生长完全受到抑制。
2.4.2 pH 对菌丝生长的影响 培养7 天后测量菌落直径,由图6可知,1018-2病原菌在pH 3~11下均可生长,适宜生长范围是pH 7~9 时,菌丝生长较好,且当pH 8时,菌丝直径达到最大值8 cm。病原菌在弱酸到中性到弱碱环境下有利菌丝生长,酸性或碱性过强都会抑制病菌的生长。
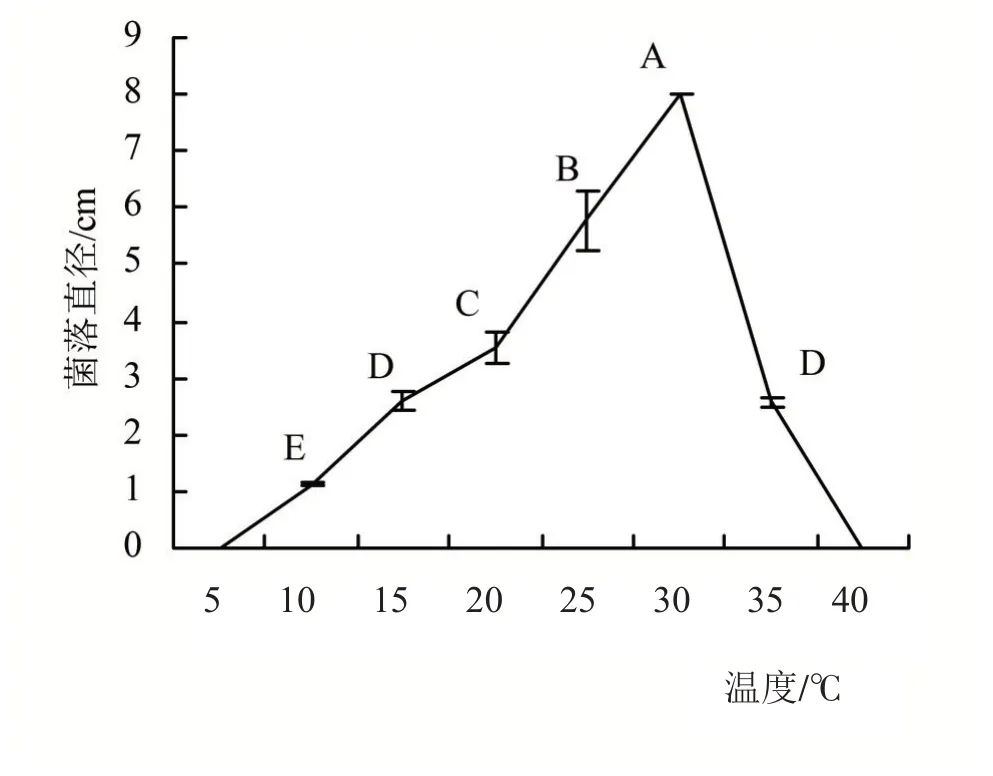
图5 不同温度处理病原菌的菌落直径
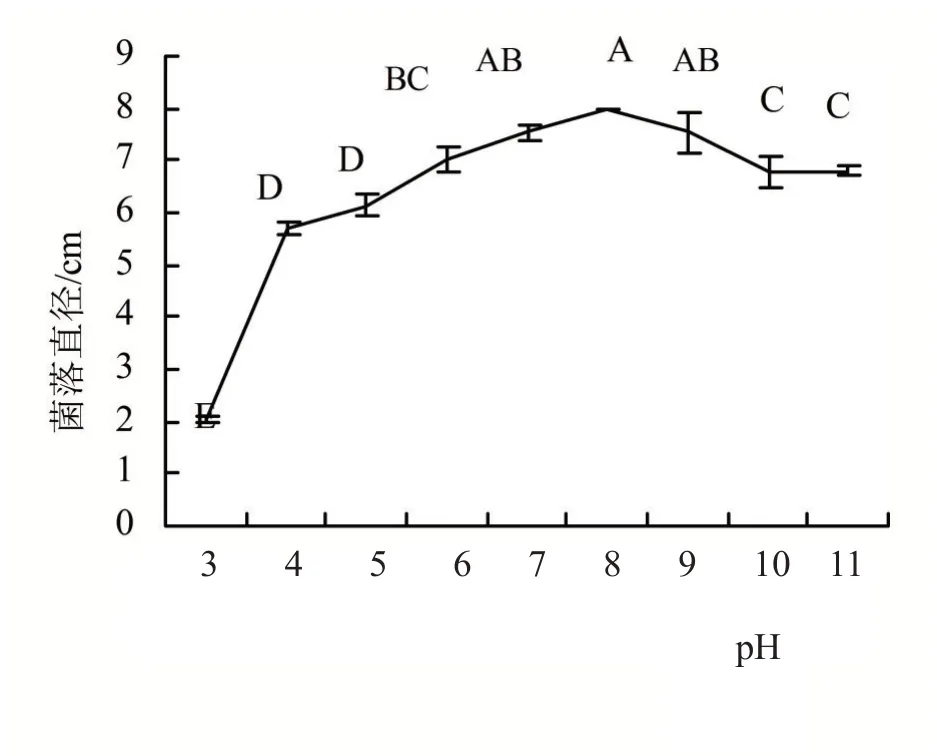
图6 不同pH处理病原菌的菌落直径
2.4.3 光照对菌丝生长的影响 病原菌在连续光照、12 h光照12 h黑暗交替、完全黑暗,这3种光照条件下均可生长,培养7天后测量菌落直径均为8 cm,三者菌丝直径差别不显著。光照处理对菌丝生长影响不大。
2.4.4 不同碳源对菌丝生长的影响 在碳源测定中,培养7 天的结果从图7 可知,病原菌在不同碳源上均生长,在供试的11种碳源中,该菌在以葡萄糖、蔗糖和麦芽糖为碳源的培养基中生长最快其菌落直径最大,为8 cm,极显著高于其余碳源,病原菌以葡萄糖、蔗糖和麦芽糖为最佳碳源。在以可溶性淀粉为碳源的培养基,其菌落直径最小,为4 cm,菌丝生长较慢。
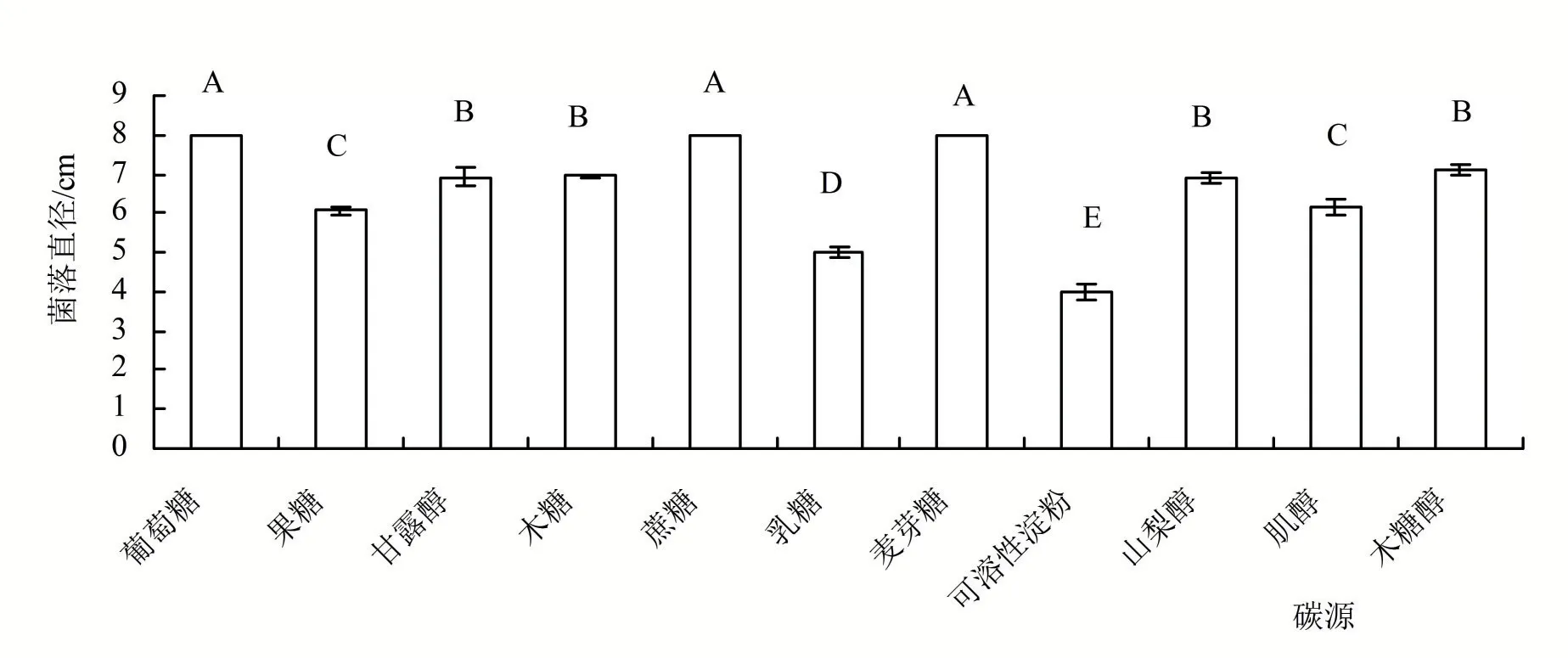
图7 不同碳源处理病原菌的菌落直径
2.4.5 不同氮源对菌丝生长的影响 在氮源测定中,培养7天的结果从图8可知,氮源对病原菌生长(菌落直径)的影响不显著,在供试的8 种氮源中,其中,硝酸钾、酵母粉和硝酸钠的菌落直径均为8 cm,以硫酸氨为氮源的培养基其菌丝生长慢,菌落直径为3.42 cm,对硫酸氨利用率低,尿素作为氮源不适合1018-2病原菌生长。

图8 不同氮源处理病原菌的菌落直径
2.4.6 菌丝体的致死温度测定5 mm 菌块在40~50℃的水浴温度处理后,病原菌1018-2仍然能在PDA培养基上生长,55~60℃,病原菌1018-2在PDA培养基上不再生长,在51~54℃进一步探究,5 mm 菌饼在52℃的水浴温度处理后能在PDA培养基不生长,表明病原菌1018-2致死温度为52℃。
3 讨论
近年来,国内外对柳叶腊梅病害防控的研究报道不多,最早由刘静鹤[5]观察发现腊梅叶斑病,致使叶片枯萎脱落,但文献资料中没有明确提出由哪种致病菌株引起该病害。寿宁地处闽东,多为山地,经过公司近几年的研究已建立一套适合柳叶蜡梅繁殖、生长的体系,与茶叶拼配的黄金茶在市场上也颇受青睐,为当地农民经济增收、乡村振兴做出了贡献。随着栽培面积的扩大,发现有叶斑病病害,影响了品质。因此本研究拟明确病害的主要病原菌及生长特性,为准确防治奠定基础。
通过形态学观察结合分子生物学鉴定,首次分离到间型弯孢霉C.intermedia是引起柳叶腊梅叶斑病的病原菌之一。弯孢霉属真菌是自然界当中重要的真菌类群,可对植物致病,亦可在腐质土壤中腐生生活[20]。在19世纪30年代被报道侵染水稻[5-6],后续发现其能侵染画眉草[8]、高粱[8]、甘蔗[8]、香蕉[9]、番木瓜[10]、玉米[12]等多种植物,弯孢霉属真菌主要寄主为禾本科植物,但在木本科植物柳叶腊梅尚属首次发现,究其原因,随着人工的仿野生种植环境发生改变,原本田间其他寄主病害开始迅速蔓延传播至柳叶腊梅叶片,有研究者发现C.intermedia的寄主之一是禾本科的牛筋草(Eleusine indica(L.)Gaertn.)[21],为世界十大恶性杂草之一[22],在田间路边随处可见,多生长于田间地头及道路旁,而且柳叶腊梅苗木开展规模化种植,生态群落层次上留给农田杂草生长空间[23-24],虽然对柳叶腊梅叶片光照光合作用不影响,但杂草争夺种植苗木的土壤养分和水分,同时伴随着传播病害的威胁,杂草充当传播真菌病害的中间寄主,导致柳叶腊梅真菌病害发生,直接或间接影响着柳叶腊梅叶片产量和品质。建议企业对于柳叶腊梅种植管理方面必须注意田间杂草清理,可从根源上防治病害传播[25]。
本研究对于分离的病原菌1018-2 的β-tub 测序结果,在NCBI 数据库里比对得到的结果是登录号KT021244.1 为C.hawaiiensis相似度达97.24%,结果与ITS序列比对的C.intermedia不一致,推测由于用βtub 引物对于间型弯孢霉这一真菌分类的研究者较少。推测仅借助单一引物序列进行鉴定,存在片段太小不足以反映菌株差异,导致准确性较低。接下来扩增ACT、CAL、LSU、CHS 等引物,通过多标记联合分析解析该菌的特征。
本研究对C.intermedia生物学特性进行探究中,在氮源上受限制于玻璃培养皿的大小,在7 天的菌落培养情况硝酸钾、酵母粉和硝酸钠的菌落直径均为8 cm,本研究发现这一结果与徐辉研究的同一属真菌C.lunata的氮源上既有相同之处又有不同之处,推测原因可能是同属不同种之间的生物学特性差异所致[7],后续尝试使用15 cm培养皿对它的氮源上进行探究。柳叶蜡酶作为乡土树种,值得一提的是,柳叶蜡梅病害防治研究方面相对空缺,下一步工作将以此基础上,展开防治该病害的相关工作,通过进行化学和生物方法进行防治该病原菌,以有效防治柳叶腊梅弯孢霉叶斑病的产生,为生产解决实际病害问题。
4 结论
本研究首次报道了寿宁县柳叶腊梅的一种新病害,叶斑病病原菌经形态特征观测和rDNA-ITS 和TUB 序列在NCBI 数据库的分析比对,鉴定为半知菌门、丝孢纲、弯孢属间型弯孢C.intermedia。该病原菌的最适生长条件最适生长温度为30℃,最适pH 8,最适碳源为葡萄糖、蔗糖和麦芽糖,最适氮源为硝酸钾、酵母粉和硝酸钠,光照对该菌株的生长没有影响,菌丝体致死温度为52℃。可为柳叶腊梅叶斑病的综合防治、抗性种质资源筛选和抗病品种选育提供理论参考。
