泮托拉唑钠静脉药物配置中心集中调配后的有效时间研究
2022-03-05杨丕辉杨源燕
杨丕辉 杨源燕

摘要:由于PIVAS实行集中配置、集中输送,注射液不能及时送达临床。随着放置时间增加,注射液物化参数可能发生变化。本课题的研究方向是针对对泮托拉唑钠注射液进行pH值、不溶性微粒数、主要成分含量测定,对调配后的有效时间进行研究分析,其研究目的为推测杂质可能结构,并对配伍禁忌的机制进行调配后有效时间初步探讨。研究结果通过发现对放置不同时间、配置后的注射液的pH值测定,发现液体剂型药物注射液的pH值比固体剂型变化小,即液体剂型注射液更加稳定。泮托拉唑钠药物不溶性微粒数增加显著,通过 LC-MS分析,发现泮托拉唑钠随放置时间增长而降解明显,泮托拉唑钠放置12 h后,主要成分相对百分含量均低于90%,综上,注射液配置完成后,随着放置时间增加,注射液pH值、不溶性微粒数、主成分含量都会发生不同程度的变化,其中泮托拉唑钠药物变化较为明显,不宜久放。
关键词:泮托拉唑钠,静脉药物,PH值,不溶性微粒数,主要成分含量测定,分子结构,调配有效时间
In order to ensure the safety of clinical medication, modern hospitals began to set up intravenous drug dispensing center, that is, under the operating environment in compliance with GMP, professional pharmacy personnel to configure infusion.To study the effective time of Pantoprazole sodium after concentrated preparation in intravenous drug dispensing centerThe Ph change rate of the solid form drug razole injection was more than 10% , presumably because the drug structure of Pantoprazole sodium contained sulfoxide group, which was easily oxidized to sulfone group, which led to the increase of acidity. By measuring the number of insoluble particles in the injection, it was found that the number of insoluble particles with particle size ≥10 m varied significantly as compared with that with particle size ≥25 M.It is found that the interaction of positive and negative ions, PKA and chemical reaction are the three key factors that affect the stability of the compatibility of injection, when the difference of PKA between two or more drugs is more than 3.6, it is easy to precipitate. Some drugs are easy to react with each other.As a new proton pump inhibitor, the application of Pantoprazole sodium has the characteristics of high availability, stable bioavailability and irreversible, and its main effect is reflected in the inhibition of H/K-ATPase.A large number of clinical studies have found that 0.9% sodium chloride injection is the best choice for diluting pantoprazole sodium because 0.9% sodium chloride injection has a neutral chemical property, so there's no chemical reaction during the dissolution.When used in combination with other drugs, this product has the advantages of little drug interaction, less drug competition, less drug interaction in Vivo, no mutagenicity, carcinogenic and teratogenic effects,with high bioavailability.Pivas to carry out intravenous drug centralized allocation, improve the quality and efficiency of drug allocation work, worthy of further promotion.
一、泮托拉唑鈉简介和分析目的意义
泮托拉唑钠是一种临床上常用的抑制胃酸分泌的药物,在胃黏膜上皮细胞表面有一种细胞叫做壁细胞,泮托拉唑钠可以通过与壁细胞表面的受体结合,从而达到抑制胃酸分泌的作用。泮托拉唑钠可以抑制两种情况的胃酸分泌,一种情况是抑制正常状态下胃酸的分泌,另外一种情况是抑制夜间胃酸的分泌。泮托拉唑钠可以抑制白天及夜间胃酸的分泌,因此抑酸能力比较强,通常用来治疗高胃酸分泌的胃溃疡。泮托拉唑钠治疗胃溃疡的治愈率高,不良反应少,是临床上常用的抑酸药物。目前国内的大部分医院都启用了药物配置中心, 大多静脉输注药物通过PIVAS配置后到临床科室使用,静脉药物从PIVAS配置后到临床科室给患者使用需要2~6h,甚至更长时间;而泮托拉唑钠分子结构中具有磺酰基苯并咪唑环,其配置后稳定性较差,其中pH值的影响最大,如果pH值值不在药物的稳定范围内,就有可能发生变色、聚合反应和不溶性微粒的生成等现象。因此,国际医院评审标准(Joint Commission International,JCI)要求静脉药物配置后应标注配置时间和有效时间。
二、泮托拉唑钠集中调配后有效时间的研究分析
(1)准备仪器和药品
实验仪器准备:高效液相色谱检测仪、精密PH测定仪、微粒分析仪。
实验药品准备:4个厂家泮托拉唑钠(湖北荷普药业股份有限公司、扬子江药业集团有限公司、成都百裕制药股份有限公司、杭州中美华东制药有限公司)和科伦0.9%氯化钠注射液100ml、0.9%氯化钠注射液250ml。
(2)研究方法
1.药液性状、PH、不溶性微粒和浓度的测定相关数据以《中国药典》(2015年版)为标准。
2.药液配置:在PIVAS水平层流操作台上,按照无菌操作要求将四个厂家泮托拉唑钠40mg分别与0.9%氯化钠注射液100ml和0.9%氯化钠注射液250ml进行配置试验。
3.试验时间段的设置:PIVAS配置输液并送达临床科室通常情况不超过2h,临床科室护士给患者用药所用时间通常在1~4h内,因此药物配置后稳定性研究时间限应不小于6h,因此设置时间节点为0,1,2,4,6h。配置后考察指标为性状、PH、不溶性微粒和浓度变化。
4.观察配置好的4个厂家泮托拉唑钠药液分别在0h,1h,2h,4h,6h5個时间节点的颜色变化,以药液颜色变化为依据对4个厂家泮托拉唑钠药物配置后的稳定性进行判断。
5.利用精密pH测定仪测定配置好的4个厂家泮托拉唑钠药液分别在0h,1h,2h,4h,6h5个时间节点的pH值。
6.利用微粒分析仪分析配置好的4个厂家泮托拉唑钠药液分别在0h,1h,2h,4h,6h5个时间节点不溶性微粒。
7.利用高效液相色谱检测仪测定配置好的4个厂家泮托拉唑钠药液分别在0h,1h,2h,4h,6h5个时间节点的浓度。
统计学方法:采用SPSS19.0软件进行数据处理,计量资料以(x±S)表示,采用t检验,计数资料用%表示,采用x2检验,以P<0.05为差异具有统计学意义。
测定方法:照高效液相色谱法(中国药典1995年版二部附录V D)测定。 色谱条件与系统适用性试验 用十八烷基硅烷键合硅胶为填充剂,磷酸盐缓冲液(取磷酸氢二钠1.12g,磷酸二氢钠0.18g,加水溶解并稀释至1000ml,摇匀,即得。)—乙腈(70:30)为流动相,检测波长为288nm,理论板数按泮托拉唑钠峰计算,应不低于2500。 测定法 取装量差异项下内容物适量(约相当于泮托拉唑20mg),精密称定,加流动相适量,溶解并稀释制成每1ml约含50μg的供试品溶液;精密量取20μl注入液相色谱仪,记录色谱图,量取峰面积;另取泮托拉唑钠对照品适量同法测定,按外标法以峰面积计算,即得。
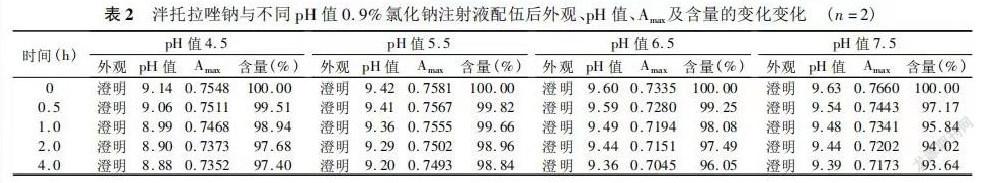
根据泮托拉唑钠在酸性条件下不稳定、碱性环境下较稳定的特点及临床用药情况,分别将其与4个厂家的药业进行配置,测定 pH 值、不溶性微粒和颜色的变化,为临床合理配伍提供依据,光阻法系在可见异物检查符合规定后,用以检查静脉用注射剂中不溶性微粒( 2 ~ 50 μm) 的大小及数量。将泮托拉唑钠专用溶剂 10ml 溶于泮托拉唑钠粉针 40mg 中,再用 pH 值为 4.5 的 0.9% 氯化钠注射液溶解于100ml 干燥容量瓶中定容,摇匀。取上述溶液 0. 5ml 分别置于 10ml 干燥容量瓶中,以 pH 值为 4.5 的 0.9% 氯化钠注射液稀释至刻度( 浓度为 0.02mg /ml) ,按紫外分光光度法于波长190 ~ 400nm 范围内进行扫描,泮托拉唑钠在波长 288.40nm 处有最大吸收,Amax为 0.7555,见图2。配伍稳定性的考察: 将 0.9% 氯化钠注射液适量分别用 0.01mol /L 盐酸( HCl) 和 0.01mol /L 氢氧化钠( NaOH) 调节pH 值分别至4.5、5.5、6.5、7.5。按临床常用剂量,将注射用泮托拉唑钠的40mg 用上述配制好的不同 pH 值 0.9% 氯化钠注 射液溶解,并置于 100ml 干燥容量瓶中定容,摇匀。分别在 0、 0. 5、1.0、2.0、4。0h 后观察其色泽、澄明度,并测定 pH 值。分别吸取配伍液 0. 5ml 置于 10ml 干燥容量瓶中,以不同 pH 值 0.9% 氯化钠注射液稀释至刻度( 浓度为 0. 02mg /ml) ,190 ~ 400nm 波长范围紫外扫描,观察吸收峰位及峰形变化,并以最大紫外吸收值计算含量( 配伍 0 时含量计为 100% ) 。
注射剂中的不溶性微粒进入人体血液后,可引起血管栓塞、过敏反应、热原样反应注射用泮托拉唑钠80 mg,pH 9. 5 ~ 11. 0,0. 9% 氯化钠注射液: 250 mLpH 4. 5 ~ 7. 0;取微粒检查用水 50 mL,光阻法测定要求每 10 mL 中含 10 μm 以上的不溶性微粒应在 10 粒以下,含 25 μm 以上的不溶性微粒应 在 2 粒以下。否则表明微粒检查用水、玻璃仪器或 试验环境不适于进行微粒检查,应重新处理,检测符合规定后方可进行供试品检查。pH 的测定供试品分别按中国药典 2005 年版二部[2]pH 测定法测定 pH。结果见表 1。 不溶性微粒的测定供试品分别按中国药典2005 年版二部不溶性微粒检查法中的光阻法测定不溶性微 粒。光阻法系在可见异物检查符合规定后,用以检查静脉用注射剂中不溶性微粒( 2 ~ 50 μm) 的大小及数量。中国药典 2005 年版二部对静脉用注射剂的不溶性微粒限度有具体规定。标示装量为 100 mL 或 100 mL 以上的静脉用注射液,除另有规定外,每 1 mL 中含 10 μm 以上的微粒不得过 25 粒,含 25 μm 以上的微粒不得过 3 粒; 静脉注射用无菌粉末,除另有规定外,每个供试品容器中含10 μm 以上的微粒不得过 6000 粒,含 25 μm 以上的粒不得过 600 粒。取供试品,用水将容器外壁洗净,小心开启瓶盖,精密加入适量微粒检查用水,小心盖上瓶盖,缓缓振摇使内容物溶解,静置适当时间脱气,小心开启容器,直接将供试品容器置于取样器上,不加搅拌,由仪器直接抽取适量溶液( 以不吸入气泡为限) ,测定并记录数据; 另取至少 2 个供试品,同法测定。第一个供试品的数据不计,取后续测定结果的平均值计算。取输液,用水将容器外壁洗净,小心翻转 20 次,使溶液混合均匀,立即小心开启容器,直接将输液瓶置于取样器上,不加搅拌,由仪器直接抽取适量溶液( 以不吸入气泡为限) ,依法测定 3 次,每次取样应不少于 5 mL,记录数据; 另取至少 2 个供试品,同法测定。每个供试品第一次数据不计,取后续测定结果的平均值计算;取注射用泮托拉唑钠,用水将容器外壁洗净,小心开启瓶盖,精密加入适量已经用水将容器外壁洗净的输液,小心盖上瓶盖,缓缓振摇使内容物溶解完全,静置适当时间脱气,小心开启容器,直接将供试品容器置于取样器上,不加搅拌,由仪器直接抽取适 量溶液( 以不吸入气泡为限) ,依法测定,记录数据, 测定结果的平均值计算。分别于 0,0. 5,1,1. 5,2, 2. 5,3,3. 5,4,4. 5,5 h 后测定 pH、不溶性微粒和颜色
三、研究结果
泮托拉唑钠配伍液 泮托拉唑钠与不同 pH 值 0. 9% 氯 化钠注射液配伍后,配伍液在 4h 内均为无色澄明液体,无颜色 变化,无气泡及沉淀生成,紫外吸收图谱、pH 值和含量均无明显变化。外观、pH 及含量变化。见表 2。实验表明注射用泮托拉唑钠与 pH 值 为 4.5、5.5、6.5、7.5 的 0.9% 氯化钠注射液配伍,配伍液在4. 0h 内稳定。≥10 μm 的不溶性微粒均有显著增加( P < 0. 05) ,pH 有明显下降,超过了 pH 范围,注射用泮托拉唑钠最好用 0. 9% 氯化钠注射液溶解和稀释,且即配即用,质量稳定,不会降低药效或引发不良反应。本实验表明泮托拉唑钠都可与 0。9% 氯化钠注射液配伍使用,至于在临床用药过程中配伍液偶尔出现沉淀的现象,可能与护士在配液时无菌操作不严格、注射器或输液器选用等因素有关,有待进一步研究考察。
四、结论
作为新型质子泵抑制剂,泮托拉唑钠药物的应用具备利用度高、生物利用度稳定以及不可逆等特点,主要作用体现在进行H+/K+-ATP酶的抑制,随着泮托拉唑钠药物应用研究的不断深入,发现该药物应用产生不良反应的报告呈现出逐渐增多的趋势。其特点强而持久、溃疡愈合率高,不良反应少,与药物相互作用少,显著优势明显,是成为治疗与酸有关的消化系统功能紊乱性疾病的特效药物,对质子泵具有更高的选择,远远优于前几代质子泵抑制剂,经研究,其对光、热均不稳定,需要避光、阴凉处保存。高效液相色谱法具有灵敏,结果准确且迅速,考虑到高效液相色谱法既可以准确定量,又可以同时进行有关物质检查,因此在质量标准的制订中,选择高效液相色谱法测定注射泮托拉唑钠中泮托拉唑钠的含量。通过实验,样品含量测定的线形关系、精密度、溶液的稳定性、回收率等等都较好,高效液相色谱法可用于注射用泮托拉唑钠中泮托拉唑钠的含量测定,由于其是弱碱性物质,所以在碱性条件下进行提取可以提高回收率并且还有利于与酸性内源性物质和中性物质进行分离。泮托拉唑钠药物治疗期间患者服用酸性药物,极易导致化学反应,进而对患者治疗稳定性与安全性产生影响。并且药物反应期间泮托拉唑钠药物会产生浑浊和沉淀的现象,所以药物合并应用需要谨慎开展,而针对该药物的具体应用,其使用剂量直接影响到药物治疗效果,0.9%氯化钠注射是稀释泮托拉唑钠药物的最佳选择,因为0.9%氯化钠注射液具备中性化学性质,所以在溶解药物期间不会产生化学反应,加强对泮托拉唑钠药物应用的監控,禁止出现配药不合理、用药不合理现象,提升药物使用的稳定性和安全性,保障患者用药安全,最大限制抑制不良反应的产生。
参考文献:
[1]牛角.泮托拉唑钠的临床不良反应与合理应用分析[J].中国医药指南,2019,17(15):144-145.
[2]蔡燕.泮托拉唑钠应用的不良反应分析及合理[J].世界最新医学信息文摘,2018,18(26):129-130.
[3]韩晓曦,蒋进.泮托拉唑钠的临床不良反应与合理应用分析[J].中国实用医药,2015,10(25):143-144.
[4]付峙. 泮托拉唑钠的临床不良反应与合理应用分析[J]. 大家健康(学术版), 2014(23):150-151.
[5]陆晓蕾, 周美华, 周月红. 300例住院患者注射用泮托拉唑钠应用情况与合理性分析[J]. 中国医院用药评价与分析, 2017(4).
[6]张艳梅;陈晓红;刘媛媛;;泮托拉唑钠的临床应用[J];首都医药;2007年02期
[7]李谢;杜有国;宗在伟;易超;;S-(-)-泮托拉唑钠的合成研究[J];齐鲁药事;2009年12期;
[8]李向东;;对泮托拉唑钠药液变色原因的浅析及其预防措施[J];北方药学;2014年02期
[9]宋伟国;张福建;方浩;;泮托拉唑钠的合成[J];中国医药工业杂志;2008年12期
[10]梁茂本;周天红;葛东明;;泮托拉唑钠在果糖氯化钠注射液中的稳定性[J];中国生化药物杂志;2009年03期
[11]杨继红;何竺;;两种注射用质子泵抑制剂在生理盐水中的配伍稳定性考察[A];2010年中国药学大会暨第十届中国药师周論文集[C];2010年
[12]Richter JE,kahrilas. PJ, JohansonJ, Ma- tonP,Breiter JR, Hwang. C et al,Efficacy and safety of esomeprazol Compared with omepraole in GERD Patients with erosive esophagitis:a randomized controlled triaL. AmJ Gastroenterol 2001,96:656~665
作者简介:杨丕辉 性别:男 民族: 白 出生日期:1991-9-26 籍贯:云南大理
科室:药剂科 职称:执业药师 学历:本科 研究方向:医药学
工作单位:大理大学第一附属医院
501186