[C2 MIM]+ 在碳纳米管中结构和性质的理论研究
2022-03-04何裕琴宋小菊李云志刘国魁夏其英
张 鑫,何裕琴,宋小菊,李云志,刘国魁,夏其英
( 临沂大学 化学化工学院,临沂 276000)
1 引 言
近年来,碳纳米管因优异的光学、力学、热学和电学性能而成为科学界研究的热点[1-3].由于碳纳米管之间存在很强的范德华力和疏水性,其在水和有机溶剂中非常容易团聚,难以分散开来,这严重限制了碳纳米管的实际制备和应用[4].然而,离子液体( ILs) 特别是咪唑类的ILs,可以在不借助化学修饰及表面活性分子的条件下,制备出高分散性的碳纳米管[5].因此,深入研究碳纳米管与咪唑类ILs 之间的相互作用机制,对碳纳米管的可控制备有极为重要的意义.
当前,已经有一些实验研究了咪唑类ILs 与碳纳米管之间的相互作用机制[6-18].研究发现,咪唑阳离子在稳定碳纳米管中起着重要的作用.例如,碳纳米管存在高度离域化的π 电子共轭体系,可以与咪唑阳离子发生π -π 作用[6-8].相反,Li 等通过拉曼和IR 的结果表明,咪唑类的ILs 与碳纳米管的相互作用是通过弱的范德华力作用,而不是π - π 作用[9].另外,Su 等通过XRD 方法发现碳纳米管与咪唑阳离子之间的距离达到4.3 Å,并把咪唑阳离子与碳纳米管之间的相互作用归因于CH-π 作用[10].最近,Wojslawski 等对碳纳米管吸附ILs 的数据进行了详细分析,阐明ILs 在碳纳米管上存在复杂的吸附机制,包括π - π 作用、范德华作用和静电相互作用[11].因此,咪唑基ILs 与CNTs 的相互作用机理至今仍不清楚.深入研究碳纳米管与咪唑类ILs之间的相互作用机制,对碳纳米管的可控制备有重要的指导意义.
本论文选取咪唑类ILs 中具有代表性的咪唑阳离子: 1 - 乙基- 3 - 甲基咪唑离子( [C2MIM]+) ,采用量子力学方法考察其在不同管径中的稳定结构,深入探索其与碳纳米管之间的相互作用和分子轨道性质.这些问题的研究有助于人们从分子水平上理解咪唑类ILs 与碳纳米管之间的相互作用机制.
本论文的组成如下: 第二部分简要介绍本文涉及的计算方法.第三部分将对[C2MIM]+在不同管径的碳纳米管中的结构和性质进行分别讨论.第四部分是本论文得到的结论.
2 理论与计算方法
本论文主要考察[C2MIM]+在不同管径的碳纳米管中的结构和性质,探索[C2MIM]+与碳纳米管之间的相互作用机制.选取的三种管径的碳纳米管分别是: (6,6) 、( 8,8) 和( 10,10).为了平衡论文的计算量,三种管径的碳纳米管分别包含192 个原子,256 个原子和320 个原子,碳管的长度为17.70 Å,直径分别为8.13 Å、10.85 Å 和13.60 Å.首先,采用ONIOM 方法[19]( M06 -2X/6 -31 +G**: M06 -2X/3 -21G) 对建立的初始构型进行结构优化,以获得[C2MIM]+在不同管径的碳纳米管中的最稳定结构.基于得到的稳定结构,使用M06 -2X/3 -21G 方法系统考察[C2MIM]+与不同管径的碳纳米管之间的相互作用和分子轨道信息.在计算[C2MIM]+与不同管径的碳纳米管之间的结合能时,我们考虑了基组重叠误差( BSSE) 校正对计算结果的影响.论文涉及的计算均使用Gaussian 16 软件[20].
3 结果与讨论
3.1 [C2MIM]+在碳纳米管中的稳定结构
基于ONIOM ( M06 -2X/6 -31 +G**: M06-2X/3 -21G) 方法,获得了[C2MIM]+在三种管径碳纳米管中的稳定结构,如图1 所示.我们发现,在管径为( 6,6) 的碳纳米管中, [C2MIM]+处于其中心区域,且[C2MIM]+的咪唑环平面平行于碳纳米管的表面,距离碳纳米管两边的垂直距离分别是3.58 Å 和4.13 Å.随着碳纳米管的管径尺寸的增大,在(8,8) 和(10,10) 碳纳米管中,[C2MIM]+则越来越靠近碳纳米管一侧的管壁.同样,在(8,8) 和(10,10) 的碳纳米管中,[C2MIM]+的咪唑环平面与碳纳米管的表面也相平行,其垂直距离分别为3.26 Å 和3.16 Å,这表明[C2MIM]+与碳纳米管之间存在显著的π-π 相互作用,这一结论与实验得到的结论是一致的.
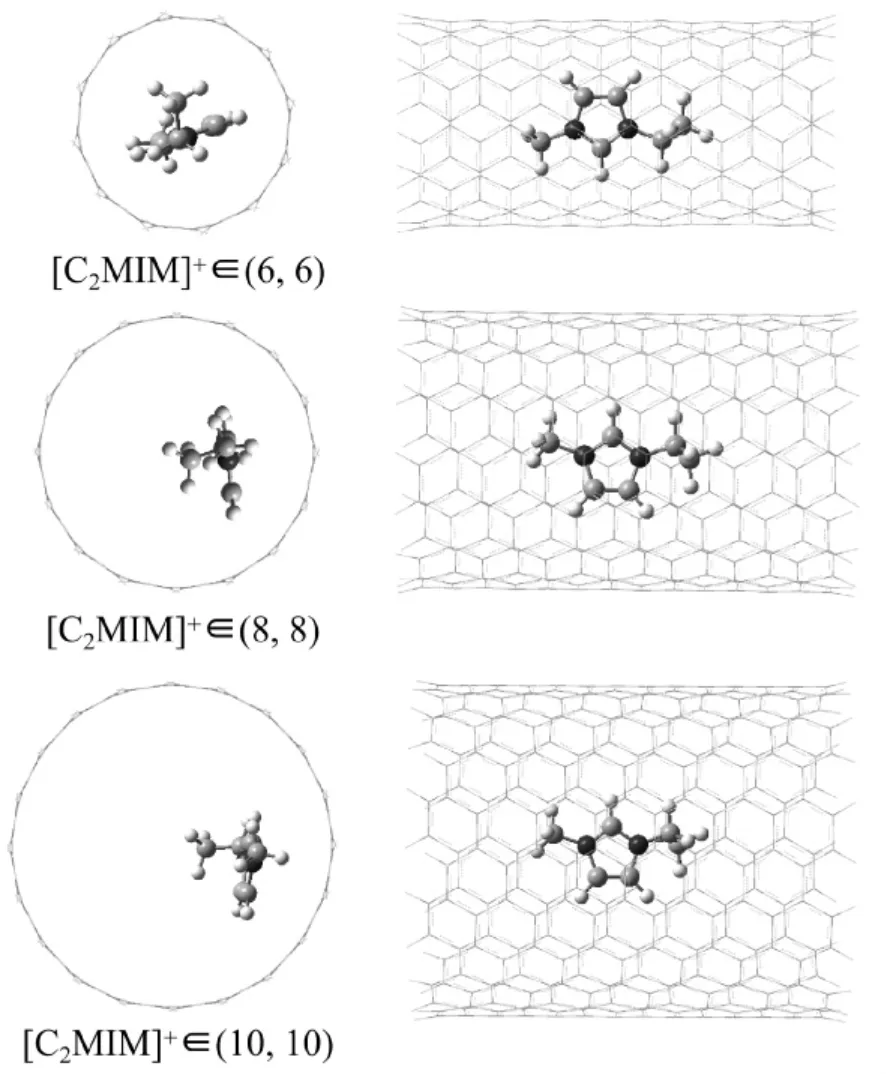
图1 [C2MIM]+在三种管径的碳纳米管中的稳定结构Fig.1 Stablestructures of[C2MIM]+ in three carbon nanotubes with different diameters
3.2 [C2MIM]+与碳纳米管的相互作用
基于得到的稳定结构,采用M06 -2X/3 -21G 方法计算了[C2MIM]+与不同管径的碳纳米管中之间的结合能,如表1 所示.通过表1 可以得到,[C2MIM]+在管径为( 6,6) 、( 8,8) 和(10,10) 的相互作用能分别 -45.5、 -40.8 和-39.5 kcal/mol,且随着碳纳米管的管径尺寸的增大,[C2MIM]+与其相互作用在逐渐减弱,并趋于稳定值.相互作用能的结果符合其在碳纳米管中的结构和分子取向.此外,我们还发现,在使用M06 -2X 方法和较小的3 -21G 基组计算结合能时,BSSE 值的贡献较大,计算时需要扣除.例如,在管径为(6,6) 的碳纳米管中,其值高达24.8 kcal/mol.
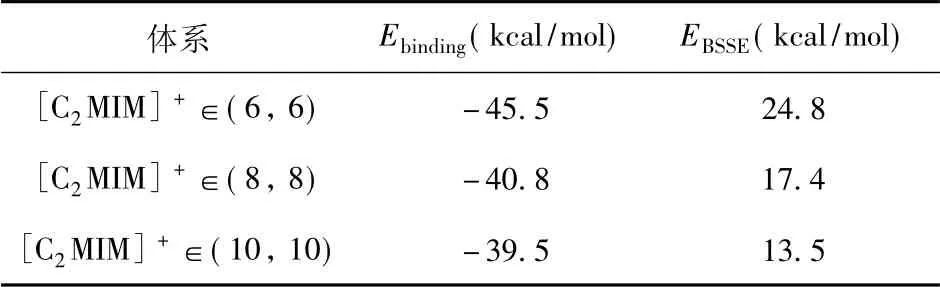
表1 [C2 MIM]+ 与三种管径的碳纳米管的结合能( Ebinding) 和BSSE 能( EBSSE)Table 1 Binding energies ( Ebinding) and BSSE energies( EBSSE) between [C2 MIM]+ and three carbon nanotubes with different diameters
3.3 [C2MIM]+在碳纳米管中分子轨道分布
为了更好地理解[C2MIM]+与碳纳米管之间的相互作用,我们考察了研究体系的最高占据分子轨道( HOMO) 和最低未占据分子轨道( LUMO)分布,结果如图2 所示.我们发现[C2MIM]+不论在什么尺寸的碳纳米管中,体系的HOMO 轨道和LUMO 轨道都是由碳纳米管贡献的,与其中的[C2MIM]+无关,且这种HOMO 到LUMO 的跃迁行为是π→π*.这表明[C2MIM]+与碳纳米管之间的作用方式为弱的范德华相互作用.我们还考察了[C2MIM]+与碳纳米管相互作用时对其前线轨道能量和能隙的影响,如表2 所示.可以发现,[C2MIM]+在管径为( 6,6) 、( 8,8) 和( 10,10) 中的HOMO 能量分别为-7.3、 -6.9 和-6.6 eV,其值随着管径的增大而增大.相反,[C2MIM]+在三种不同管径的碳纳米管中LUMO 能量分别为-5.0、-5.0 和-4.9 eV,其能量值变化较小.最后,计算得到[C2MIM]+在三种不同管径的碳纳米管中的能隙分别为2.3、1.9 和1.7 eV,其值随着管径的增加,呈减小趋势.
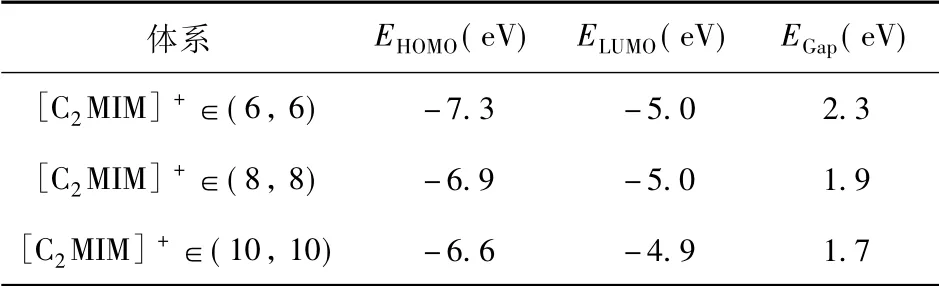
表2 [C2 MIM]+ 在三种管径的碳纳米管中的HOMO 和LUMO 轨道能量和能隙Table 2 HOMO and LUMO energies and energy gaps of[C2 MIM]+ in three carbon nanotubes with different diameters
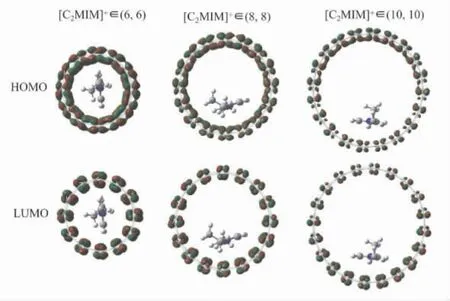
图2 [C2 MIM]+在三种管径的碳纳米管中的分子轨道分布Fig.2 Molecular orbital distributions of[C2MIM]+ in three carbon nanotubes with different diameters
4 总 结
本文采用密度泛函理论方法系统考察了[C2MIM]+在(6,6) 、(8,8) 和( 10,10) 三种管径的碳纳米管中的稳定结构、相互作用能和分子轨道性质.研究发现,随着碳纳米管管径的增加,[C2MIM]+从碳纳米管居中的位置越发靠近其管壁,且[C2MIM]+的咪唑环平面与碳纳米管的管壁相平行, [C2MIM]+与碳纳米管之间存在显著的π-π 相互作用.[C2MIM]+在管径为(6,6) 、(8,8) 和(10,10) 的相互作用能分别为 -45.5、-40.8 和-39.5 kcal/mol.可以看到,随着碳纳米管管径的增加, [C2MIM]+与碳纳米管的相互作用能减弱,并趋于稳定值.我们分析了研究体系的HOMO 和LUMO 分子轨道性质,发现研究体系的分子前线轨道均由局域在碳纳米管上,与[C2MIM]+无关,这表明[C2MIM]+与碳纳米管之间的作用方式为弱的范德华相互作用.本研究有助于人们从分子水平上理解咪唑类离子液体与碳纳米管之间的相互作用机制.
