右美托咪定通过调控LncRNA HOXA11-AS/miR-515-5p抑制膀胱癌细胞增殖并诱导细胞凋亡
2022-03-04刘建秀袁晓斌
刘建秀 袁晓斌
(1济南市第三人民医院麻醉科,山东 济南 250101;2青岛市中医医院(青岛市海慈医院)疾控科)
膀胱癌是临床常见恶性肿瘤之一,其具有极强的侵袭性及转移能力〔1〕,目前关于膀胱癌发病机制尚未阐明。研究表明部分抗肿瘤药物可用于治疗膀胱癌,但患者易产生耐药性而降低治疗效果〔2〕。因而需深入探究膀胱癌发病机制并寻求安全高效的治疗药物从而提高膀胱癌治疗效果。研究表明部分麻醉相关药物对肿瘤细胞生长及转移过程发挥重要调控作用〔3〕。右美托咪定(Dex)属于选择性α2-肾上腺受体激动剂,其具有良好的镇静、镇痛等作用,研究表明Dex可抑制卵巢癌生长〔4,5〕。长链非编码RNA(LncRNA)在肿瘤发生过程中发挥重要作用,研究报道指出长链非编码RNA HOXA11-AS(LncRNA HOXA11-AS)在非小细胞肺癌中呈高表达,可调控细胞增殖、侵袭、凋亡〔6,7〕。但HOXA11-AS在膀胱癌发生过程中的作用机制尚未阐明。starbase预测HOXA11-AS与微小RNA-515-5p(miR-515-5p)可能存在结合位点,研究表明miR-515-5p在前列腺癌中的具有抗癌作用〔8〕。本研究主要探讨Dex对膀胱癌细胞增殖、凋亡及HOXA11-AS/miR-515-5p的影响。
1 材料与方法
1.1材料与试剂 Dex购自湖北金梭生物;膀胱癌T24细胞购自上海晶抗生物;si-HOXA11-AS、si-NC、miR-515-5p mimics、miR-NC购自上海GenePharma;pcDNA3.1购自上海柯雷生物;四甲基偶氮唑蓝(MTT)、二抗购自北京百奥莱博;凋亡试剂盒购自上海美吉生物;Trizol、反转录及SYBR荧光染料试剂盒均购自日本TaKaRa;Lipofectamine2000购自美国Invitrogen。
1.2方法
1.2.1Dex处理与实验分组 膀胱癌T24细胞用不同浓度(25、50、100、200 ng/ml)的Dex处理T24细胞24 h,分别记作25 ng/ml Dex组、50 ng/ml Dex组、100 ng/ml Dex组、200 ng/ml Dex组〔9〕。未进行药物处理的T24细胞作为NC组。观察HOXA11-AS低表达与miR-515-5p高表达对T24细胞增殖和凋亡的影响,取对数期T24细胞,分别将si-NC、si-HOXA11-AS、miR-NC、miR-515-5p mimics转染至T24细胞,分别记为si-NC组、si-HOXA11-AS组、miR-NC组、miR-515-5p组。转染时严格按照Lipofectamine2000说明书进行操作。分别将pcDNA-NC、pcDNA-HOXA11-AS、pcDNA-HOXA11-AS与miR-NC、pcDNA-HOXA11-AS与miR-515-5p mimics转染至T24细胞后加入含有100 ng/ml Dex的培养液培养24 h,分别记为Dex+pcDNA-NC组、Dex+pcDNA-HOXA11-AS组、Dex+pcDNA-HOXA11-AS+miR-NC组、Dex+pcDNA-HOXA11-AS+miR-515-5p组。
1.2.2实时荧光定量聚合酶链反应(qRT-PCR)检测细胞中HOXA11-AS、miR-515-5p的表达水平 收集si-NC组、si-HOXA11-AS组、miR-NC组、miR-515-5p组、Dex+pcDNA-NC组、Dex+pcDNA-HOXA11-AS组、Dex+pcDNA-HOXA11-AS+miR-NC组、Dex+pcDNA-HOX A11-AS+miR-515-5p组细胞,采用Trizol法提取T24细胞总RNA,利用反转录试剂盒进行RNA的反转录,制备cDNA。qRT-PCR反应体系及反应程序均按照SYBR荧光染料试剂盒说明书进行操作,应用美国ABI StepOnePlus实时荧光定量PCR仪检测HOXA11-AS、miR-515-5p相对表达量。
1.2.3MTT检测细胞存活率 收集NC组、25 ng/ml Dex组、50 ng/ml Dex组、100 ng/ml Dex组、200 ng/ml Dex组T24细胞接种至96孔板(5×103个/孔),加入 MTT试剂(20 μl/孔),继续培养,4 h后将上清替换为150 μl DMSO,检测490 nm处T24细胞的相对吸光度值(OD)。
1.2.4流式细胞术检测细胞凋亡 收集各组对数生长期T24细胞磷酸盐缓冲液(PBS)清洗,按照凋亡检测试剂说明书操作并检测细胞凋亡率。
1.2.5荧光素酶报告基因检测HOXA11-AS与miR-515-5p的靶向关系 starbase预测显示HOXA11-AS与miR-515-5p存在互补配对结合位点。将野生型WT-HOXA11-AS载体、突变型MUT-HOXA11-AS载体分别与miR-NC、miR-515-5p mimics严格按照Lipofectamine2000说明书,共转染T24细胞。继续培养48 h后,检测T24细胞荧光素酶活性。
1.2.6Western印迹检测细胞周期蛋白(Cyclin)D1、活化的含半胱氨酸的天科氨酸蛋白水解酶(C-caspase)-3蛋白表达 各组膀胱癌T24细胞加入RIPA裂解液获得总蛋白,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,转膜,封闭,4℃加入CyclinD1(1∶1 000)、C-caspase-3(1∶800)一抗稀释液(美国CST)孵育12 h,室温加入二抗(1∶3 000)孵育1 h,滴加ECL发光剂后,于避光环境曝光显影,应用ImageJ软件分析CyclinD1、C-caspase-3条带灰度值。
1.3统计学处理 采用SPSS21.0软件进行t检验、单因素方差分析。
2 结 果
2.1Dex对T24细胞增殖的影响 25、50、100、200 ng/ml Dex处理后,膀胱癌T24细胞存活率〔(88.27±8.82)%、(72.11±7.21)%、(54.28±5.43)%、(52.11±5.21)%〕相较于NC组〔(100.96±10.11%)〕明显降低(P<0.05),且呈剂量依赖性(均P<0.005),100 ng/ml Dex组与200 ng/ml Dex组T24细胞存活率差异无统计学意义(P>0.05),因而选用100 ng/ml Dex进行后续实验研究。
2.2Dex对T24细胞凋亡的影响 相较于NC组,100 ng/ml Dex组膀胱癌T24细胞凋亡率和C-caspase-3蛋白相对表达量均显著升高(P<0.05),见图1、图2、表1。

图1 流式细胞仪检测100 ng/ml Dex处理的T24细胞凋亡

图2 Western印迹检测100 ng/ml Dex处理的T24细胞中C-caspase-3蛋白表达

表1 100 ng/ml Dex对T24细胞凋亡及HOXA11-AS表达的影响
2.3Dex对HOXA11-AS和miR-515-5p表达的影响 与NC组比较,100 ng/ml Dex组膀胱癌T24细胞中HOXA11-AS表达水平显著降低(P<0.05),miR-515-5p表达水平显著升高(P<0.05),见表1。
2.4HOXA11-AS低表达对T24细胞增殖和凋亡的影响 与si-NC组比较,si-HOXA11-AS组HOXA11-AS的表达水平、细胞存活率显著降低(P<0.05)。si-HOXA11-AS组T24细胞凋亡率显著高于si-NC组(P<0.05)。与si-NC组相比,si-HOXA11-AS组T24细胞中CyclinD1蛋白相对表达量显著降低(P<0.05),C-caspase-3蛋白相对表达量显著升高(P<0.05),见图3、表2、图4。

图3 流式细胞仪检测HOXA11-AS低表达后的T24细胞凋亡


图4 Western印迹检测CyclinD1、C-caspase-3蛋白表达
2.5miR-515-5p高表达对T24细胞增殖和凋亡的影响 miR-515-5p组T24细胞中miR-515-5p的表达水平显著高于miR-NC组(P<0.05)。miR-515-5p组T24细胞存活率较miR-NC组显著降低(P<0.05),细胞凋亡率较miR-NC组显著升高(P<0.05),CyclinD1蛋白相对表达量较miR-NC组显著降低(P<0.05),C-caspase-3蛋白相对表达量较miR-NC组显著升高(P<0.05),见图5、图6、表3。
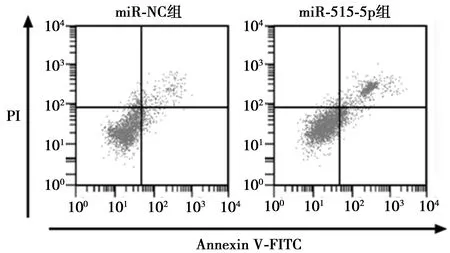
图5 流式细胞仪检测miR-515-5p高表达后T24细胞凋亡

图6 各组CyclinD1、C-caspase-3蛋白表达

2.6HOXA11-AS靶向调控miR-515-5p的表达 HOXA11-AS与miR-515-5p的靶向结合通过StarBase预测,见图7。miR-515-5p mimics与野生型载体WT-HOXA11-AS共转染T24细胞的荧光素酶活性相较于miR-NC与野生型载体WT-HOXA11-AS共转染T24细胞显著降低(P<0.05);miR-515-5p mimics与突变型载体MUT-HOXA11-AS共转染T24细胞的荧光素酶活性相比于miR-NC与突变型载体MUT-HOXA11-AS共转染T24细胞差异无统计学意义(P>0.05),见表4。si-HOXA11-AS组膀胱癌T24细胞中miR-515-5p的表达水平(2.86±0.28)显著高于si-NC组(1.02±0.12,P<0.05);pcDNA-HOXA11-AS组膀胱癌T24细胞中miR-515-5p的表达水平(0.40±0.04)显著低于pcDNA-NC组(1.00±0.11,P<0.05)。

图7 StarBase对HOXA11-AS和miR-515-5p结合进行预测示意

表4 miR-NC或miR-515-5p与报告质粒共转染T24细胞后双荧光素酶活性检测
2.7HOXA11-AS高表达可以逆转Dex对T24细胞增殖和凋亡的影响 与Dex+pcDNA-NC组比较,Dex+pcDNA-HOXA11-AS组T24细胞中HOXA11-AS的表达水平、细胞存活率及CyclinD1蛋白水平显著升高(P<0.05),凋亡率及C-caspase-3蛋白水平显著降低(P<0.05),见图8、图9、表5。

图8 流式细胞仪检测HOXA11-AS高表达和Dex作用的T24细胞凋亡

1,2:Dex-pcDNA-NC组,Dex+pcDNA-HOXA11-AS组图9 Western印迹检测各组CyclinD1、C-caspase-3蛋白表达
2.8高表达miR-515-5p可以逆转HOXA11-AS高表达对Dex处理的T24细胞增殖和凋亡的影响 与Dex+pcDNA-HOXA11-AS+miR-NC组比较,Dex+pcDNA-HOXA11-AS+miR-515-5p组细胞存活率及CyclinD1蛋白水平显著降低(P<0.05),凋亡率及C-caspase-3蛋白水平显著升高(P<0.05),见表6、图10、图11。


1,2:Dex-pcDNA-HOXA11-AS+miR-NC组,Dex-pcDNA-HOXA11-AS+miR-515-5p组;下图同图10 流式细胞仪检测高表达miR-515-5p、HOXA11-AS高表达和Dex作用的T24细胞凋亡
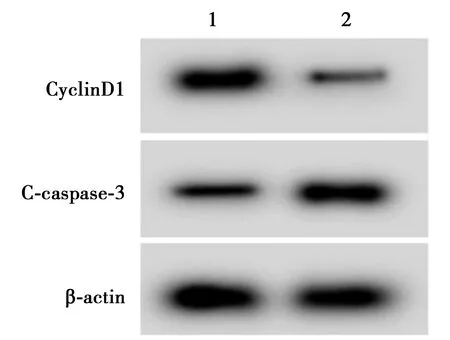
图11 Western印迹检测CyclinD1、C-caspase-3蛋白表达
3 讨 论
研究表明LncRNA在膀胱癌中异常表达并可参与肿瘤细胞增殖、迁移及侵袭等过程,进一步研究显示LncRNA可能通过调控下游miRNA表达从而发挥作用〔10,11〕。Dex可诱导卵巢癌细胞凋亡及抑制细胞增殖、迁移及侵袭能力〔12〕。研究表明Dex在乳腺癌发生发展过程发挥重要调控作用〔13〕。相关报道指出Dex可抑制宫颈癌细胞增殖及迁移〔14〕。本研究结果提示Dex可抑制膀胱癌细胞增殖、诱导凋亡。
HOXA11-AS在胃癌细胞中呈高表达,并可促进胃癌细胞增殖及侵袭〔15〕。研究表明HOXA11-AS通过充当miR-125a-5p的海绵分子促进骨肉瘤转移〔16〕。本研究结果提示Dex可能通过下调HOXA11-AS的表达而发挥作用。本研究证实HOXA11-AS能够靶向调控miR-515-5p的表达。miR-515-5p在乳腺癌、非小细胞肺癌中呈低表达并可促进细胞增殖〔17,18〕。
