外泌体介导miR-199a-3p靶向ARPC2基因对肾癌细胞增殖、迁移和侵袭的影响
2022-03-04樊松强张红森汤尧
樊松强 张红森 汤尧
(1漯河市第二人民医院泌尿外科,河南 漯河 462000;2新乡市中心医院泌尿外科;3西安航天总医院泌尿外科)
外泌体是细胞分泌的可以在细胞间传递的一种囊泡,其内包含miRNA、mRNA和蛋白等多种有生物活性的成分,是一类重要的细胞间通信分子,外泌体传输特异性miRNA可能在肿瘤的发病过程中发挥了重要作用,在肾癌等泌尿系统恶性肿瘤的发病机制以及诊疗上有很大的应用前景〔1,2〕。研究发现miR-199a可抑制肾癌细胞增殖,促进肿瘤细胞凋亡〔3〕。miR-199a-3p能诱导肾癌细胞周期G1期阻滞,抑制细胞侵袭,表明miR-199a-3p可作为肾癌诊断、预后判断和治疗的潜在靶点〔4〕。肌动蛋白相关蛋白2/3复合亚基(ARPC)2是肌动蛋白相关蛋白2/3复合体(ARP2/3)家族中的一员,研究发现ARPC2在胃癌组织中高表达,促进胃癌细胞的增殖和侵袭,与肿瘤大小、淋巴结浸润和肿瘤分期显著相关〔5〕。ARPC2在上皮性卵巢癌中高表达,抑制ARPC2的表达抑制了细胞的迁移和增殖〔6〕。本实验探索外泌体介导miR-199a-3p对肾癌细胞恶性行为的影响,分析其机制是否与ARPC2有关。
1 材料与方法
1.1细胞与试剂 肾小管上皮细胞HK-2和肾癌细胞786-O购自上海斯信生物科技有限公司;荧光定量试剂盒、RNA提取试剂盒、反转录试剂盒购自日本TaKaRa公司;二甲基亚砜(DMSO)、二喹啉甲酸(BCA)试剂盒、RIPA蛋白裂解液购自Sigma公司;外泌体分离纯化试剂盒购自上海生博生物医药科技有限公司;四甲基偶氮唑蓝(MTT)试剂盒购自上海信裕生物科技有限公司;miR-NC、miR-199a-3p、anti-miR-NC、anti-miR-199a-3p、si-NC、si-ARPC2、pcDNA-NC、pcDNA-ARPC2、野生型(WT)-ARPC2、突变型(MUT)-ARPC2质粒购自北京源生思创生物科技有限公司;LipofectamineTM2000转染试剂购自美国Invitrogen公司;双荧光素酶报告基因检测试剂盒购自北京Solarbio公司;抗体购自上海煊翎生物科技有限公司;Transwell小室、基质胶购自美国BD公司。
1.2方法
1.2.1细胞培养及外泌体提取 HK-2和786-O细胞用含10%胎牛血清DMEM培养基于37℃、5%CO2培养箱中培养,每天换液1次。待HK-2和786-O细胞密度融合至70%左右时将培养液换成去除外泌体的DMEM培养液培养48 h,收集细胞培养上清液,3 000 r/min离心20 min,去除细胞和细胞碎片,上清液用0.22 μm的滤器过滤,加入外泌体分离纯化试剂混匀后4℃过夜,1 500 r/min离心30 min,去上清,沉淀即为富集的外泌体,用无菌磷酸盐缓冲液(PBS)重悬备用。取重悬的外泌体滴在直径为2 mm的铜网上,用滤纸将多余液体从边缘吸去,将20 μl的2%磷钨酸盐滴在铜网上,室温下复染10 min,蒸馏水清洗2次后用滤纸吸除多余液体,将铜网于白炽灯下烤干,透射电镜下于80 kV下观察外泌体形态,并拍摄电镜照片。
1.2.2过表达miR-199a-3p细胞外泌体中miR-199a-3p的表达及外泌体表面标志物CD63、CD81表达水平 将miR-NC、miR-199a-3p转染至786-O细胞后用去除外泌体的DMEM培养液培养48 h,提取外泌体。实时荧光定量-聚合酶链反应(qRT-PCR)检测miR-199a-3p表达水平:提取RNA后将其反转录成cDNA,随后进行荧光定量PCR,每个样品设3个重复。miR-199a-3p的相对表达量用2-△△Ct法计算。Western印迹检测外泌体表面标志物CD63、CD81表达水平:取80 μg相应外泌体,加入蛋白裂解液,吹打混匀后冰上孵育30 min,于4℃条件下1 000 r/min离心30 min,取上清,定量变性。经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离、湿法转膜后,用5%脱脂奶粉封闭膜,然后加入1∶1 000稀释一抗4℃孵育过夜,TBST洗膜后,用1∶2 000稀释二抗室温孵育1.5 h,TBST洗涤,用电化学(ECL)发光液显影。ChemiDoc XRS+系统成像后,Quantity One分析软件处理,测定各组蛋白条带的相对吸光度。每个蛋白样品设3个重复。
1.2.3细胞转染和分组 将miR-NC、miR-199a-3p转染至786-O细胞中后加入外泌体进行培养,记为EXO-miR-NC组、EXO-miR-199a-3p组;将miR-199a-3p分别与pcDNA-NC、pcDNA-ARPC2共转染至786-O细胞中后加入外泌体进行培养,记为EXO-miR-199a-3p+pcDNA-NC组、EXO-miR-199a-3p+pcDNA-ARPC2组。将miR-NC、anti-miR-NC、miR-199a-3p、anti-miR-199a-3p、si-ARPC2、si-NC分别转染至786-O细胞中,分别记为miR-NC组、anti-miR-NC组、miR-199a-3p组、anti-miR-199a-3p组、si-ARPC2组、si-NC组。
1.2.4qRT-PCR检测786-O细胞中miR-199a-3p表达水平 各组培养48 h后提取总RNA,参照1.2.2步骤进行逆转录和qRT-PCR。
1.2.5Western印迹检测786-O细胞中细胞周期蛋白(Cyclin)D1、基质金属蛋白(MMP)-2、MMP-9、ARPC2蛋白表达水平 各组细胞培养48 h后提取总蛋白,按照1.2.2步骤检测蛋白表达。
1.2.6MTT检测细胞存活率 各组细胞培养至48 h时加入20 μl的MTT溶液,37℃孵育4 h;弃培养液,加入150 μl DMSO后振荡溶解甲瓒,用酶标仪检测在490 nm各孔吸光度(OD)值。每次设3个复孔,实验重复3次。细胞存活率(%)=实验组OD值/空白对照组OD值×100%。
1.2.7Transwell检测细胞迁移和侵袭 用无血清培养基重悬各组细胞培养48 h后细胞调整为5×104个/ml细胞悬液。取200 μl接种于涂覆基质胶Transwell上室(侵袭检测)或未涂覆基质胶的Transwell上室(迁移检测)。下室加入600 μl含10%胎牛血清培养液,培养48 h后取出小室,弃去上室培养液,用棉签轻轻擦去上层细胞,PBS洗涤,4%多聚甲醛固定30 min,0.1%结晶紫染色10 min,显微镜观察并拍照,计算结晶紫染色细胞数即为迁移或侵袭细胞数。
1.2.8荧光素酶报告实验检测miR-199a-3p对ARPC2的靶向调控 构建含有miR-199a-3p结合位点ARPC2-3′UTR野生型及突变型报告基因载体WT-ARPC2、MUT-ARPC2,在786-O细胞中转染miR-199a-3p+WT-ARPC2、miR-199a-3p+MUT-ARPC2、miR-NC+WT-ARPC2、miR-NC+MUT-ARPC2。48 h后测定荧光素酶活性,实验结果以荧光素酶活性和Renilla活性的比值表示,实验重复3次。
1.3统计学分析 采用SPSS20.0软件进行t检验、单因素方差分析。
2 结 果
2.1miR-199a-3p在肾癌细胞来源的外泌体中表达情况 提取肾小管上皮细胞HK-2和肾癌细胞786-O培养基中的外泌体,透射电子显微镜下观察两者形态均为典型外泌体结构,有完整双层脂膜包被的杯口状的囊泡样结构(图1)。与肾小管上皮细胞HK-2 miR-199a-3p表达水平(1.00±0.12)相比,肾癌细胞786-O外泌体(0.35±0.04)显著降低(P<0.05)。表明肾癌细胞来源的外泌体中miR-199a-3p低表达。
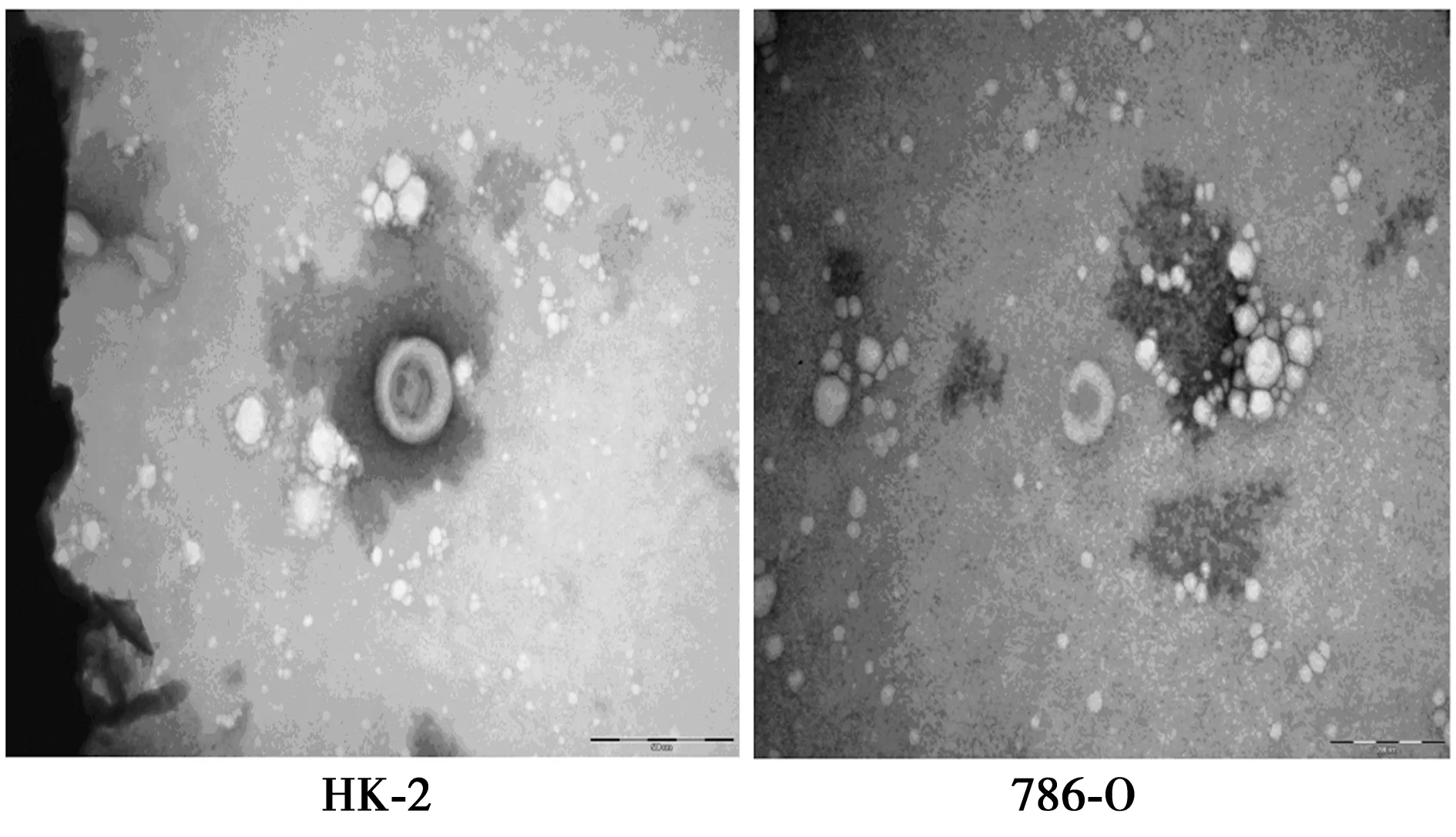
图1 电镜观察HK-2、786-O细胞系外泌体的形态(×400)
2.2外泌体中miR-199a-3p表达情况 miR-199a-3p组外泌体中miR-199a-3p表达水平显著高于miR-NC组(P<0.001)。见图2、表1。

图2 Western印迹检测CD63、CD81蛋白表达

表1 外泌体中miR-199a-3p表达情况
2.3外泌体介导miR-199a-3p对肾癌细胞786-O增殖、迁移和侵袭的影响 EXO-miR-199a-3p组肾癌细胞786-O中miR-199a-3p表达水平显著高于EXO-miR-NC组,CyclinD1、MMP-2和MMP-9、ARPC2表达水平显著低于EXO-miR-NC组,细胞存活率、迁移数和侵袭数显著低于EXO-miR-NC组(均P<0.001)。见图3,表2。表明外泌体介导miR-199a-3p抑制肾癌细胞786-O增殖、迁移和侵袭。
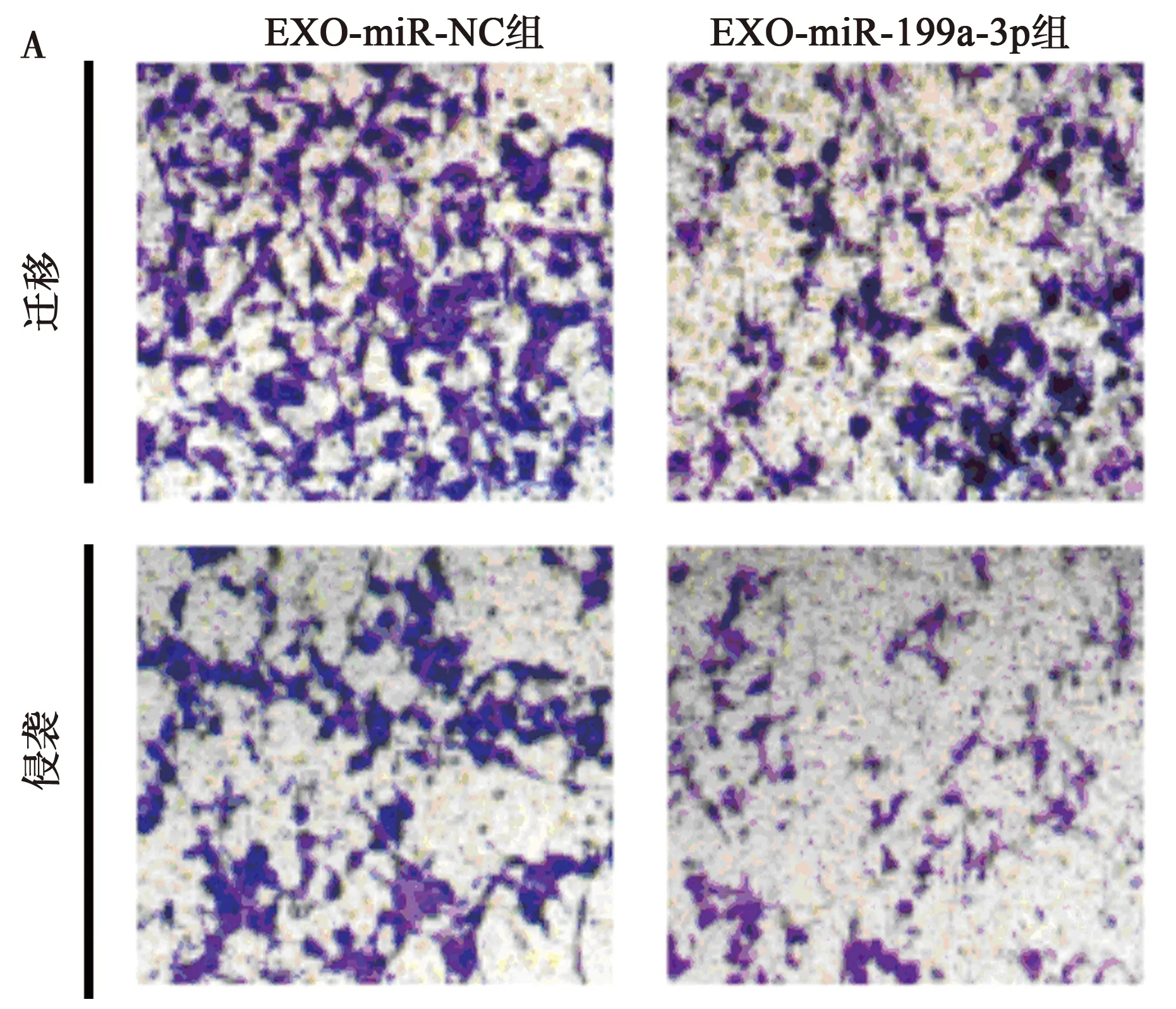
A:Transwell检测786-O的迁移和侵袭(结晶紫染色,×200);B:Western印迹检测CyclinD1、MMP-2和MMP-9蛋白的表达

2.4敲减ARPC2对肾癌细胞786-O增殖、迁移和侵袭的影响 与si-NC组相比,si-ARPC2组肾癌细胞786-O中CyclinD1、MMP-2、MMP-9和ARPC2表达水平显著低于si-NC组,细胞存活率、迁移数和侵袭数显著低于si-NC组(P<0.05)。见图4、表3。表明敲减ARPC2抑制肾癌细胞786-O增殖、迁移和侵袭。
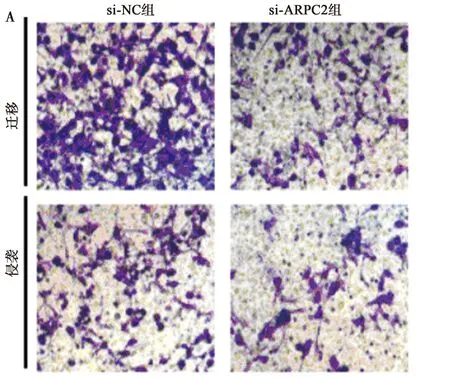
A:Transwell检测786-O的迁移和侵袭(结晶紫染色,×200);B:Western印迹检测ARPC2、CyclinD1、MMP-2和MMP-9蛋白的表达

2.5miR-199a-3p靶向ARPC2 StarBase预测ARPC2与miR-199a-3p存在结合位点,见图5。相较于miR-NC组,miR-199a-3p组转染WT-ARPC2的细胞786-O的荧光素酶活性显著降低(P<0.001);而转染MUT-ARPC2表达载体的细胞786-O的荧光素酶活性差异不显著(P>0.05),见表4。miR-199a-3p组ARPC2表达水平(0.43±0.05)显著低于miR-NC组(0.98±0.10,P<0.05);anti-miR-199a-3p组ARPC2表达水平(1.28±0.13)显著高于anti-miR-NC组(0.96±0.11,P<0.05),见图6,表明miR-199a-3p可靶向调控ARPC2的表达。
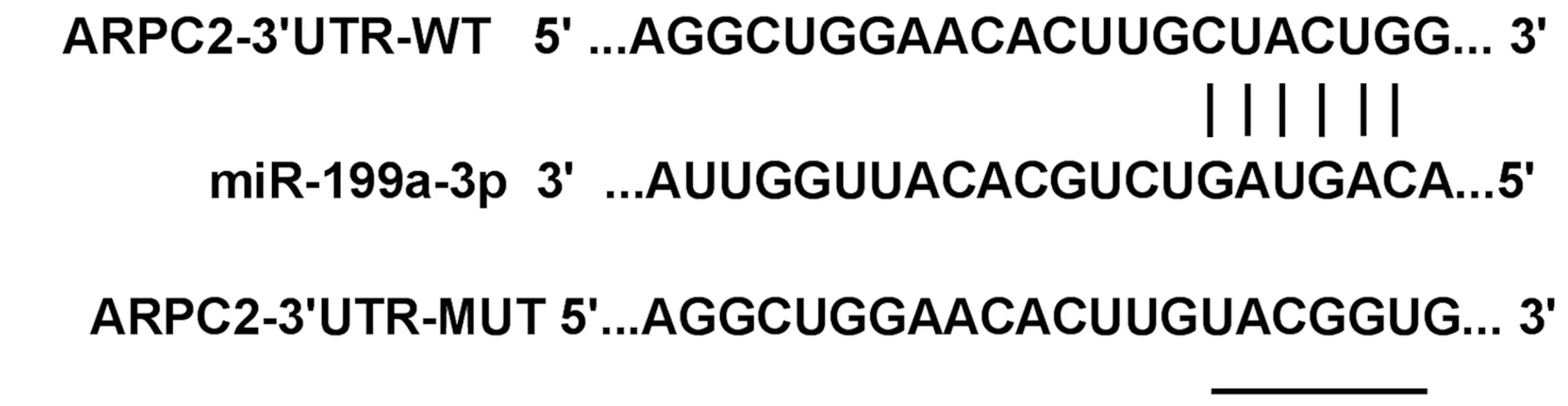
图5 StarBase对miR-199a-3p和ARPC2结合进行预测示意图

表4 双荧光素酶活性检测
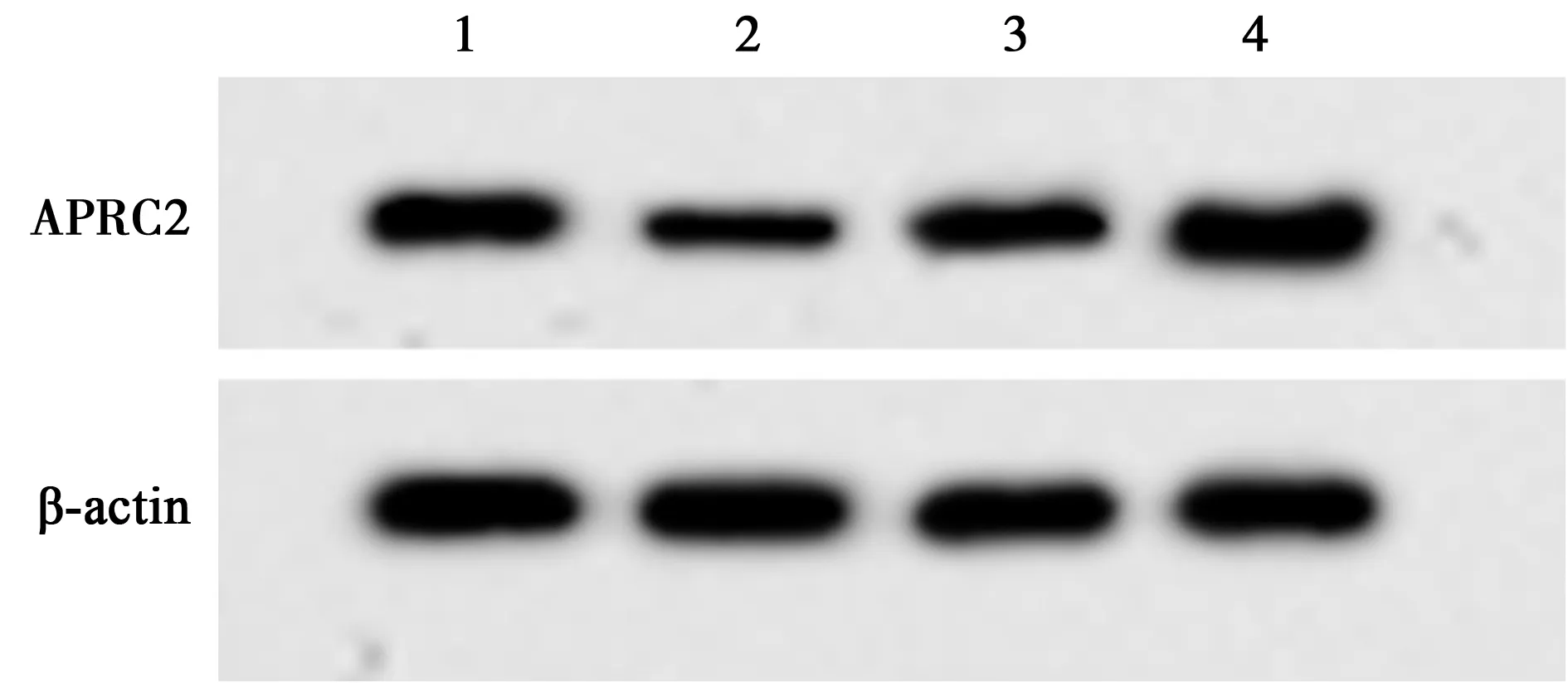
1~4:miR-NC组,miR-199a-3p组,anti-miR-NC组,anti-miR-199a-3p组图6 Western印迹检测ARPC2表达量
2.6高表达ARPC2可以部分逆转外泌体介导的miR-199a-3p对786-O增殖、迁移和侵袭的影响EXO-miR-199a-3p+pcDNA-ARPC2组786-O细胞中CyclinD1、MMP-2、MMP-9和ARPC2表达水平显著高于EXO-miR-199a-3p+pcDNA-NC组,细胞存活率、迁移数、侵袭数显著高于EXO-miR-199a-3p+pcDNA-NC组(P<0.05)。见图7、表5、图8。表明高表达ARPC2可以部分逆转外泌体介导的miR-199a-3p对786-O增殖、迁移和侵袭的抑制作用。
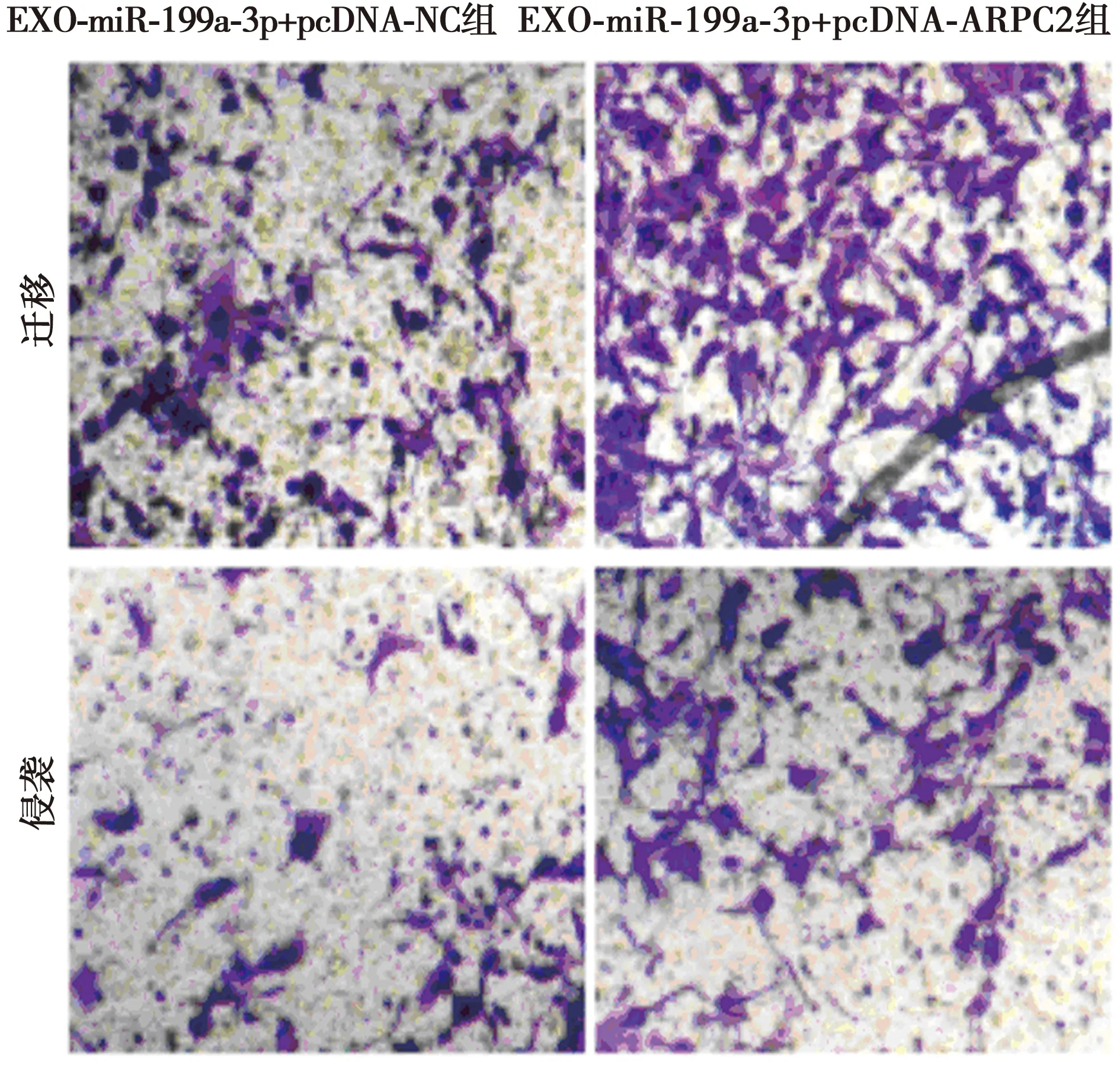
图7 Transwell检测786-O的迁移和侵袭(结晶紫染色,×200)


1,2:EXO-miR-199a-3p+pcDNA-NC组,EXO-miR-199a-3p+pcDNA-ARPC2组图8 Western印迹检测ARPC2、CyclinD1、MMP-2和MMP-9蛋白的表达
3 讨 论
肾癌发病率和死亡率均较高,严重危害人类身体健康,肿瘤晚期多数伴有癌细胞转移,导致预后不良,寻找其早期标志物以实现早期诊断、早期治疗具有重要意义〔7〕。外泌体是细胞分泌的小囊泡,可调节受体细胞的信号通路而发挥生物学作用,在泌尿系统恶性肿瘤中不仅促进癌细胞的增殖、转移、侵袭以及血管生长,可作为泌尿系统恶性肿瘤的发生、发展及预后的生物标志物,还可作为递送RNA、化疗药物以及制备肿瘤疫苗的载体用于恶性肿瘤的治疗〔8〕。研究报道miR-210在肾癌患者血清外泌体中明显高表达,血清外泌体miR-210水平可作为肾透明细胞癌早期诊断的标志物〔9〕。miR-199a-3p在肾透明细胞癌组织中低表达,miR-199a-3p过表达影响肾透明细胞癌细胞生长、集落形成、细胞侵袭、细胞迁移和细胞凋亡〔10〕。p53诱导miR-199a-3p抑制顺铂诱导急性肾脏损伤〔11〕。以上结果表明miR-199a-3p对肾癌具有抑癌作用。有研究发现人骨髓间充质干细胞的外泌体可通过将miR-199a-3p转运至肾细胞,下调Sema3A表达并从而激活丝氨酸/苏氨酸激酶(AKT)和细胞外调节蛋白激酶(ERK)途径来保护肾缺血/再灌注损伤〔12〕。本研究结果说明过表达miR-199a-3p可以提高癌细胞外泌体中miR-199a-3p的水平。CyclinD1是细胞周期的正调控因子,其低表达可阻滞细胞周期发挥抗增殖功能〔13〕;MMP-2和MMP-9是基质金属蛋白酶家族重要成员,其低表达减少细胞外基质的降解,进而抑制迁移和侵袭〔14〕。说明外泌体介导的miR-199a-3p可抑制肾癌细胞增殖、迁移和侵袭。
ARPC2是ARP2/3的一员,而ARP2/3复合物与人胶质瘤细胞迁移和侵袭有关,ARPC2可能也与肿瘤的迁移、侵袭相关〔15〕。苯丙哌林是ARPC2抑制剂,可抑制癌细胞迁移和肿瘤转移,说明抑制ARPC2表达可抑制癌细胞迁移和转移〔16〕。ARPC2在乳腺癌癌组织中高表达,可促进乳腺癌的增殖和转移;且与肿瘤分期、淋巴结转移和患者的总体存活高度相关〔17〕。沉默ARPC2抑制了过氧化氢诱导的血管平滑肌细胞迁移〔18〕。本研究结果说明敲减ARPC2可抑制肾癌细胞增殖、迁移和侵袭;外泌体介导的miR-199a-3p可能通过调控ARPC2影响肾癌细胞恶性表型。
