STIL 在神经胶质瘤中的表达及对基因组稳定的影响
2022-03-04钟锰王晓娇王君刘畅朱彬王鹤李英夫何伟明
钟锰 王晓娇 王君 刘畅 朱彬 王鹤 李英夫 何伟明
(1内蒙古民族大学附属医院神经外科,内蒙古 通辽 028007;2内蒙古医科大学基础医学院;3佳木斯大学第一附属医院神经外科)
神经胶质瘤的发病涉及一系列相关基因和蛋白表达水平的改变,包括癌基因活化及抑癌基因的抑制。癌症基因组图谱计划通过对206例神经胶质瘤临床样本大规模遗传学分析发现神经胶质瘤中众多基因发生突变,主要涉及3条信号通路:酪氨酸激酶受体RTK/RAS/PI3K通路、p53通路及RB信号通路。其中,p53通路通过以p53为核心的调控网络监控DNA损伤,募集损伤蛋白以维持基因组的完整性,P53的失活与神经胶质瘤的发生密切相关〔1〕。此外,随着非编码RNA领域的研究不断深入,报道发现长链非编码RNA、miRNAs也参与了胶质瘤的发生发展过程〔2~5〕。然而,尽管神经胶质瘤发病机制的研究取得了一些进展,但目前仍未全面揭示其发病的具体机制,临床也无有效的肿瘤标志物。因此,神经胶质瘤发生的机制仍需进一步阐明,寻找新型特异性肿瘤标志物对于预测胶质瘤的预后和复发至关重要。中心体是细胞中的主要细胞器之一,在进化上高度保守。一个中心体包括2个中心粒及其周围的中心粒周围物质,参与有丝分裂过程中纺锤体的组装及细胞分裂。近年来,越来越多的研究发现在肿瘤细胞中观察到中心体异常。染色体不稳定性和中心体扩增异常是肿瘤细胞普遍具有的特征,通常出现在肿瘤发生的早期阶段,这为肿瘤的早期诊断和治疗提供了新的途径〔6~8〕。作为一种癌基因,STIL(SCL/TAL1 interrupting locus)与生物体内中心体的生成、复制及细胞有丝分裂密切相关。因此,本文旨在前期工作的基础上,深入研究STIL在神经胶质瘤发生发展中的生物学功能及意义,为神经胶质瘤的临床诊疗提供可能的生物学指标。
1 材料和方法
1.1细胞系 神经胶质瘤细胞系SHG-44、U87、SWO-38及U251 与神经胶质细胞系NHA。分别利用免疫组织化学(IHC)、实时定量聚合酶链反应(q-PCR)及蛋白质(Western)印迹技术检测STIL在神经胶质瘤细胞系SHG-44、U87、SWO-38及U251 与神经胶质细胞系NHA样本中的表达情况。
1.2瞬转细胞系构建 根据STIL在不同细胞系中表达,选取STIL高表达细胞系(U87细胞)及STIL低表达细胞系(U251细胞),分别采用siRNA干扰技术及过表达技术,瞬时转染siRNA及STIL过表达载体pcDNA3.1,建立STIL低表达/过表达细胞系。
1.3CCK8检测干扰和过表达STIL后对胶质瘤细胞增殖能力的影响 siRNA干扰技术敲低STIL的表达水平后,利用CCK8试验及克隆集落形成实验检测STIL低表达对胶质瘤细胞U87细胞增殖能力的影响;然后在胶质瘤细胞系U251中瞬时过表达pcDNA3.1-STIL载体,CCK8实验及克隆集落形成实验检测STIL过表达对胶质瘤细胞生长情况的影响。
1.4流式细胞术 检测STIL过表达/敲低细胞系对胶质瘤细胞基因组稳定性及细胞凋亡的影响。
1.5细胞培养 SHG-44、U87、SWO-38及U251与神经胶质细胞系NHA。在含有100 ml/L胎牛血清(FBS)、100 U/ml青霉素和100 μg/ml链霉素DMEM培养基中,在37℃、5%CO2培养箱中培养。
1.6Western印迹 使用RIPA裂解液裂解所收集细胞;提取细胞蛋白后采用二喹啉甲酸(BCA)法检测蛋白浓度; 采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)对蛋白进行电泳分离后转膜至聚偏氟乙烯(PVDF)膜上;使用脱脂牛奶封闭 2 h;于4 ℃冰箱温育一抗过夜;采用洗膜缓冲液(TBST)洗膜后温育二抗2 h;使用电化学发光(ECL)曝光液曝光。
1.7统计学处理 使用SPSS25.0软件和GraphPad Prism7.0软件进行分析。NCAPD2表达与临床病理学特征的相关性分析采用χ2检验和Fisher 精确检验分析法。在UCSC Xena数据库中应用单因素方差分析NCAPD2基因在神经胶质瘤组织中的表达情况。在LinkedOmics数据库中应用Pearson相关性分析与NCAPD2基因呈相关性的基因。
2 结 果
2.1STIL在不同神经胶质瘤细胞系中表达 STIL在胶质瘤细胞系中高表达,在NHA细胞中为1.0,在U251细胞中为1.70~1.80,SHG-44中为2.11~2.21,SWD-38中为2.15~2.65。其中在U87细胞中表达最高为3.45~3.65。
2.2Western印迹技术检测干扰后STIL的表达 在低表达细胞系U251细胞中构建STIL过表达细胞系,在高表达U87细胞中构建STIL低表达细胞系后,Western印迹检测干扰后STIL的表达变化,结果显示低表达/过表达细胞系构建成功。见图1。
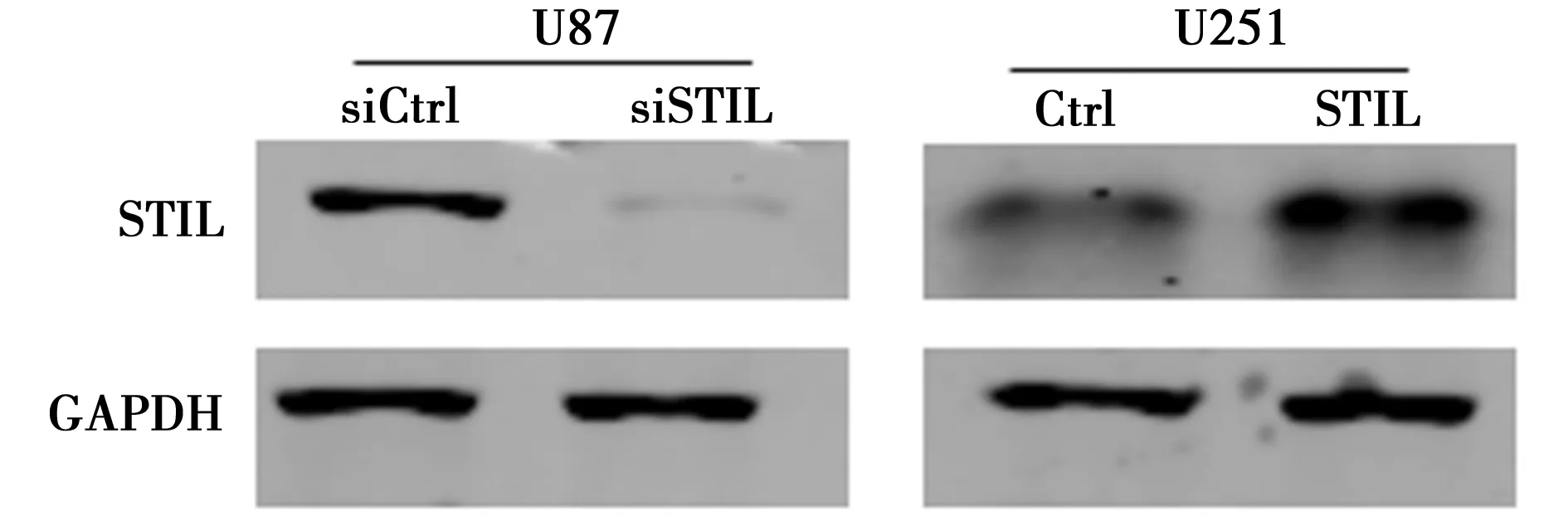
图1 Western印迹技术检测干扰后STIL的表达
2.3CCK8检测干扰和过表达STIL后对胶质瘤细胞增殖能力的影响 两组U87 细胞和U251细胞第1天增殖活力无显著差异(P>0.05);第2天后,STIL干扰组 U87 细胞增殖活力显著低于对照组;STIL干扰组 U251 细胞增殖活力显著高于对照组(P<0.05)。见表1、2。
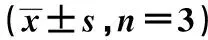
表1 STIL干扰组低对U87细胞增殖活力的影响
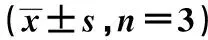
表2 STIL过表达组低对U251细胞增殖活力的影响
2.4细胞周期检测干扰和过表达STIL后对胶质瘤细胞周期的影响 U87细胞中干扰STIL促进G0/G1期细胞阻滞;而U251细胞中过表达STIL可以降低G0/G1期细胞数。见表3、4。
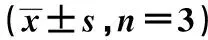
表3 STIL干扰组对细胞周期G0/G1期的影响
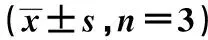
表4 STIL过表达组对细胞周期G0/G1期的影响
2.5流式细胞术检测干扰和过表达STIL后对胶质瘤细胞凋亡的影响 STIL干扰组U87细胞凋亡率〔(17.01±0.81)%〕显著高于对照组〔(5.88±0.67)%;t=14.851,P<0.000 1〕,说明U87细胞中干扰STIL促进细胞凋亡;STIL过表达组U251细胞凋亡率〔(2.967±0.09)%〕显著低于对照组〔(4.930±0.26)%;t=9.957,P<0.000 6〕,说明U251细胞中过表达STIL可以抑制细胞凋亡。
3 讨 论
研究发现在细胞分裂过程中,STIL与其结合蛋白相互作用,确保中心体复制的保真性以减少染色体不稳定性的发生〔9〕。中心体数目或结构异常能够影响细胞分裂过程,而STIL在维持增殖细胞中心体完整性方面至关重要。研究表明在多种预后不良的肿瘤中STIL存在异常表达,包括肺癌、结肠癌及卵巢癌等〔10~12〕。更甚,STIL的表达水平与多种肿瘤的转移潜能密切相关〔12〕。STIL发挥着原癌基因的作用,通过促进纺锤体缺陷引发染色体不稳定性,最终导致肿瘤发生〔13〕。另外,大量文献报道STIL参与调控音猬因子(SHH)信号通路也可能与肿瘤发生发展相关〔14〕。在胰腺癌中过表达STIL可抑制丝氨酸/苏氨酸蛋白激酶抑制剂(SUFU)介导的GLI1蛋白表达,而敲低STIL可逆转上述表型。STIL过表达促进GLI家族锌指蛋白(GLI)1转录活性增强,而GLI1的表达水平上调能够促进细胞持续增殖、细胞死亡抗性、血管生成及基因组不稳定性。因此,学者们推测STIL的过表达通过调控GLI1的功能进而引发癌变〔15〕。作为癌基因,STIL为预后做出更准确的评估及进行分子靶向治疗提供了可能。有报道指出通过抑制STIL能够有效增强DNA损伤化疗药物在治疗卵巢癌中的功效〔11〕。
本课题组前期研究发现干扰STIL后,p27的表达水平显著上调。P27一般在G0/G1期升高,并在细胞有丝分裂后迅速降解,从而解除对细胞周期蛋白(cyclin)E/周期蛋白依赖性激酶(Cdk)2的抑制状态,允许细胞周期进展〔16〕。p27的减少废除了对细胞周期从G1期到S期的过渡进行适当的控制,会导致不受控制的细胞生长和增殖,该机制与乳腺癌、前列腺癌、结肠癌、肺癌等多种癌症的发生相关〔17~20〕。翻译后修饰,特别是通过泛素蛋白酶体介导的蛋白水解,在正常细胞周期和病理条件下对p27蛋白丰度的调节有重要作用。本文结果表明,STIL过表达可通过影响细胞G0/G1期而改变了神经胶质细胞系的基因组稳定性,STIL过表达可抑制细胞凋亡,促进肿瘤发生。
综上,神经胶质瘤中STIL呈高表达,并参与细胞周期及 DNA修复等过程,有望成为神经胶质瘤诊疗的新分子靶标。
